2019浙教版中考科学复习-化学-6、酸碱盐综合复习1
文档属性
| 名称 | 2019浙教版中考科学复习-化学-6、酸碱盐综合复习1 |  | |
| 格式 | zip | ||
| 文件大小 | 576.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-13 21:59:46 | ||
图片预览


文档简介
浙教版中考复习化学-6、酸碱盐综合复习1
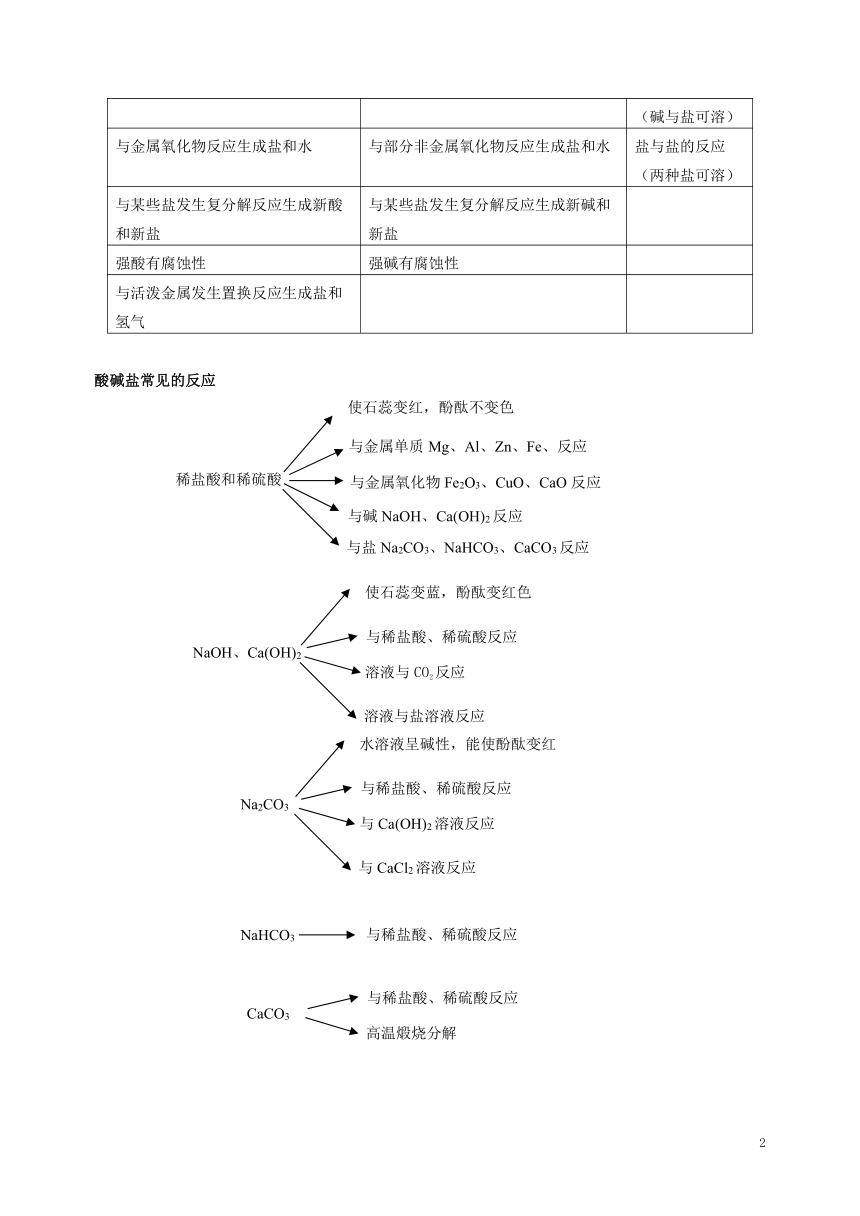
1.常见的酸碱盐
常见的酸 常见的碱 常见的盐
盐酸 硫酸 氢氧化钠 氢氧化钙 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
HCl H2SO4 NaOH Ca(OH)2 NaCl Na2CO3 NaHCO3 CaCO3
俗称 火碱、烧碱、苛性钠 熟石灰、消石灰 食盐 苏打、纯碱 小苏打
特性 浓盐酸:易挥发(瓶口有白雾) 浓硫酸:溶于水放出大量的热,具有吸水性,脱水性 易潮解,具有强腐蚀性 微溶于水,有较强腐蚀性 有咸味 水溶液显碱性 水溶液显碱性,受热分解 难溶于水,受热分解
用途 除锈 除锈,化工原料 制肥皂、造纸等 用于改良酸性土壤 调味剂 制洗涤剂、制玻璃等 发酵粉主要成分 大量用于建筑
2.酸碱盐的性质
酸的共性 碱的共性 盐的共性
组成上都含有氢元素,电离时阳离子都为氢离子 组成上都含有氢氧元素,电离时阴离子都为氢氧根离子 电离时阳离子为金属离子,阴离子为酸根离子
溶液的pH小于7(注意显酸性的不一定为酸溶液) 溶液的pH大于7(注意显碱性的不一定为碱溶液) 金属与某些盐溶液反应
能使酸碱指示剂变色(使紫色石蕊试液变红色,使无色酚酞试液不变色) 能使酸碱指示剂变色(使紫色石蕊试液变蓝色,使无色酚酞试液变红色) 酸与某些盐反应
与碱发生中和反应生成盐和水 与酸发生中和反应生成盐和水 碱与某些盐反应(碱与盐可溶)
与金属氧化物反应生成盐和水 与部分非金属氧化物反应生成盐和水 盐与盐的反应(两种盐可溶)
与某些盐发生复分解反应生成新酸和新盐 与某些盐发生复分解反应生成新碱和新盐
强酸有腐蚀性 强碱有腐蚀性
与活泼金属发生置换反应生成盐和氢气
酸碱盐常见的反应
3.几种反应的概念
中和反应:酸与碱作用生成盐和水的反应,叫做中和反应
置换反应:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
复分解反应:两种化合物相互交换成分,生成另外两种新的化合物的反应叫做复分解反应。复分解反应的条件是产物有水、气体或沉淀生成。中和反应是复分解反应的一种。
4.溶液酸碱度的表示方法—pH
pH=7,呈中性溶液
pH<7,显酸性溶液,pH越小酸性越强
pH>7,呈碱性溶液,pH越大碱性越强
酸碱盐性质
【例1】 下列各组属于同一物质的是( )
A. 冰和干冰 B. 火碱和烧碱
C. 熟石灰和生石灰 D. 小苏打和苏打
【答案】B
【例2】物质存放在烧杯中一段时间后,质量增大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④食盐 ⑤生石灰 ⑥稀硫酸
A.①⑥ B.②③⑤ C.③⑤ D.②③④
【答案】C
【例3】为验证下列化学变化的发生,需要滴加指示剂才能观察到实验现象的是( )
A. 向石灰石中滴加盐酸 B. 向氧化铁中滴加硫酸
C. 向水中通入二氧化碳 D. 向石灰水中通入二氧化碳
【答案】C
【例4】右图中甲、乙、丙是3种不同类别的物质,且均能与X发生化学反应。若X
为稀盐酸,则甲、乙、丙3种物质可能为( )
A. Fe、CuO、Cu(OH)2 B. Fe、CaCO3、Na2CO3
C. Zn、Fe2O3、Na2SO4 D. Cu、Ca(OH)2、CaCO3
【答案】A
【例5】下列实验方案中,不能证明氢氧化钠溶液与稀盐酸发生了反应的是( )
A. 向一定量的氢氧化钠溶液中通入二氧化碳后再滴加稀盐酸,有气体生成
B. 向装有一定量氢氧化钠溶液的烧杯中滴几滴酚酞溶液,再不断滴入稀盐酸
C. 用pH试纸测氢氧化钠溶液pH,再滴加稀盐酸,pH逐渐降低,最终小于7
D. 向装有少量稀盐酸的试管中滴加足量氢氧化钠溶液,再向其中滴加碳酸钠溶液
【答案】A
pH的应用
【例6】下图表示的是一些物质在常温下的近似pH。下列有关这些物质的说法正确
的是( )
A. 苹果汁的酸性大于酸雨的酸性 B. 厨房清洁剂的碱性小于小苏打水的碱性
C. 小苏打水不能用于治疗胃酸过多 D. 酸雨呈酸性的主要原因是溶有二氧化碳
【答案】A
【例7】有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),张华同学查资料得知苯甲酸的
酸性比醋酸强,可用做食品防腐剂.下列对苯甲酸性质的推测中不合理的是( )
A. 苯甲酸溶液的pH小于7
B. 苯甲酸溶液只能与可溶性的碱发生反应
C. 苯甲酸溶液能使紫色石蕊试液变红
D. 苯甲酸溶液不能使无色酚酞试液变色
【答案】B
【例8】下图是收集某气体的装置。由实验装置推测该气体的有关性质可能正确的
是( )
A B C D
密度比空气 大 大 小 小
溶于水中所得溶液的pH >7 <7 >7 <7
【答案】C
推理类
【例9】推理是化学学习中常用的思维方法。下列推理正确的是 ( )
A.酸能使紫色石蕊溶液变红。通入CO2后的紫色石蕊溶液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
D.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
【答案】C
【例10】科学探究中常用到推理的方法。根据下列实验事实,推出的结论正确的是( )
A. 若某物质中只含有一种元素,则该物质一定是单质
B. 若某溶液使紫色石蕊溶液变红,则该溶液一定显酸性
C. 若反应中有盐和水生成,则该反应一定是置换反应
D. 若某溶液使无色酚酞溶液变红,则该溶液一定是碱溶液
【答案】B
【例11】氢氧化铝[Al(OH)3]受热易分解,产生水并吸收热量,故可用作阻燃
剂;能与盐酸、NaOH溶液反应,是药物“复方胃舒平”的主要成分之一。实验室制备Al(OH)3
方法为:
Al2(SO4)3 + 6NH3?H2O == 2Al(OH)3↓ + 3(NH4)2SO4,通常不选用NaOH。下列判断不正
确的是( )
A.氢氧化铝的化学性质稳定
B.复方胃舒平可用于治疗胃酸过多症
C.氢氧化铝可灭火的原因之一是降低了可燃物的温度
D.实验室不用NaOH溶液制备Al(OH)3,因为NaOH会与Al(OH)3反应
【答案】A
信息类
【例12】某些金属氢化物与水反应可生成碱和氢气,如CaH2 + 2H2O=Ca(OH)2 +2H2 ↑。CaH2与足量
Na2CO3溶液之间发生反应的产物有( )
A. Ca(OH)2 和H2 B. NaOH 和Ca(OH)2
C. CaCO3、NaOH 和H2 D. Ca(OH)2 、CaCO3和H2
【答案】C
【例13】生活中常有误食亚硝酸钠(NaNO2)中毒事件的报道,这是因为亚硝酸钠外观酷似食盐且有咸味;工业用盐中常混有亚硝酸钠,有关氯化钠和亚硝酸钠的部分资料如下表:
化学式 酸碱性 热稳定性 与稀盐酸的 反应现象 与硝酸银溶液的反应现象
氯化钠 中性 受热不分解 无明显变化 生成白色沉淀
亚硝酸钠 弱碱性 320℃以上会分解 放出刺激性气体 放出红棕色气体 无明显变化
如要检验食盐样品中有无亚硝酸钠,下列判定方法不正确的是 ( )
A. 用pH试纸测定食盐样品溶液的酸碱性
B. 取少量食盐样品加热到320℃以上,观察有无刺激性气体放出
C. 取少量食盐样品,向其中加入盐酸,观察有无红棕色气体放出
D. 取少量食盐样品加水溶解,加入硝酸银溶液观察有无白色沉淀
【答案】D
【例14】将下列溶液分别滴入氢氧化钠溶液、饱和石灰水和稀盐酸中,能呈现三种不同现象的是
( )
A. FeCl3 B.MgCl2 C.Na2CO3 D.酚酞
【答案】C
【例15】欲将含有盐酸的氯化钙溶液调至中性,得到氯化钙溶液,在没有指示剂的情况下,应加入的
试剂是( )
A. Na2CO3 B. CaO C. Ca(OH)2 D. CaCO3
【答案】D
【例16】用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑
浊。针对此现象,同学们提出了自己的想法。
[查资料]稀盐酸与AgNO3溶液发生复分解反应,AgCl为白色且难溶于水。
[假设] 小明的假设:澄清石灰水已变质。
小白的假设:气体X中除了有CO2外,还有 。
[实验探究](1)小明的探究:
实验目的 实验步骤 可能的实验现象 化学方程式和实验结沦
探究所用 澄清石灰 水是否变 质 ①用一支试管另取少量原澄清石灰水②取稀硫酸与碳酸钠反应制取CO2③ 步骤③中现象为: 步骤②中反应方程式为: 实验结论:所用的澄清石灰水没有变质。
(2)小白的探究
实验目的 实验步骤 实验现象 化学方程式和实验结论
探究小白的假设是否成立 将气体X通入AgNO3溶液 反应方程式为: 实验结论:小白的假设成立
[实验反思]
(3)同学们经过讨论发现,用下面实验装置就可以同时完成上述两个假设的探究。
A B C
A、B中都加AgNO3溶液,通X气体后:如果A浑浊、B澄清、C浑浊,结论是 ;
如果看到 现象;小明和小白的假设都成立。
【答案】假设: HCl气体
(1) 小明的探究:
实验目的 实验步骤 可能的实验现象 化学方程式和实验结沦
探究所用澄清石灰水是否变质 ③将产生的气体通入所用澄清石灰水中 步骤③中现象为:澄清石灰水变浑浊 步骤②中反应方程式为: H2SO4+Na2CO3=Na2SO4+ H2O+CO2↑
(2)小白的探究
实验目的 实验步骤 实验现象 化学方程式和实验结论
探究小白的假设是否成立 将气体X通入AgNO3 溶液 有白色沉淀生成 反应方程式为: HCl+AgNO3=AgCl↓+HNO3
(3)X中有HCl杂质,石灰水未变质;A浑浊,B澄清,C澄清
【练习1】在A+B→盐+水的反应中,A、B分别是( )
A. 盐酸和熟石灰 B. 纯碱和熟石灰
C. 小苏打和盐酸 D. 熟石灰和烧碱
【答案】A
【练习2】煤燃烧产生的废气中含有SO2 ,用NaOH、Na2SO3溶液可将90%以上的SO2 吸收。涉及的
反应有:① 2NaOH+SO2=Na2SO3+H2O
② Na2SO3+SO2+H2O=2NaHSO3
③ NaHSO3+NaOH=Na2SO3+H2O
下列说法中,不正确的是 ( )
A. 反应②发生的是化合反应
B. 可循环使用的物质是Na2SO3
C. NaHSO3中硫元素的化合价是+6
D. 反应①说明SO2与CO2 有相似的化学性质
【答案】C
【练习3】向氢氧化钙的饱和溶液中加入下列物质,不可能使溶液的pH有明显改
变的是( )
A. 通入CO2 B. 加入稀H2SO4
C. 加入盐酸 D. 加入Na2CO3溶液
【答案】D
【练习4】化学反应有着广泛的应用。
(1)不能用铁质容器存放硫酸铜溶液,因为铁与硫酸铜溶液会发生化学反应,此反应中铜元
素的化合价由 变为 。
(2)实验室制取氢气反应的化学方程式是______。
(3)人的胃液里含有胃酸,若胃酸分泌过多会引起胃病。服用“胃舒平”(主要成分是氢氧
化铝)可缓解病痛。则该药用于治疗的化学原理是(用化学方程式表示)_____。
(4)做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加入适量的纯碱或小苏打等碱性
物质,它们相互作用产生了_____气体,使蒸出的馒头疏松多孔;若加入的碱性物质过
多,可向面团或蒸锅中添加的少许酸性厨房调味料是_____,以免蒸出的馒头口味涩且
发黄。
【答案】(1)+2、0 (2)Zn + H2SO4 = ZnSO4 + H2↑ (3)Al(OH)3 + 3HCl = AlCl3+ 3H2O
(4)二氧化碳 醋
酸碱盐基础知识
稀盐酸和稀硫酸
使石蕊变红,酚酞不变色
与金属单质Mg、Al、Zn、Fe、反应
与金属氧化物Fe2O3、CuO、CaO反应
与碱NaOH、Ca(OH)2反应
与盐Na2CO3、NaHCO3、CaCO3反应
NaOH、Ca(OH)2
使石蕊变蓝,酚酞变红色
与稀盐酸、稀硫酸反应
溶液与CO2反应
溶液与盐溶液反应
Na2CO3
水溶液呈碱性,能使酚酞变红
与稀盐酸、稀硫酸反应
与Ca(OH)2溶液反应
与CaCl2溶液反应
NaHCO3
与稀盐酸、稀硫酸反应
CaCO3
与稀盐酸、稀硫酸反应
高温煅烧分解
基础达标
某气体
NaOH
固体
能力提升
复习巩固
1
