人教版九年级化学下册11.1《 生活中常见的盐》课件
文档属性
| 名称 | 人教版九年级化学下册11.1《 生活中常见的盐》课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 807.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-18 00:00:00 | ||
图片预览



文档简介
11.1复分解反应及应用
一、回顾旧知识
3 Fe + 2 O2 点燃 Fe3O4
请用化学方程式表示图片中所发生的化学反应:
S + O2 点燃 SO2
4 P + 5 O2 点燃 2 P2O5
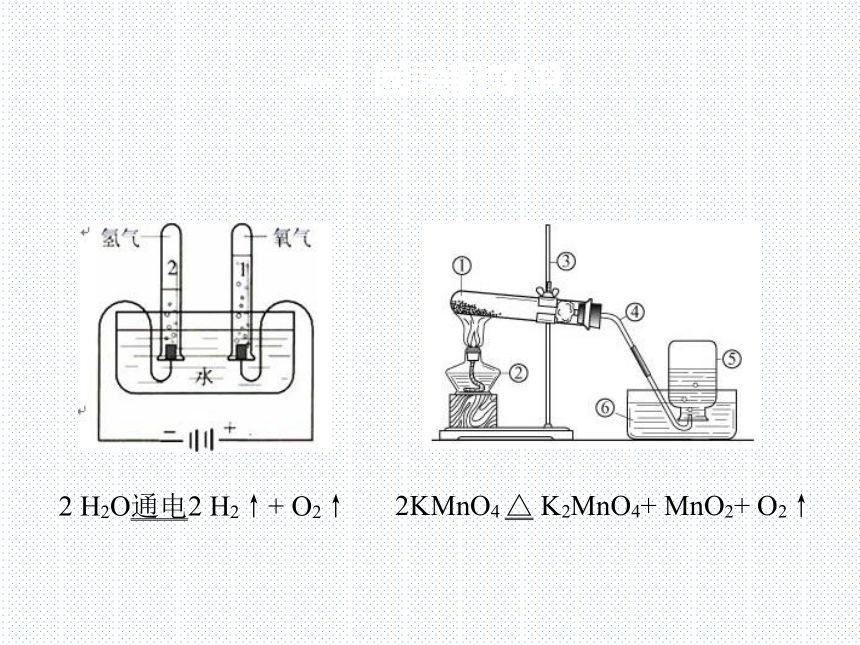
2KMnO4 △ K2MnO4+ MnO2+ O2↑
2 H2O通电2 H2↑+ O2↑
一、回顾旧知识
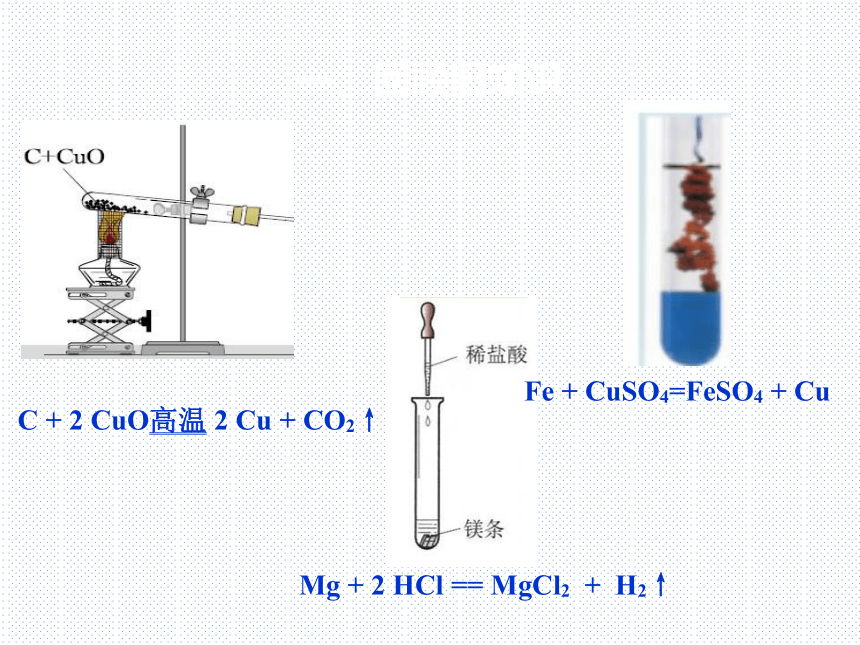
C + 2 CuO高温 2 Cu + CO2↑
Fe + CuSO4=FeSO4 + Cu
Mg + 2 HCl == MgCl2 + H2↑
一、回顾旧知识
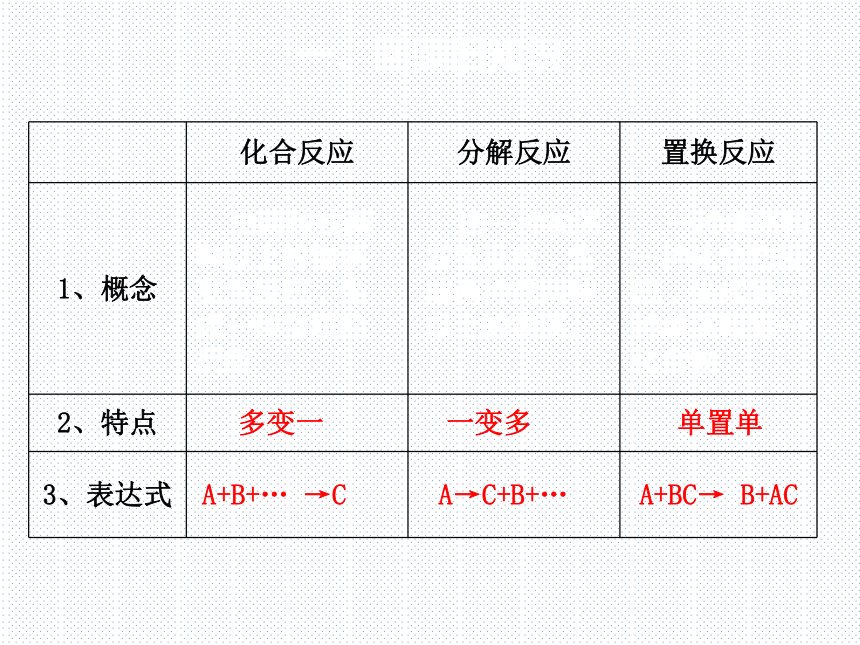
化合反应 分解反应 置换反应
1、概念
2、特点
3、表达式
由两种或两种以上的物质发生反应,生成一种物质的反应
多变一
A+B+… →C
由一种物质发生反应,生成两种或两种以上的物质。
一变多
A→C+B+…
一种单质和一种化合物反应,生成另一种单质和另一化合物
单置单
A+BC→ B+AC
一、回顾旧知识
二、建构复分解反应概念
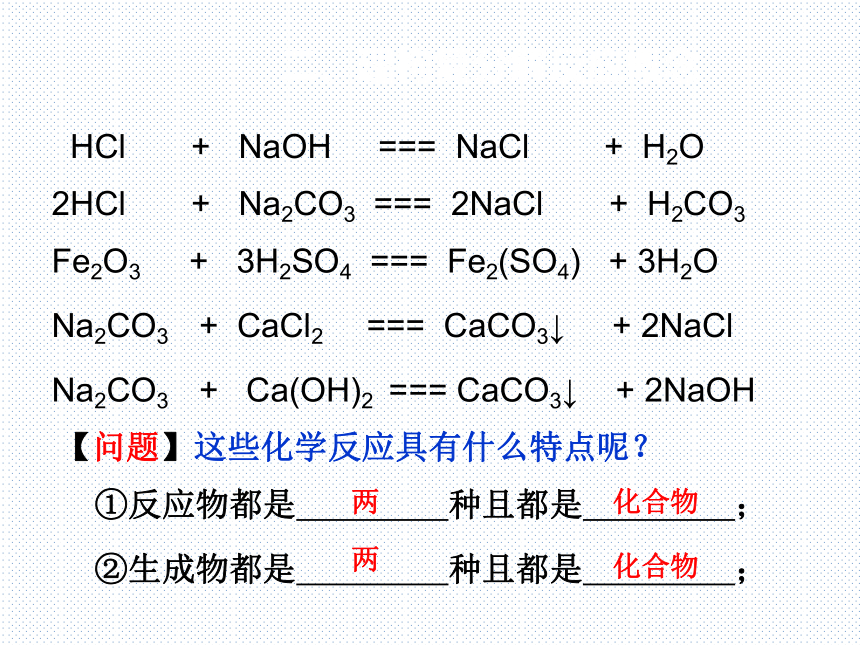
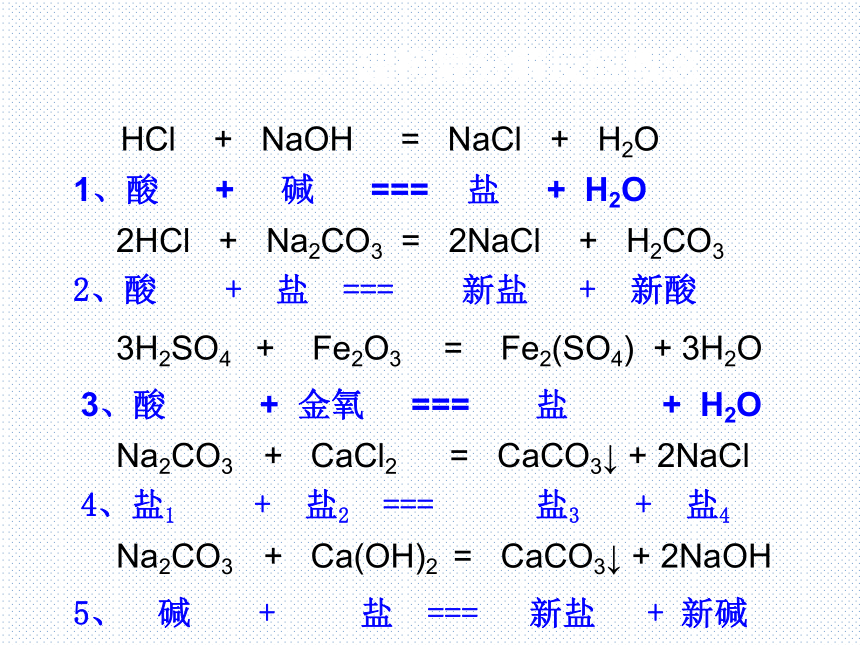
HCl + NaOH === NaCl + H2O
2HCl + Na2CO3 === 2NaCl + H2CO3
Fe2O3 + 3H2SO4 === Fe2(SO4) + 3H2O
Na2CO3 + CaCl2 === CaCO3↓ + 2NaCl
【问题】这些化学反应具有什么特点呢?
Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH
①反应物都是 种且都是 ;
②生成物都是 种且都是 ;
两
两
化合物
化合物
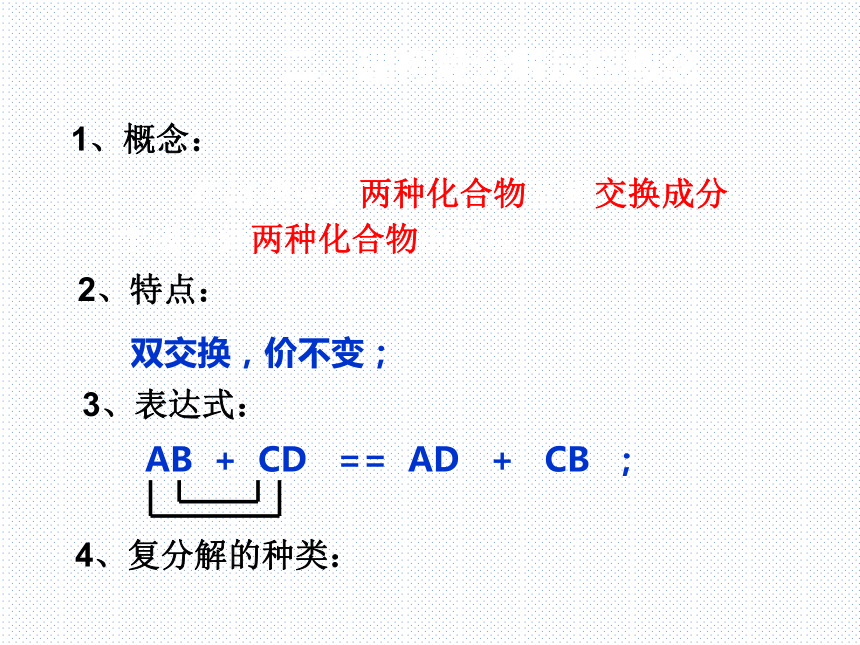
1、概念:
在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应。
2、特点:
双交换,价不变;
3、表达式:
AB + CD == AD + CB ;
4、复分解的种类:
二、建构复分解反应概念
1、下列属于复分解反应的是(反应条件已省略)( )
A.Fe + CuSO4=== FeSO4+ Cu
B.CaCO3====CaO+CO2↑
C.H2SO4+ 2NaOH====Na2SO4+2H2O
D.CH4 + 2O2==== CO2+2H2O
【限时检测】
HCl + NaOH = NaCl + H2O
2HCl + Na2CO3 = 2NaCl + H2CO3
3H2SO4 + Fe2O3 = Fe2(SO4) + 3H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
1、酸 + 碱 === 盐 + H2O
2、酸 + 盐 === 新盐 + 新酸
3、酸 + 金氧 === 盐 + H2O
5、 碱 + 盐 === 新盐 + 新碱
4、盐1 + 盐2 === 盐3 + 盐4
二、建构复分解反应概念
① CuSO4 + NaOH = ?
② CuSO4 + BaCl2 = ?
③ NaOH + KCl = ?
【口诀】复分解两头顾; 先顾头,后顾尾;
顾头要看溶解性,顾尾沉淀气体水;
【解释】条件1:反应物必须溶于水或溶于酸。
条件2:生成物中必须生成沉淀、气体或水;
三、复分解反应发生条件
钾钠铵盐水中溶;
盐酸盐除银亚汞;
碳酸盐类多沉淀,
【酸碱盐的溶解性】
硝酸盐入水无影踪;
硫酸钡铅水不溶;
碱有钾钠钡钙氨能溶;
不溶于酸的沉淀:
BaSO4、 AgCl
溶于酸产生气泡的沉淀:
CaCO3、BaCO3
能溶于酸的沉淀:
Cu (OH)2、
Fe (OH)3
例1:CuSO4 + BaCl2 = ?
第1步:先看反应物的溶解性;有酸溶于酸,无酸溶
于水;
CuSO4 BaCl2
溶
溶
第2步:反应物满足条件后,再看生成物。生成物中
必须要有沉淀或气体或水中之一。
BaSO4 CuCl2
不溶
溶
三、复分解反应发生条件
例2: NaCl +K2CO3 = ?
溶
溶
KCl + Na2CO3
无沉淀、无气体、无水
例3: NaCl + BaSO4 = ?
例4: HCl + CaCO3 = ?
溶
不溶
溶
不溶于水,但能溶于酸
H2CO3 + CaCl2
H2O + CO2
三、复分解反应发生条件
【限时检测】
NaOH NaCl K2CO3 Ba(NO3)2
H2SO4
依据
√
×
√
√
有水生成
有气体生成
有沉淀生成
三、复分解反应发生条件
①Na2CO3 +BaCl2
②MgSO4 +KOH
③FeCl3 +Cu(OH)2
④NaCl +KNO3
⑤HCl +CaCO3
⑥Cu (OH)2 +HNO3
⑦AgCl +NaNO3
⑧NaCl +Cu(OH)2
⑨HCl +Mg(OH)2
⑩Na2SO4 +K2CO3
【限时检测】
三、复分解反应发生条件
【限时检测】
A.NaOH溶液和稀HNO3 B.AgCl和KNO3
C.CaCO3和稀HCl D.BaCl2溶液和稀H2SO4
1、下列各组物质不能发生化学反应的是( )
A.3个 B.4个 C.5个 D.6个
2、今有氯化钡、碳酸钠、硝酸银和盐酸四种溶液,将它们
两两混合,能生成沉淀的反应的个数是( )
三、复分解反应发生条件
【限时检测】
A.C?? CuO??? H2SO4(稀) B.Ba(OH)2 HCl K2CO3
C.Fe? HCl(稀) ?CuSO4 D.CO2 Ca(OH)2 HCl(稀)
3、下列各组物质两两之间都能互相发生化学反应的是( )
A.①②④ B.②④⑤ C.③④⑤ D.①②③
4、下列各组溶液,相互能发生反应的是( )
①碳酸钠和氯化钙??????②氢氧化钾和盐酸??③硫酸和氯化钠
④碳酸钾和硝酸?? ⑤硫酸铜和氯化铵.
三、复分解反应发生条件
(1)用恰当的化学方程式表示图中的化学反应:
;
(2)用离子方程式表示图中的化学反应:
;
HCl + NaOH === ;
NaCl + H2O
H+ + OH- = H2O
四、复分解反应的实质
离子与离子之间的反应;
【小结】复分解反应是实质是 ;
(1)用恰当的化学方程式表示图中的化学反应:
;
(2)用离子方程式表示图中的化学反应:
;
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
SO42-+ Ba2+ ====BaSO4 ↓
补充:离子与离子反应的条件
若离子与离子能结合成沉淀、
气体、水,则离子能反应;
【分析】Na+ 与Cl—能发生反应吗?
【分析】Ba2+ 与SO42-能发生反应吗?
【解答】Na+ 与Cl—能结合成NaCl, 但NaCl不是
沉淀,所以Na+ 与Cl—不能反应。
【解答】Ba2+与SO42-能结合成BaSO4 , BaSO4
是沉淀,所以Ba2+与SO42-能反应。
四、复分解反应的实质
H+
OH-
CO32-
Ba2+
SO42-
Ag+
Cl-
Mg2+
Cu2+
Fe3+
NH4+
注:Na+、K+、NO3-不与任何离子反应;
四、复分解反应的实质
五、离子共存问题
【例1】下列各组离子能共存的是( )
A. Ba2+、K+、NO3-、CO32-、H+
B. K+、Cl-、Mg2+、NO3-、H+
C. Fe3+、SO42-、OH-、Na+、Cu2+
D. Ag+、Ba2+、Cl-、NO3-、K+
【例2】下列离子可在同一溶液中大量共存,且形成无色溶液
的一组是( )
A. K+、Na+、OH-、Cl- B. Ba2+、Cu2+、NO3-、Cl-
C. Mg2+、Na+、OH-、SO42- D. H+、Ba2+、NO3-、OH-
五、离子共存问题
【例3】下列离子能在pH=13的水溶液中大量共存的是( )
A.SO42-、Cl-、Na+、H+ B.K+、SO42-、Cu2+、N03-
C.Cl-、K+、SO42-、Na+ D. Ca2+、Cl-、CO32-、Na+
【例4】在pH=1的无色透明溶液中不能大量共存的离子组是
( )
A.Al3+ Ag+ NO3- Cl- B.Mg2+ Na+ NO3- Cl-
C.Ba2+ K+ CO32- Cl- D. K+ Na+ NO3- CO32-
一、回顾旧知识
3 Fe + 2 O2 点燃 Fe3O4
请用化学方程式表示图片中所发生的化学反应:
S + O2 点燃 SO2
4 P + 5 O2 点燃 2 P2O5
2KMnO4 △ K2MnO4+ MnO2+ O2↑
2 H2O通电2 H2↑+ O2↑
一、回顾旧知识
C + 2 CuO高温 2 Cu + CO2↑
Fe + CuSO4=FeSO4 + Cu
Mg + 2 HCl == MgCl2 + H2↑
一、回顾旧知识
化合反应 分解反应 置换反应
1、概念
2、特点
3、表达式
由两种或两种以上的物质发生反应,生成一种物质的反应
多变一
A+B+… →C
由一种物质发生反应,生成两种或两种以上的物质。
一变多
A→C+B+…
一种单质和一种化合物反应,生成另一种单质和另一化合物
单置单
A+BC→ B+AC
一、回顾旧知识
二、建构复分解反应概念
HCl + NaOH === NaCl + H2O
2HCl + Na2CO3 === 2NaCl + H2CO3
Fe2O3 + 3H2SO4 === Fe2(SO4) + 3H2O
Na2CO3 + CaCl2 === CaCO3↓ + 2NaCl
【问题】这些化学反应具有什么特点呢?
Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH
①反应物都是 种且都是 ;
②生成物都是 种且都是 ;
两
两
化合物
化合物
1、概念:
在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应。
2、特点:
双交换,价不变;
3、表达式:
AB + CD == AD + CB ;
4、复分解的种类:
二、建构复分解反应概念
1、下列属于复分解反应的是(反应条件已省略)( )
A.Fe + CuSO4=== FeSO4+ Cu
B.CaCO3====CaO+CO2↑
C.H2SO4+ 2NaOH====Na2SO4+2H2O
D.CH4 + 2O2==== CO2+2H2O
【限时检测】
HCl + NaOH = NaCl + H2O
2HCl + Na2CO3 = 2NaCl + H2CO3
3H2SO4 + Fe2O3 = Fe2(SO4) + 3H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
1、酸 + 碱 === 盐 + H2O
2、酸 + 盐 === 新盐 + 新酸
3、酸 + 金氧 === 盐 + H2O
5、 碱 + 盐 === 新盐 + 新碱
4、盐1 + 盐2 === 盐3 + 盐4
二、建构复分解反应概念
① CuSO4 + NaOH = ?
② CuSO4 + BaCl2 = ?
③ NaOH + KCl = ?
【口诀】复分解两头顾; 先顾头,后顾尾;
顾头要看溶解性,顾尾沉淀气体水;
【解释】条件1:反应物必须溶于水或溶于酸。
条件2:生成物中必须生成沉淀、气体或水;
三、复分解反应发生条件
钾钠铵盐水中溶;
盐酸盐除银亚汞;
碳酸盐类多沉淀,
【酸碱盐的溶解性】
硝酸盐入水无影踪;
硫酸钡铅水不溶;
碱有钾钠钡钙氨能溶;
不溶于酸的沉淀:
BaSO4、 AgCl
溶于酸产生气泡的沉淀:
CaCO3、BaCO3
能溶于酸的沉淀:
Cu (OH)2、
Fe (OH)3
例1:CuSO4 + BaCl2 = ?
第1步:先看反应物的溶解性;有酸溶于酸,无酸溶
于水;
CuSO4 BaCl2
溶
溶
第2步:反应物满足条件后,再看生成物。生成物中
必须要有沉淀或气体或水中之一。
BaSO4 CuCl2
不溶
溶
三、复分解反应发生条件
例2: NaCl +K2CO3 = ?
溶
溶
KCl + Na2CO3
无沉淀、无气体、无水
例3: NaCl + BaSO4 = ?
例4: HCl + CaCO3 = ?
溶
不溶
溶
不溶于水,但能溶于酸
H2CO3 + CaCl2
H2O + CO2
三、复分解反应发生条件
【限时检测】
NaOH NaCl K2CO3 Ba(NO3)2
H2SO4
依据
√
×
√
√
有水生成
有气体生成
有沉淀生成
三、复分解反应发生条件
①Na2CO3 +BaCl2
②MgSO4 +KOH
③FeCl3 +Cu(OH)2
④NaCl +KNO3
⑤HCl +CaCO3
⑥Cu (OH)2 +HNO3
⑦AgCl +NaNO3
⑧NaCl +Cu(OH)2
⑨HCl +Mg(OH)2
⑩Na2SO4 +K2CO3
【限时检测】
三、复分解反应发生条件
【限时检测】
A.NaOH溶液和稀HNO3 B.AgCl和KNO3
C.CaCO3和稀HCl D.BaCl2溶液和稀H2SO4
1、下列各组物质不能发生化学反应的是( )
A.3个 B.4个 C.5个 D.6个
2、今有氯化钡、碳酸钠、硝酸银和盐酸四种溶液,将它们
两两混合,能生成沉淀的反应的个数是( )
三、复分解反应发生条件
【限时检测】
A.C?? CuO??? H2SO4(稀) B.Ba(OH)2 HCl K2CO3
C.Fe? HCl(稀) ?CuSO4 D.CO2 Ca(OH)2 HCl(稀)
3、下列各组物质两两之间都能互相发生化学反应的是( )
A.①②④ B.②④⑤ C.③④⑤ D.①②③
4、下列各组溶液,相互能发生反应的是( )
①碳酸钠和氯化钙??????②氢氧化钾和盐酸??③硫酸和氯化钠
④碳酸钾和硝酸?? ⑤硫酸铜和氯化铵.
三、复分解反应发生条件
(1)用恰当的化学方程式表示图中的化学反应:
;
(2)用离子方程式表示图中的化学反应:
;
HCl + NaOH === ;
NaCl + H2O
H+ + OH- = H2O
四、复分解反应的实质
离子与离子之间的反应;
【小结】复分解反应是实质是 ;
(1)用恰当的化学方程式表示图中的化学反应:
;
(2)用离子方程式表示图中的化学反应:
;
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
SO42-+ Ba2+ ====BaSO4 ↓
补充:离子与离子反应的条件
若离子与离子能结合成沉淀、
气体、水,则离子能反应;
【分析】Na+ 与Cl—能发生反应吗?
【分析】Ba2+ 与SO42-能发生反应吗?
【解答】Na+ 与Cl—能结合成NaCl, 但NaCl不是
沉淀,所以Na+ 与Cl—不能反应。
【解答】Ba2+与SO42-能结合成BaSO4 , BaSO4
是沉淀,所以Ba2+与SO42-能反应。
四、复分解反应的实质
H+
OH-
CO32-
Ba2+
SO42-
Ag+
Cl-
Mg2+
Cu2+
Fe3+
NH4+
注:Na+、K+、NO3-不与任何离子反应;
四、复分解反应的实质
五、离子共存问题
【例1】下列各组离子能共存的是( )
A. Ba2+、K+、NO3-、CO32-、H+
B. K+、Cl-、Mg2+、NO3-、H+
C. Fe3+、SO42-、OH-、Na+、Cu2+
D. Ag+、Ba2+、Cl-、NO3-、K+
【例2】下列离子可在同一溶液中大量共存,且形成无色溶液
的一组是( )
A. K+、Na+、OH-、Cl- B. Ba2+、Cu2+、NO3-、Cl-
C. Mg2+、Na+、OH-、SO42- D. H+、Ba2+、NO3-、OH-
五、离子共存问题
【例3】下列离子能在pH=13的水溶液中大量共存的是( )
A.SO42-、Cl-、Na+、H+ B.K+、SO42-、Cu2+、N03-
C.Cl-、K+、SO42-、Na+ D. Ca2+、Cl-、CO32-、Na+
【例4】在pH=1的无色透明溶液中不能大量共存的离子组是
( )
A.Al3+ Ag+ NO3- Cl- B.Mg2+ Na+ NO3- Cl-
C.Ba2+ K+ CO32- Cl- D. K+ Na+ NO3- CO32-
同课章节目录
