2019高考全国Ⅰ卷理科综合化学模拟试题B(共30张PPT).ppt
文档属性
| 名称 | 2019高考全国Ⅰ卷理科综合化学模拟试题B(共30张PPT).ppt |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-19 00:00:00 | ||
图片预览





文档简介
2019高考全国Ⅰ卷理科综合化学模拟试题B
理科综合能力测试
化学部分 试题分析与备考指导
指导思想
根据普通高等学校对新生文化素质的要求,依据中华人民共和国教育部2003年颁布的《普通高中化学课程标准(实验)》和《2019年普通高等学校招生全国统一考试大纲(化学科)》,结合教学实际,确定化学科考试内容。考试内容包括知识和能力两个方面。
试题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
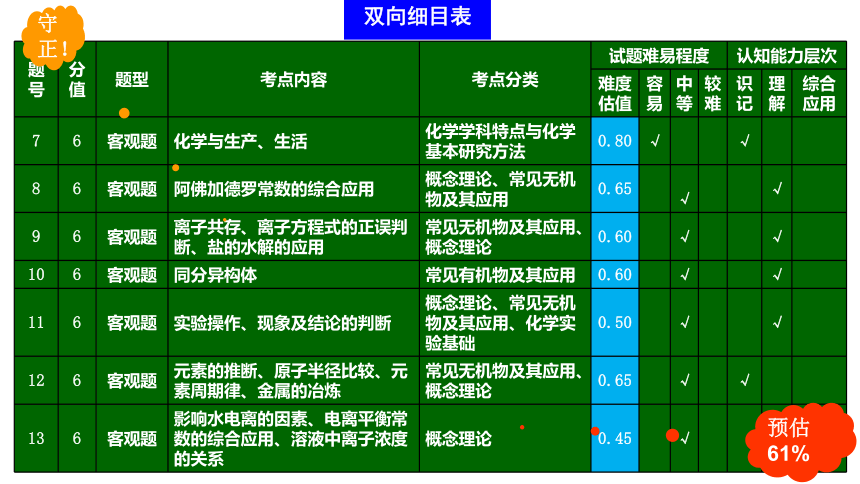
预估61%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
7 6 客观题 化学与生产、生活 化学学科特点与化学基本研究方法 0.80 √ √
8 6 客观题 阿佛加德罗常数的综合应用 概念理论、常见无机物及其应用 0.65 √ √
9 6 客观题 离子共存、离子方程式的正误判断、盐的水解的应用 常见无机物及其应用、概念理论 0.60 √ √
10 6 客观题 同分异构体 常见有机物及其应用 0.60 √ √
11 6 客观题 实验操作、现象及结论的判断 概念理论、常见无机物及其应用、化学实验基础 0.50 √ √
12 6 客观题 元素的推断、原子半径比较、元素周期律、金属的冶炼 常见无机物及其应用、概念理论 0.65 √ √
13 6 客观题 影响水电离的因素、电离平衡常数的综合应用、溶液中离子浓度的关系 概念理论 0.45 √ √
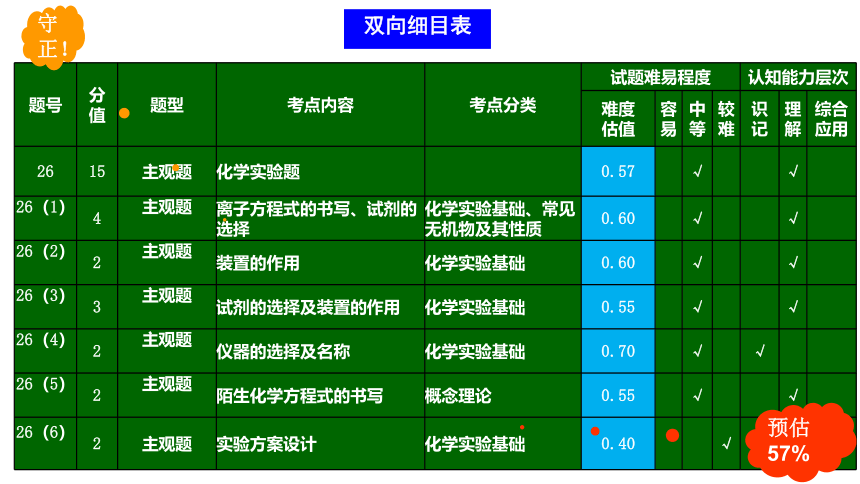
预估57%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
26 15 主观题 化学实验题 0.57 √ √
26(1)
4 主观题
离子方程式的书写、试剂的选择 化学实验基础、常见无机物及其性质 0.60 √ √
26(2)
2 主观题
装置的作用 化学实验基础 0.60 √ √
26(3)
3 主观题
试剂的选择及装置的作用 化学实验基础 0.55 √ √
26(4)
2 主观题
仪器的选择及名称 化学实验基础 0.70 √ √
26(5)
2 主观题
陌生化学方程式的书写 概念理论 0.55 √ √
26(6)
2 主观题 实验方案设计 化学实验基础 0.40 √ √
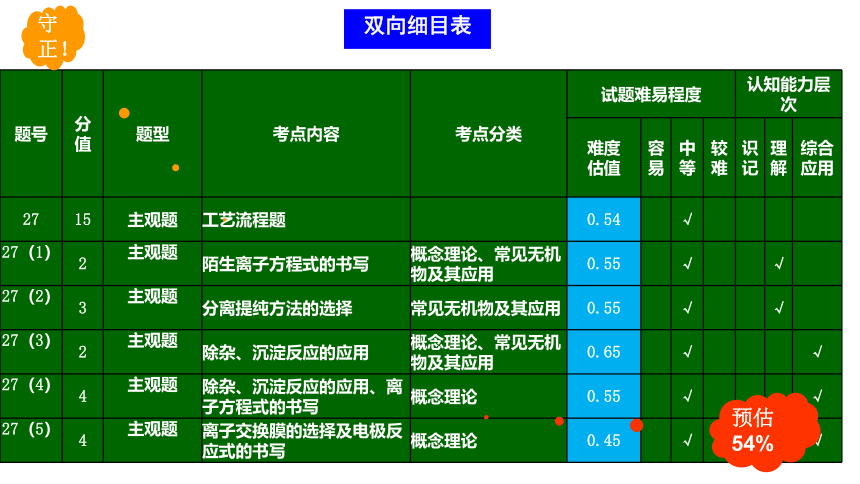
预估54%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
27 15 主观题 工艺流程题 0.54 √
27(1)
2 主观题
陌生离子方程式的书写 概念理论、常见无机物及其应用 0.55 √ √
27(2)
3 主观题
分离提纯方法的选择 常见无机物及其应用 0.55 √ √
27(3)
2 主观题
除杂、沉淀反应的应用 概念理论、常见无机物及其应用 0.65 √ √
27(4)
4 主观题
除杂、沉淀反应的应用、离子方程式的书写 概念理论 0.55 √ √
27(5)
4 主观题
离子交换膜的选择及电极反应式的书写 概念理论 0.45 √ √
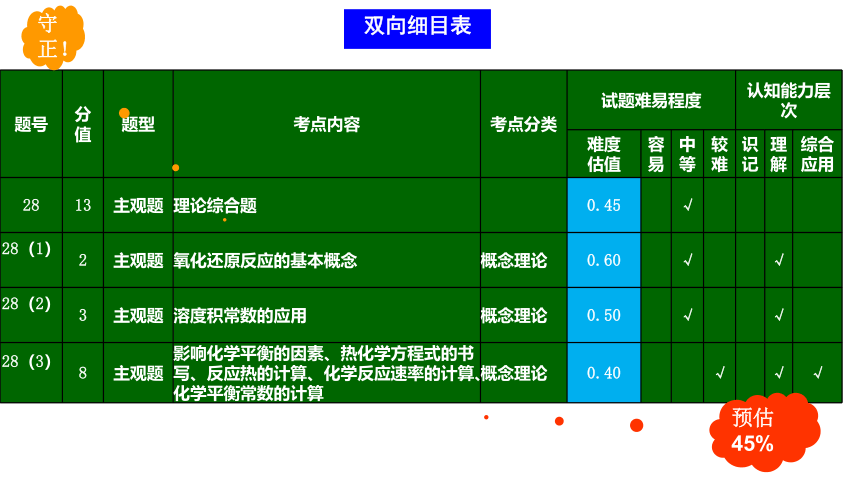
预估45%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
28 13 主观题 理论综合题 0.45 √
28(1)
2 主观题 氧化还原反应的基本概念 概念理论 0.60 √ √
28(2)
3 主观题 溶度积常数的应用 概念理论 0.50 √ √
28(3)
8 主观题 影响化学平衡的因素、热化学方程式的书写、反应热的计算、化学反应速率的计算、化学平衡常数的计算 概念理论 0.40 √ √ √
预估55%
守正!
双向细目表
选做题
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
36 15 主观题 化学与技术 0.55 √ √
36(1) 2 主观题 陌生方程式的书写 概念理论 0.60 √ √
36(2) 4 主观题 物质的分离与提纯、离子方程式的书写 常见无机物及其应用 0.55 √
36(3) 2 主观题 试剂的选择 常见无机物及其应用、化学实验基础 0.60 √ √
36(4) 3 主观题 操作名称、仪器的选择 化学与技术 0.55 √ √
36(5) 2 主观题 试剂的选择 常见无机物及其应用、化学实验基础 0.50 √ √
36(6) 2 主观题 纯度的计算 概念理论 0.50 √ √
预估55%
守正!
双向细目表
选做题
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
37 15 主观题 物质结构与性质 0.55 √
37(1) 2 主观题 价电子排布式、能级 物质结构与性质 0.60 √ √
37(2) 4 主观题 配位化合物、化学键的类型 物质结构与性质 0.60 √ √
37(3) 5 主观题 等电子体、键角的比较及解释 物质结构与性质 0.50 √ √
37(4) 1 主观题 晶体类型的判断 物质结构与性质 0.70 √ √
37(5) 3 主观题 根据晶胞结构写化学式、有关晶胞的计算 物质结构与性质 0.50 √ √
预估54%
守正!
双向细目表
选做题
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
38 15 主观题 有机化学基础 0.54 √
38(1) 2 主观题 有机物的命名及官能团名称 有机化学基础 0.65 √ √ √
38(2) 4 主观题 有机物的空间构型及顺反异构 有机化学基础 0.50 √ √
38(3) 2 主观题 有机反应类型 有机化学基础 0.60 √ √
38(4) 2 主观题 有机方程式的书写 有机化学基础 0.55 √ √
38(5) 2 主观题 同分异构体 有机化学基础 0.50 √ √
38(6) 3 主观题 合成路线的设计 有机化学基础 0.50 √ √
【解题思路】草木灰和铵态氮肥不能混合使用的原因是NH4+和CO32-发生双水解
【命题意图】考查化学与生产、生活的紧密联系
【难度估计】0.78
【备考建议】熟悉化学知识在生活中的典型应用。
7.化学与工农业生产、人类生活密切相关。下列说法中不正确的是
A.塑料、人造纤维和合成橡胶都属于有机高分子化合物
B.食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质
C.Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂
D.草木灰和铵态氮肥不能混合使用,是因为NH4+ + HCO3-=CO2↑+H2O+NH3↑
D
【解题思路】化合物A其分子式为C13H10O4N2,故A错;水解产物是醋酸盐和C2H518OH,故B错;命名为2,2﹣二甲基丁烷
【命题意图】有机物分子式、反应原理、命名
【难度估计】0.75
【备考建议】掌握常见有机官能团的性质,分子式的计算和命名法。
C
8.下列说法正确的是
A.化合物A结构如图,则其分子式为C13H9O4N2
B.在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
C.在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 的系统命名为2﹣甲基﹣2﹣乙基丙烷
9. 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如右图所示,则下列有关说法中不正确的是
A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
【解题思路】看电解液中离子移动的方向可知钠离子向左移动,则左侧为阴极,则X为负极,故A正确;阳极区OH—中和了亚硫酸氢根,所以pH减少,故B错。
【命题意图】考查电解池原理
【难度估计】0.58
【备考建议】熟练掌握电解池工作原理
B
【解题思路】硝酸氧化了Fe2+,故B错;生成了银氨络离子,故C错;滴入的2mL 0.1mol·L-1 ZnSO4溶液量太少,故D错
【命题意图】考查实验操作、现象及结论的判断
【难度估计】0.52
【备考建议】熟练掌握概念理论、常见无机物及其应用、化学实验基础
A
10.下列实验操作、实验现象和实验结论均正确的是
选项 实验操作 实验现象 实验结论
A 向酸性KMnO4溶液中滴加乙二酸 溶液褪色 乙二酸具有还原性
B 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 溶液变红 稀硫酸能氧化Fe2+
C 向AgNO3溶液中滴加过量氨水 得到澄清溶液 Ag+与NH3·H2O能大量共存
D 向10mL 0.1mol·L-1 Na2S溶液中滴入2mL 0.1mol·L-1 ZnSO4溶液,再加入2mL 0.1mol·L-1 CuSO4溶液 开始有白色沉淀生成;后有黑色沉淀生成 Ksp(CuS) < Ksp(ZnS)
【命题意图】考查影响水电离的因素、电离平衡常数的综合应用、溶液中离子浓度的关系
11.溶液的酸碱性可用酸度(AG)表示: ,室温下,将0.01 mol?L-1 盐酸逐滴滴入20.00 mL 0.01mol?L-1 氨水中,溶液的AG变化如图所示。下列说法正确的是
A.室温下,0.01 mol?L-1盐酸的AG=12
B.M点时溶液中:c(NH4+ )=c(Cl- )
C.M点加入盐酸的体积大于20.00 mL
D.M点以后NH4+的水解程度逐渐增大
【解题思路】M点时氢离子的浓度等于氢氧根的浓度,根据电荷守恒,故B正确;室温下,0.01 mol?L-1盐酸的AG=10,故A错;若等于20ml,则生成氯化铵溶液显酸性,只有盐酸少于20ml才可能为中性,故C错;盐酸过量时会抑制NH4+水解,故D错。
【难度估计】0.43
【备考建议】熟练掌握影响水电离的因素、电离平衡常数的综合应用、溶液中离子浓度的关系
B
12.设NA为阿伏加德罗常数的值。下列叙述中正确的是
A.14g分子式CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
B.1mol SiO2晶体中含NA个SiO2分子
C.标准状况下,1L液态水中含有的H+数目为10-7 NA
D.常温常压下,足量Zn与一定量的浓硫酸反应,产生气体22.4L时,转移的电子数为2 NA
【命题意图】考查阿伏加德罗常数在化学计量中的应用
【解题思路】SiO2晶体是原子晶体,不是分子,故B错;25℃时水的离子积才是10-14,故C错;非标准状态22.4L不是1mol,故D错
【难度估计】0.65
【备考建议】突破阿伏加德罗常数的常见“陷阱”。
A
【解题思路】此题关键是“25℃时0.01mol·L-1己溶液的pH为12”这句话,由此推理已为氢氧化钠溶液,由此推理出X、Y、Z、W分别是H、C、O、Na四种元素,则钠离子半径比氧离子小,故D错
【命题意图】考查原子结构、元素周期表和元素周期律。
【难度估计】0.45
【备考建议】理解“位—构—性”三者之间的关系,会根据元素周期表比较元素的有关性质。
D
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲?乙?丙?戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质。已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol·L-1己溶液的pH为12。下列说法不正确的是
A.1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量大于0.1mol
B.将足量甲加入到酚酞试液中,溶液先变红后褪色
C.X与W构成的化合物、戊、己均为离子化合物
D.W的简单离子半径大于Z的简单离子半径
26.(14分)氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有关性质.
(1)装置A中烧瓶内试剂可选用 (填序号);
B的作用是 。
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
ac
干燥氨气
Ⅰ
【命题意图】综合考查实验原理、实验装置、药品选择、物质的提纯、实验设计等。
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,
该反应证明氨气具有 性。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号)。
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L。
还原性
Ⅱ、Ⅲ
0.2
【解题思路】(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,浓硫酸和氨气发生反应,氨气易溶入烧碱溶液,不选择浓硫酸、氢氧化钠溶液制备氨气,所以装置A中试剂为:a.碱石灰,c.生石灰;B装置中的碱石灰是吸收水蒸气,干燥氨气的作用,
故答案:ac;干燥氨气;
(2)连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,故答案为:Ⅰ;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH?3?===?3Cu+N?2?+3H?2?O;氮元素化合价升高为0价,做还原剂具有还原性,
故答案为:3CuO+2NH?3?===?3Cu+N?2?+3H?2?O;还原性;
【难度估计】0.58
【备考建议】掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理、净化、收集、尾气处理方法),设计、评价实验方案并能规范表述;提升收集、处理、应用信息的能力。
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=
=0.2mol/L,
0.1mol
0.5L
27. ( 15分 ) 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2的中Cl元素的化合价为_______。
(2)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液初始浓度为5×10?3mol·L?1。反应10min后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中与NO反应的离子方程式__ ________。
②10min时NaClO2的转换率为_____________。
③若在实验室中要检验脱硫反应结束后产生的SO42?操作和现象为___ ___
_____ _____。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
+3
70%
取少量溶液于试管中,先加盐酸,无明显现象,再加入氯化钡溶液,有白色沉淀产生
离子 SO42? SO32? NO3? NO2? Cl?
c/(mol·L?1) 8.35×10?4 6.87×10?6 1.5×10?4 1.2×10?5 3.5×10?3
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___________(填“增大”“不变”或“减小”)。
②反应ClO2?+2SO32?===2SO42?+Cl?的平衡常数K表达式为____ _______。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是__ _ ____。
②已知下列反应:
SO2(g)+2OH? (aq) =SO32? (aq)+H2O(l) ΔH1
ClO? (aq)+SO32? (aq) =SO42? (aq)+Cl? (aq) ΔH2
CaSO4(s) =Ca2+(aq)+SO42?(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) =CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=____。
减小
【解题思路】(2)② 70%
③取少量溶液于试管中,先加盐酸,无明显现象,再加入氯化钡溶液,有白色沉淀产生(2分)
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
①由图分析可知,反应温度升高,SO2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小。
②根据反应的方程式ClO2+2SO32-===2SO42-+Cl可知平衡常数K表达式为
【命题意图】主要考查物质的性质,基本概念和理论
【难度估计】0.55
【备考建议】关注化合价、氧化还原陌生方程式的书写、反应速率的计算、离子的检验、平衡常数及其表达式、无机化合物的性质、盖斯定律的运用等常见考点
28.(14分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为______ _____,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124?形式存在于溶液中。“废渣2”中含有_______。
物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3
质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
(4)“离子交换”和“洗脱”可简单表示为:
4ROH+ V4O124? R4V4O12+4OH?
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)工业上采用铝热法由V2O5制取钒单质,请写出该反应方程式________________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式______ ____。
【命题意图】主要考查概念理论、常见无机物及其应用
碱
【解题思路】(1)“酸浸”时V2O5转化为VO2+,V元素化合价不变,说明不是氧化还原反应,根据原子守恒可知反应的离子方程式为V2O5+2H+=2VO2++H2O;二氧化硅与酸不反应,则“废渣1”的主要成分是二氧化硅。
(4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。
(5)10Al+3V2O5 5Al2O3+6V
(6)根据原子守恒可知偏钒酸铵(NH4VO3?“煅烧”生成七氧化二钒、氨气和水,发生反应的化学方程式为2NH4VO3 V2O5+H2O+2NH3↑。
【难度估计】0.59
【备考建议】陌生离子方程式的书写、氧化还原反应电子得失守恒的应用、除杂、沉淀反应的应用
38.【化学—选修5:有机化学基础】(15分)
阿托酸乙酯可用于辅助胃肠道痉挛及溃疡。阿托酸乙酯的一种合成路线如下图所示:
请回答下列问题:
(1)E的分子式为 ,F的结构简式 ,阿托酸乙酯所含官能团的名称 ;
(2)在反应①②③④⑤⑥⑦⑧中,属于取代反应的有 ;
(3)反应③的方程式 。
(4)有关阿托酸乙酯的说法正确的是 ;
A.能使高锰酸钾褪色,不能使溴水褪色 B.1mol阿托酸乙酯最多能与4molH2加成C.能发生加成、加聚、氧化、水解等反应 D.分子式为C11H13O2
(5)D的同分异构体有多种,符合含有苯环且能与碳酸氢钠反应放出气体的同分异构体有 ___________种(不包含D)。
C10H12O2
碳碳双键、酯基
②⑤⑥
B C
3
【命题意图】主要考查有机化学基础
【解题思路】
【难度估计】0.56
【备考建议】多点关注有机物的分子式、结构简式及官能团名称、有机反应类型、有机方程式的书写、有机物的性质、同分异构体等常考点
理科综合能力测试
化学部分 试题分析与备考指导
指导思想
根据普通高等学校对新生文化素质的要求,依据中华人民共和国教育部2003年颁布的《普通高中化学课程标准(实验)》和《2019年普通高等学校招生全国统一考试大纲(化学科)》,结合教学实际,确定化学科考试内容。考试内容包括知识和能力两个方面。
试题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面发展。
预估61%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
7 6 客观题 化学与生产、生活 化学学科特点与化学基本研究方法 0.80 √ √
8 6 客观题 阿佛加德罗常数的综合应用 概念理论、常见无机物及其应用 0.65 √ √
9 6 客观题 离子共存、离子方程式的正误判断、盐的水解的应用 常见无机物及其应用、概念理论 0.60 √ √
10 6 客观题 同分异构体 常见有机物及其应用 0.60 √ √
11 6 客观题 实验操作、现象及结论的判断 概念理论、常见无机物及其应用、化学实验基础 0.50 √ √
12 6 客观题 元素的推断、原子半径比较、元素周期律、金属的冶炼 常见无机物及其应用、概念理论 0.65 √ √
13 6 客观题 影响水电离的因素、电离平衡常数的综合应用、溶液中离子浓度的关系 概念理论 0.45 √ √
预估57%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
26 15 主观题 化学实验题 0.57 √ √
26(1)
4 主观题
离子方程式的书写、试剂的选择 化学实验基础、常见无机物及其性质 0.60 √ √
26(2)
2 主观题
装置的作用 化学实验基础 0.60 √ √
26(3)
3 主观题
试剂的选择及装置的作用 化学实验基础 0.55 √ √
26(4)
2 主观题
仪器的选择及名称 化学实验基础 0.70 √ √
26(5)
2 主观题
陌生化学方程式的书写 概念理论 0.55 √ √
26(6)
2 主观题 实验方案设计 化学实验基础 0.40 √ √
预估54%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
27 15 主观题 工艺流程题 0.54 √
27(1)
2 主观题
陌生离子方程式的书写 概念理论、常见无机物及其应用 0.55 √ √
27(2)
3 主观题
分离提纯方法的选择 常见无机物及其应用 0.55 √ √
27(3)
2 主观题
除杂、沉淀反应的应用 概念理论、常见无机物及其应用 0.65 √ √
27(4)
4 主观题
除杂、沉淀反应的应用、离子方程式的书写 概念理论 0.55 √ √
27(5)
4 主观题
离子交换膜的选择及电极反应式的书写 概念理论 0.45 √ √
预估45%
守正!
双向细目表
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
28 13 主观题 理论综合题 0.45 √
28(1)
2 主观题 氧化还原反应的基本概念 概念理论 0.60 √ √
28(2)
3 主观题 溶度积常数的应用 概念理论 0.50 √ √
28(3)
8 主观题 影响化学平衡的因素、热化学方程式的书写、反应热的计算、化学反应速率的计算、化学平衡常数的计算 概念理论 0.40 √ √ √
预估55%
守正!
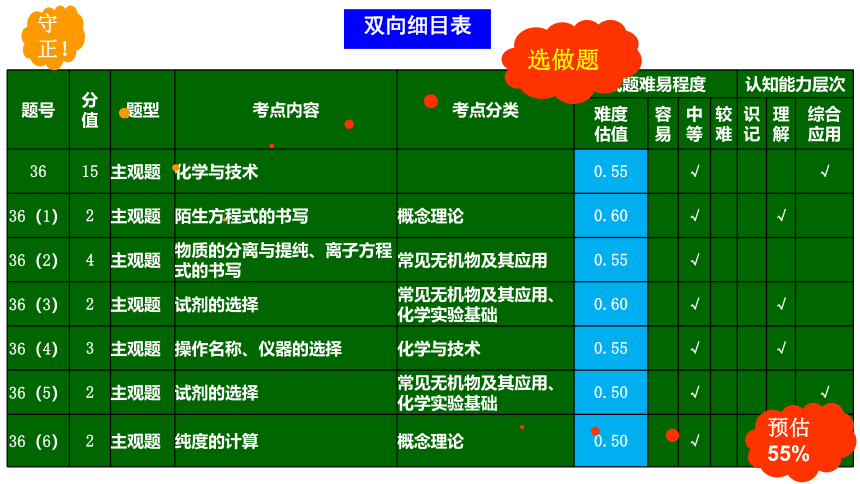
双向细目表
选做题
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
36 15 主观题 化学与技术 0.55 √ √
36(1) 2 主观题 陌生方程式的书写 概念理论 0.60 √ √
36(2) 4 主观题 物质的分离与提纯、离子方程式的书写 常见无机物及其应用 0.55 √
36(3) 2 主观题 试剂的选择 常见无机物及其应用、化学实验基础 0.60 √ √
36(4) 3 主观题 操作名称、仪器的选择 化学与技术 0.55 √ √
36(5) 2 主观题 试剂的选择 常见无机物及其应用、化学实验基础 0.50 √ √
36(6) 2 主观题 纯度的计算 概念理论 0.50 √ √
预估55%
守正!
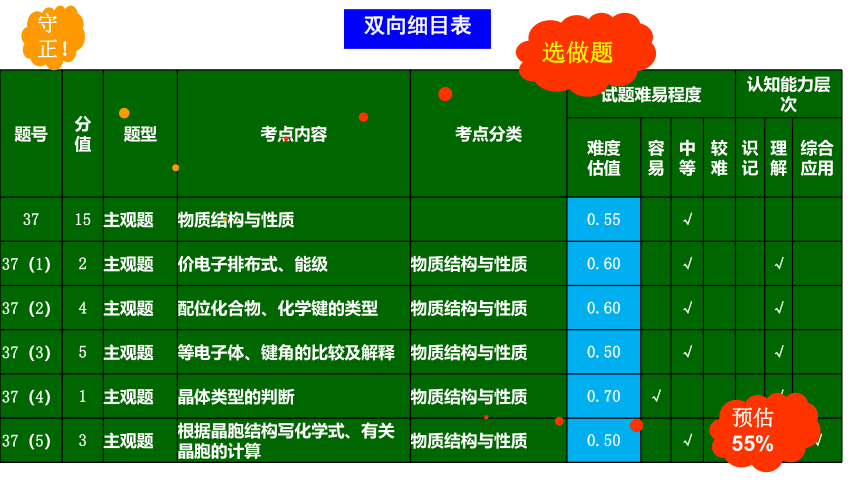
双向细目表
选做题
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
37 15 主观题 物质结构与性质 0.55 √
37(1) 2 主观题 价电子排布式、能级 物质结构与性质 0.60 √ √
37(2) 4 主观题 配位化合物、化学键的类型 物质结构与性质 0.60 √ √
37(3) 5 主观题 等电子体、键角的比较及解释 物质结构与性质 0.50 √ √
37(4) 1 主观题 晶体类型的判断 物质结构与性质 0.70 √ √
37(5) 3 主观题 根据晶胞结构写化学式、有关晶胞的计算 物质结构与性质 0.50 √ √
预估54%
守正!
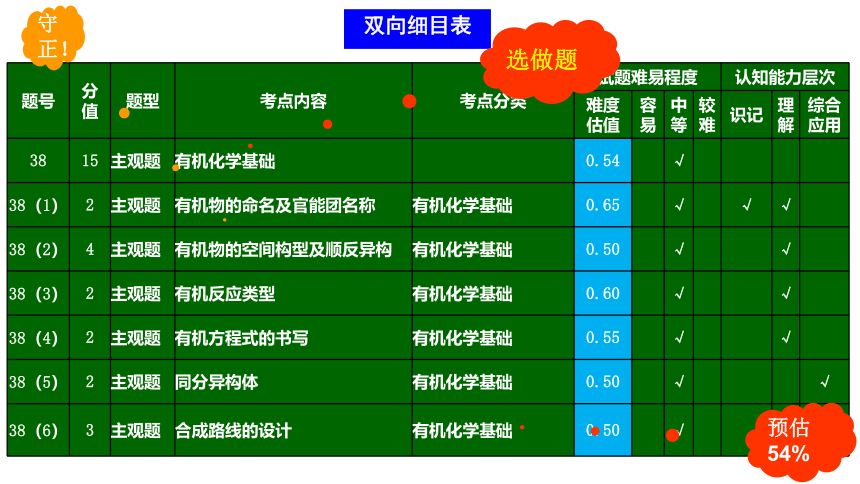
双向细目表
选做题
题号 分值 题型 考点内容 考点分类 试题难易程度 认知能力层次
难度 估值 容易 中等 较难 识记 理解 综合应用
38 15 主观题 有机化学基础 0.54 √
38(1) 2 主观题 有机物的命名及官能团名称 有机化学基础 0.65 √ √ √
38(2) 4 主观题 有机物的空间构型及顺反异构 有机化学基础 0.50 √ √
38(3) 2 主观题 有机反应类型 有机化学基础 0.60 √ √
38(4) 2 主观题 有机方程式的书写 有机化学基础 0.55 √ √
38(5) 2 主观题 同分异构体 有机化学基础 0.50 √ √
38(6) 3 主观题 合成路线的设计 有机化学基础 0.50 √ √
【解题思路】草木灰和铵态氮肥不能混合使用的原因是NH4+和CO32-发生双水解
【命题意图】考查化学与生产、生活的紧密联系
【难度估计】0.78
【备考建议】熟悉化学知识在生活中的典型应用。
7.化学与工农业生产、人类生活密切相关。下列说法中不正确的是
A.塑料、人造纤维和合成橡胶都属于有机高分子化合物
B.食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质
C.Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂
D.草木灰和铵态氮肥不能混合使用,是因为NH4+ + HCO3-=CO2↑+H2O+NH3↑
D
【解题思路】化合物A其分子式为C13H10O4N2,故A错;水解产物是醋酸盐和C2H518OH,故B错;命名为2,2﹣二甲基丁烷
【命题意图】有机物分子式、反应原理、命名
【难度估计】0.75
【备考建议】掌握常见有机官能团的性质,分子式的计算和命名法。
C
8.下列说法正确的是
A.化合物A结构如图,则其分子式为C13H9O4N2
B.在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
C.在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 的系统命名为2﹣甲基﹣2﹣乙基丙烷
9. 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如右图所示,则下列有关说法中不正确的是
A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
【解题思路】看电解液中离子移动的方向可知钠离子向左移动,则左侧为阴极,则X为负极,故A正确;阳极区OH—中和了亚硫酸氢根,所以pH减少,故B错。
【命题意图】考查电解池原理
【难度估计】0.58
【备考建议】熟练掌握电解池工作原理
B
【解题思路】硝酸氧化了Fe2+,故B错;生成了银氨络离子,故C错;滴入的2mL 0.1mol·L-1 ZnSO4溶液量太少,故D错
【命题意图】考查实验操作、现象及结论的判断
【难度估计】0.52
【备考建议】熟练掌握概念理论、常见无机物及其应用、化学实验基础
A
10.下列实验操作、实验现象和实验结论均正确的是
选项 实验操作 实验现象 实验结论
A 向酸性KMnO4溶液中滴加乙二酸 溶液褪色 乙二酸具有还原性
B 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 溶液变红 稀硫酸能氧化Fe2+
C 向AgNO3溶液中滴加过量氨水 得到澄清溶液 Ag+与NH3·H2O能大量共存
D 向10mL 0.1mol·L-1 Na2S溶液中滴入2mL 0.1mol·L-1 ZnSO4溶液,再加入2mL 0.1mol·L-1 CuSO4溶液 开始有白色沉淀生成;后有黑色沉淀生成 Ksp(CuS) < Ksp(ZnS)
【命题意图】考查影响水电离的因素、电离平衡常数的综合应用、溶液中离子浓度的关系
11.溶液的酸碱性可用酸度(AG)表示: ,室温下,将0.01 mol?L-1 盐酸逐滴滴入20.00 mL 0.01mol?L-1 氨水中,溶液的AG变化如图所示。下列说法正确的是
A.室温下,0.01 mol?L-1盐酸的AG=12
B.M点时溶液中:c(NH4+ )=c(Cl- )
C.M点加入盐酸的体积大于20.00 mL
D.M点以后NH4+的水解程度逐渐增大
【解题思路】M点时氢离子的浓度等于氢氧根的浓度,根据电荷守恒,故B正确;室温下,0.01 mol?L-1盐酸的AG=10,故A错;若等于20ml,则生成氯化铵溶液显酸性,只有盐酸少于20ml才可能为中性,故C错;盐酸过量时会抑制NH4+水解,故D错。
【难度估计】0.43
【备考建议】熟练掌握影响水电离的因素、电离平衡常数的综合应用、溶液中离子浓度的关系
B
12.设NA为阿伏加德罗常数的值。下列叙述中正确的是
A.14g分子式CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
B.1mol SiO2晶体中含NA个SiO2分子
C.标准状况下,1L液态水中含有的H+数目为10-7 NA
D.常温常压下,足量Zn与一定量的浓硫酸反应,产生气体22.4L时,转移的电子数为2 NA
【命题意图】考查阿伏加德罗常数在化学计量中的应用
【解题思路】SiO2晶体是原子晶体,不是分子,故B错;25℃时水的离子积才是10-14,故C错;非标准状态22.4L不是1mol,故D错
【难度估计】0.65
【备考建议】突破阿伏加德罗常数的常见“陷阱”。
A
【解题思路】此题关键是“25℃时0.01mol·L-1己溶液的pH为12”这句话,由此推理已为氢氧化钠溶液,由此推理出X、Y、Z、W分别是H、C、O、Na四种元素,则钠离子半径比氧离子小,故D错
【命题意图】考查原子结构、元素周期表和元素周期律。
【难度估计】0.45
【备考建议】理解“位—构—性”三者之间的关系,会根据元素周期表比较元素的有关性质。
D
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲?乙?丙?戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质。已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol·L-1己溶液的pH为12。下列说法不正确的是
A.1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量大于0.1mol
B.将足量甲加入到酚酞试液中,溶液先变红后褪色
C.X与W构成的化合物、戊、己均为离子化合物
D.W的简单离子半径大于Z的简单离子半径
26.(14分)氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有关性质.
(1)装置A中烧瓶内试剂可选用 (填序号);
B的作用是 。
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
ac
干燥氨气
Ⅰ
【命题意图】综合考查实验原理、实验装置、药品选择、物质的提纯、实验设计等。
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,
该反应证明氨气具有 性。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号)。
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L。
还原性
Ⅱ、Ⅲ
0.2
【解题思路】(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,浓硫酸和氨气发生反应,氨气易溶入烧碱溶液,不选择浓硫酸、氢氧化钠溶液制备氨气,所以装置A中试剂为:a.碱石灰,c.生石灰;B装置中的碱石灰是吸收水蒸气,干燥氨气的作用,
故答案:ac;干燥氨气;
(2)连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,故答案为:Ⅰ;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH?3?===?3Cu+N?2?+3H?2?O;氮元素化合价升高为0价,做还原剂具有还原性,
故答案为:3CuO+2NH?3?===?3Cu+N?2?+3H?2?O;还原性;
【难度估计】0.58
【备考建议】掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理、净化、收集、尾气处理方法),设计、评价实验方案并能规范表述;提升收集、处理、应用信息的能力。
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=
=0.2mol/L,
0.1mol
0.5L
27. ( 15分 ) 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2的中Cl元素的化合价为_______。
(2)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液初始浓度为5×10?3mol·L?1。反应10min后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中与NO反应的离子方程式__ ________。
②10min时NaClO2的转换率为_____________。
③若在实验室中要检验脱硫反应结束后产生的SO42?操作和现象为___ ___
_____ _____。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
+3
70%
取少量溶液于试管中,先加盐酸,无明显现象,再加入氯化钡溶液,有白色沉淀产生
离子 SO42? SO32? NO3? NO2? Cl?
c/(mol·L?1) 8.35×10?4 6.87×10?6 1.5×10?4 1.2×10?5 3.5×10?3
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___________(填“增大”“不变”或“减小”)。
②反应ClO2?+2SO32?===2SO42?+Cl?的平衡常数K表达式为____ _______。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是__ _ ____。
②已知下列反应:
SO2(g)+2OH? (aq) =SO32? (aq)+H2O(l) ΔH1
ClO? (aq)+SO32? (aq) =SO42? (aq)+Cl? (aq) ΔH2
CaSO4(s) =Ca2+(aq)+SO42?(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) =CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=____。
减小
【解题思路】(2)② 70%
③取少量溶液于试管中,先加盐酸,无明显现象,再加入氯化钡溶液,有白色沉淀产生(2分)
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
①由图分析可知,反应温度升高,SO2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小。
②根据反应的方程式ClO2+2SO32-===2SO42-+Cl可知平衡常数K表达式为
【命题意图】主要考查物质的性质,基本概念和理论
【难度估计】0.55
【备考建议】关注化合价、氧化还原陌生方程式的书写、反应速率的计算、离子的检验、平衡常数及其表达式、无机化合物的性质、盖斯定律的运用等常见考点
28.(14分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为______ _____,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124?形式存在于溶液中。“废渣2”中含有_______。
物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3
质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
(4)“离子交换”和“洗脱”可简单表示为:
4ROH+ V4O124? R4V4O12+4OH?
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)工业上采用铝热法由V2O5制取钒单质,请写出该反应方程式________________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式______ ____。
【命题意图】主要考查概念理论、常见无机物及其应用
碱
【解题思路】(1)“酸浸”时V2O5转化为VO2+,V元素化合价不变,说明不是氧化还原反应,根据原子守恒可知反应的离子方程式为V2O5+2H+=2VO2++H2O;二氧化硅与酸不反应,则“废渣1”的主要成分是二氧化硅。
(4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。
(5)10Al+3V2O5 5Al2O3+6V
(6)根据原子守恒可知偏钒酸铵(NH4VO3?“煅烧”生成七氧化二钒、氨气和水,发生反应的化学方程式为2NH4VO3 V2O5+H2O+2NH3↑。
【难度估计】0.59
【备考建议】陌生离子方程式的书写、氧化还原反应电子得失守恒的应用、除杂、沉淀反应的应用
38.【化学—选修5:有机化学基础】(15分)
阿托酸乙酯可用于辅助胃肠道痉挛及溃疡。阿托酸乙酯的一种合成路线如下图所示:
请回答下列问题:
(1)E的分子式为 ,F的结构简式 ,阿托酸乙酯所含官能团的名称 ;
(2)在反应①②③④⑤⑥⑦⑧中,属于取代反应的有 ;
(3)反应③的方程式 。
(4)有关阿托酸乙酯的说法正确的是 ;
A.能使高锰酸钾褪色,不能使溴水褪色 B.1mol阿托酸乙酯最多能与4molH2加成C.能发生加成、加聚、氧化、水解等反应 D.分子式为C11H13O2
(5)D的同分异构体有多种,符合含有苯环且能与碳酸氢钠反应放出气体的同分异构体有 ___________种(不包含D)。
C10H12O2
碳碳双键、酯基
②⑤⑥
B C
3
【命题意图】主要考查有机化学基础
【解题思路】
【难度估计】0.56
【备考建议】多点关注有机物的分子式、结构简式及官能团名称、有机反应类型、有机方程式的书写、有机物的性质、同分异构体等常考点
同课章节目录
