1.3.2 共价键 课件
图片预览







文档简介
第三节 化学键(二)
共价键
人教版必修二
活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向。
讨论
氯化氢的形成过程
我才不会失电子给你
解决方式?
我是非金属,我很少失电子
Cl2 气体分子
H2 气体分子
分开后,她们为什么不高兴?让我们听听她们说些什么?
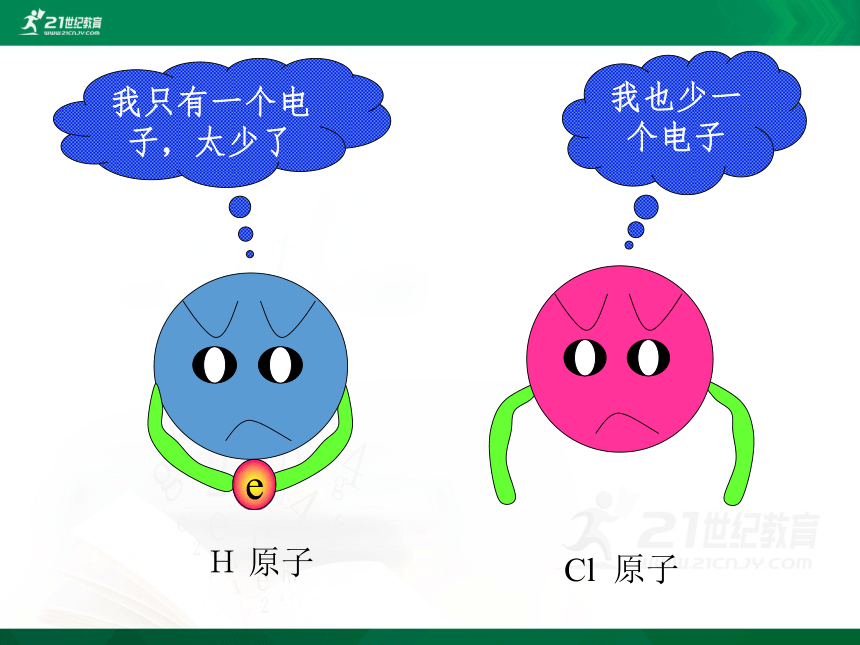
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
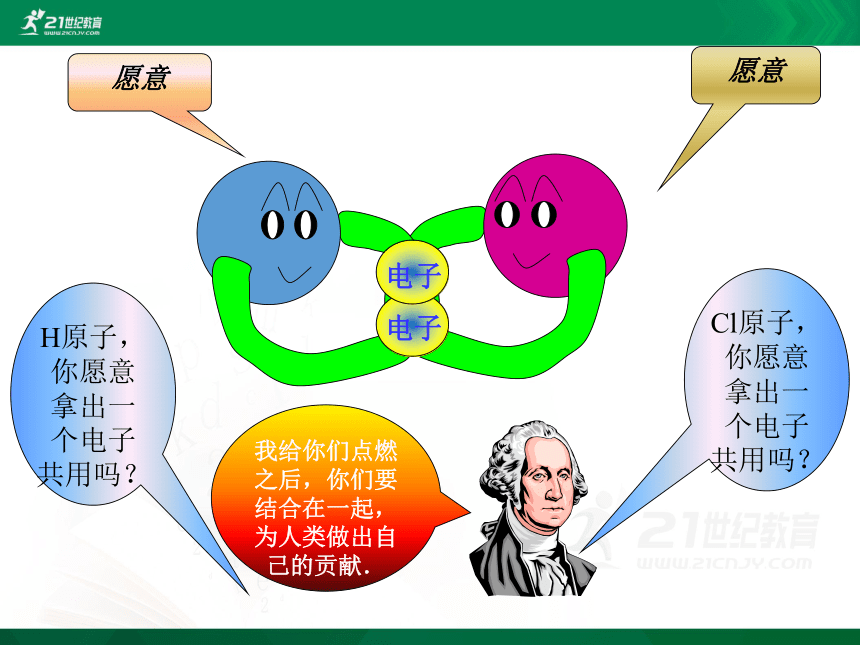
二位好!我有一个好办法.你们每人拿出一个电子共用,就像共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
愿意
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
我们的接合使人类的生活多了一点味道
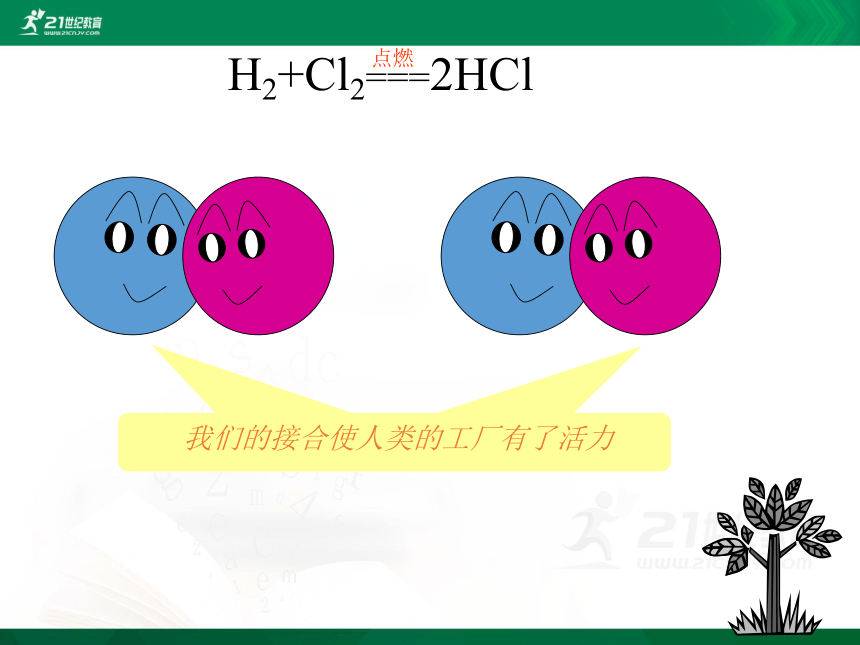
我们的接合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
共价键
原子之间通过共用电子对所形成的相互作用,叫做共价键。
一、共价键
定 义:
成键元素:
成键方式:
成键粒子:
成键结果:
原子之间通过共用电子对所形成的相互作用
非金属原子间(一般)
有电子的偏移共用,没有电子得失
形成共价化合物或单质
原子
只由共价键构成的化合物叫做共价化合物。
.常见共价化合物包括:
①非金属氢化物(如HCl、H2S、H2O等);
②含氧酸(如H2SO4、HNO3、H3PO4等);
③非金属氧化物(如CO、CO2、SO2等).
只由共价键构成的化合物叫做
共价化合物。
共用电子对
共用电子对
共用电子对
共用电子对
共价化合物的形成过程(或单质)
H + O + H → H O H
×
×
×
×
注意事项:①不用箭头表示电子的偏移;
②右边相同原子不能合并在一起;
③没有形成离子.
HCl
H2O
F2
×
H
Cl
+
→
×
H Cl
F
+
→
F
F
F
共用电子对
共用电子对
说明:
1)共价键可形成单质;可形成共价化合物;
2)共价化合物只含有共价键,不含离子键;含有共价键的化合物不一定是共价化合物,例如:NaOH NH4Cl K2SO4等。
(2)结构式:结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子。用“-”、“=”、“≡”分别表示1、2、3对共用电子,未成键电子不标
共价键的表示方法
(1)电子式
氮气的电子式、结构式
N N
: :
:
:
:
N N
—
—
—
氯气分子的电子式、结构式
: :
: :
Cl Cl
: : :
Cl Cl
__
水分子的电子式、结构式
H H
O
: :
: :
O
—
H
H
—
二氧化碳的电子式
: :
: :
O C O
:
:
:
:
O C O
— —
— —
含有共价键的化合物不一定是共价化合物
氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。
[ ]
+
-
·
H
·
Na
﹕
﹕
·
·
O
过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。
O
·
·
:
:
O
·
·
:
:
·
Na
·
Na
[ ]
+
+
2-
H
?
?
H
共用电子对无偏向
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
? ?
? ?
? ?
? ?
相邻的原子之间的强烈相互作用。
化学键
类型
比较
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物
如NaCl、铵盐
离子半径越小,离子所带电荷数越多,离子键越强(离子化合物的熔沸点越高)
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物
通常原子半径越小,
共用电子对越多,共价键越强,形成的单质或化合物越稳定
极性键和非极性键
非极性键:
同种原子形成的共价键
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
不同种原子形成的共价键
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)(不同非金属键间)
非极性键和极性键
共价键的类型
练习:写出下列物质的电子式:
CH4 NH3 H2S HBr
CCl4 CO2 N2 PH3 BF3 SiH4 PCl3 Br2
用化学键的观点来分析化学反应的本质是什么?
化学反应的本质:就是旧化学键的断裂和新化学键的形成的过程。
讨论
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
【说明】
1.离子化合物含有离子键,也可能同时含共价键;
2.共价化合物只含有共价键;
3.酸类物质均属于共价化合物,强碱均属于离子 化合物,大多数盐类物质属于离子化合物(但AlCl3等例外,它们属于共价化合物)。
离子化合物——含有离子键的化合物;
共价化合物——只含有共价键的化合物。
二、分子间作用力和氢键
问题??
分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?
存在
不同温度下分子具有不同能量
相互作用的大小不同
一 分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
但是:
为什么HF、H2O和NH3的沸点会反常呢?
讨论:
2、氢键
定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,即:
(2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。
作用力的大小: >氢键>
化学键
分子间作用力
(3)特征:具有方向性。
(4)结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
(5)结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
作业 :
P24 1、7
小结:
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
共价键
人教版必修二
活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向。
讨论
氯化氢的形成过程
我才不会失电子给你
解决方式?
我是非金属,我很少失电子
Cl2 气体分子
H2 气体分子
分开后,她们为什么不高兴?让我们听听她们说些什么?
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
二位好!我有一个好办法.你们每人拿出一个电子共用,就像共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
愿意
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
共价键
原子之间通过共用电子对所形成的相互作用,叫做共价键。
一、共价键
定 义:
成键元素:
成键方式:
成键粒子:
成键结果:
原子之间通过共用电子对所形成的相互作用
非金属原子间(一般)
有电子的偏移共用,没有电子得失
形成共价化合物或单质
原子
只由共价键构成的化合物叫做共价化合物。
.常见共价化合物包括:
①非金属氢化物(如HCl、H2S、H2O等);
②含氧酸(如H2SO4、HNO3、H3PO4等);
③非金属氧化物(如CO、CO2、SO2等).
只由共价键构成的化合物叫做
共价化合物。
共用电子对
共用电子对
共用电子对
共用电子对
共价化合物的形成过程(或单质)
H + O + H → H O H
×
×
×
×
注意事项:①不用箭头表示电子的偏移;
②右边相同原子不能合并在一起;
③没有形成离子.
HCl
H2O
F2
×
H
Cl
+
→
×
H Cl
F
+
→
F
F
F
共用电子对
共用电子对
说明:
1)共价键可形成单质;可形成共价化合物;
2)共价化合物只含有共价键,不含离子键;含有共价键的化合物不一定是共价化合物,例如:NaOH NH4Cl K2SO4等。
(2)结构式:结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子。用“-”、“=”、“≡”分别表示1、2、3对共用电子,未成键电子不标
共价键的表示方法
(1)电子式
氮气的电子式、结构式
N N
: :
:
:
:
N N
—
—
—
氯气分子的电子式、结构式
: :
: :
Cl Cl
: : :
Cl Cl
__
水分子的电子式、结构式
H H
O
: :
: :
O
—
H
H
—
二氧化碳的电子式
: :
: :
O C O
:
:
:
:
O C O
— —
— —
含有共价键的化合物不一定是共价化合物
氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。
[ ]
+
-
·
H
·
Na
﹕
﹕
·
·
O
过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。
O
·
·
:
:
O
·
·
:
:
·
Na
·
Na
[ ]
+
+
2-
H
?
?
H
共用电子对无偏向
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
? ?
? ?
? ?
? ?
相邻的原子之间的强烈相互作用。
化学键
类型
比较
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物
如NaCl、铵盐
离子半径越小,离子所带电荷数越多,离子键越强(离子化合物的熔沸点越高)
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物
通常原子半径越小,
共用电子对越多,共价键越强,形成的单质或化合物越稳定
极性键和非极性键
非极性键:
同种原子形成的共价键
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
不同种原子形成的共价键
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)(不同非金属键间)
非极性键和极性键
共价键的类型
练习:写出下列物质的电子式:
CH4 NH3 H2S HBr
CCl4 CO2 N2 PH3 BF3 SiH4 PCl3 Br2
用化学键的观点来分析化学反应的本质是什么?
化学反应的本质:就是旧化学键的断裂和新化学键的形成的过程。
讨论
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
【说明】
1.离子化合物含有离子键,也可能同时含共价键;
2.共价化合物只含有共价键;
3.酸类物质均属于共价化合物,强碱均属于离子 化合物,大多数盐类物质属于离子化合物(但AlCl3等例外,它们属于共价化合物)。
离子化合物——含有离子键的化合物;
共价化合物——只含有共价键的化合物。
二、分子间作用力和氢键
问题??
分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?
存在
不同温度下分子具有不同能量
相互作用的大小不同
一 分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
但是:
为什么HF、H2O和NH3的沸点会反常呢?
讨论:
2、氢键
定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,即:
(2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。
作用力的大小: >氢键>
化学键
分子间作用力
(3)特征:具有方向性。
(4)结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
(5)结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
作业 :
P24 1、7
小结:
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
