2018年高考天津卷化学试题精品分步动画解析(共22张PPT)
文档属性
| 名称 | 2018年高考天津卷化学试题精品分步动画解析(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 854.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-20 00:00:00 | ||
图片预览






文档简介
2018年全国高考天津卷
理综化学试题分步解析
可能用到的相对原子质量:H 1 C 12 N 14 O 16
A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应 B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品 C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士 D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
A
A.谷物中的淀粉在酿造中发生水解反应只能得到葡萄糖,葡萄糖要在酒化酶作用下分解,得到酒精和二氧化碳。酒中含有酒精,醋中含有醋酸,显然都不是只水解就可以的。选项A不合理。
B.商代后期铸造出工艺精湛的后(司)母戊鼎属于青铜器,青铜是铜锡合金。选项B合理。
1. 以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
C.陶瓷的制造原料为黏土。选项C合理。
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,是利用青蒿素在乙醚中溶解度较大的原理,将青蒿素提取到乙醚中,所以属于萃取操作。选项D合理。
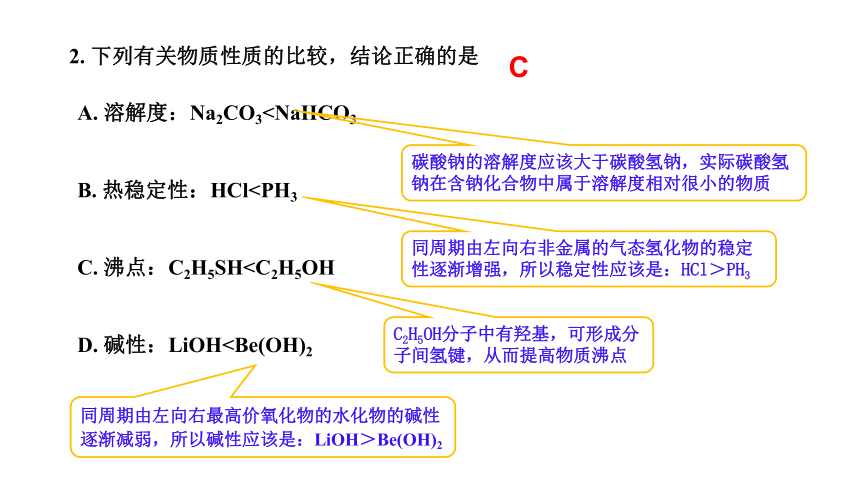
A. 溶解度:Na2CO3C
碳酸钠的溶解度应该大于碳酸氢钠,实际碳酸氢钠在含钠化合物中属于溶解度相对很小的物质
同周期由左向右非金属的气态氢化物的稳定性逐渐增强,所以稳定性应该是:HCl>PH3
C2H5OH分子中有羟基,可形成分子间氢键,从而提高物质沸点
同周期由左向右最高价氧化物的水化物的碱性逐渐减弱,所以碱性应该是:LiOH>Be(OH)2
2. 下列有关物质性质的比较,结论正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小 B. 铁管镀锌层局部破损后,铁管仍不易生锈 C. 反应活化能越高,该反应越易进行 D. 不能用红外光谱区分C2H5OH和CH3OCH3
B
根据“越弱越水解”的原理,HA的Ka越小,代表HA越弱,所以A-的水解越强,应该是NaA的Kh(水解常数)越大
铁管镀锌层局部破损后,形成锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的腐蚀
反应的活化能越高,该反应进行的越困难(可以简单理解为需要“翻越”的山峰越高,“翻越”越困难)
红外光谱是用来检测有机物中的官能团或特定结构的,
C2H5OH和CH3OCH3的官能团明显有较大差异,所以可以用红外光谱区分
3. 下列叙述正确的是
4. 由下列实验及现象推出的相应结论正确的是
实验 现象 结论
A.某溶液中滴加K3[Fe(CN)6]溶液 产生蓝色沉淀 原溶液中有Fe2+,无Fe3+
B.向C6H5ONa溶液中通入CO2 溶液变浑浊 酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 生成黑色沉淀 Ksp(CuS)D.①某溶液中加入Ba(NO3)2溶液②再加足量盐酸 ①产生白色沉淀②仍有白色沉淀 原溶液中有SO42-
B
A.某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中有Fe2+,但是无法证明是否有Fe3+。
B.向C6H5ONa溶液中通入CO2,溶液变浑浊,说明生成了苯酚,根据强酸制弱酸的原则,得到碳酸的酸性强于苯酚。选B正确。
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,虽然有ZnS不溶物,但是溶液中还有Na2S,加入硫酸铜溶液后,Cu2+一定与溶液中的S2-反应得到黑色CuS沉淀,不能证明发生沉淀转化。选项C错误。
D.向溶液中加入硝酸钡溶液,得到白色沉淀(有很多可能),再加入盐酸时,溶液中就会同时存在硝酸钡电离的硝酸根和盐酸电离的氢离子,溶液具有硝酸的强氧化性。如果上一步得到的是亚硫酸钡沉淀,此步就会被氧化为硫酸钡沉淀,依然不溶,则无法证明原溶液有硫酸根离子。选项D错误。
A. 加入NaOH,可增大乙醇的物质的量 B. 增大HBr浓度,有利于生成C2H5Br C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
5. 室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr ? C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
D
A.加入NaOH,中和HBr,平衡逆向移动,可增大乙醇的物质的量。选项A正确。
B.增大HBr浓度,平衡正向移动,有利于生成C2H5Br。选B正确。
C.若反应物增大至2 mol,实际上就是将反应的浓度都增大至原来的2倍,比例不变(两次实验反应物的比例都是1:1,等于方程式中的系数比),这里有一个可以直接使用的结论:只要反应物的投料比等于系数比,达平衡时反应物的转化率一定是相等的。所以两种反应物的转化率一定是1:1。选项C正确。
D.若起始温度提高至60℃,考虑到HBr是挥发性酸,在此温度下会挥发出去,降低HBr的浓度减慢速率,增加了反应时间。选项D错误。
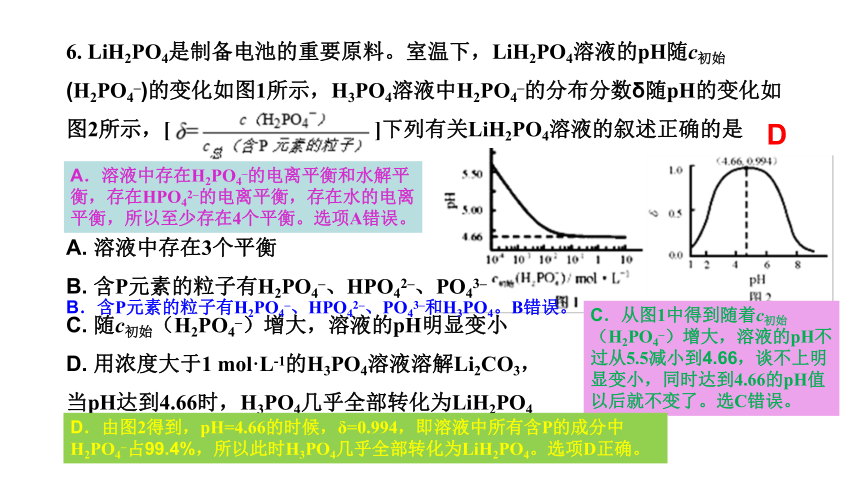
6. LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[ ]下列有关LiH2PO4溶液的叙述正确的是
A. 溶液中存在3个平衡 B. 含P元素的粒子有H2PO4–、HPO42–、PO43– C. 随c初始(H2PO4–)增大,溶液的pH明显变小 D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,
当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
D
A.溶液中存在H2PO4–的电离平衡和水解平衡,存在HPO42–的电离平衡,存在水的电离平衡,所以至少存在4个平衡。选项A错误。
B.含P元素的粒子有H2PO4–、HPO42–、PO43–和H3PO4。B错误。
C.从图1中得到随着c初始(H2PO4–)增大,溶液的pH不过从5.5减小到4.66,谈不上明显变小,同时达到4.66的pH值以后就不变了。选C错误。
D.由图2得到,pH=4.66的时候,δ=0.994,即溶液中所有含P的成分中H2PO4–占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4。选项D正确。
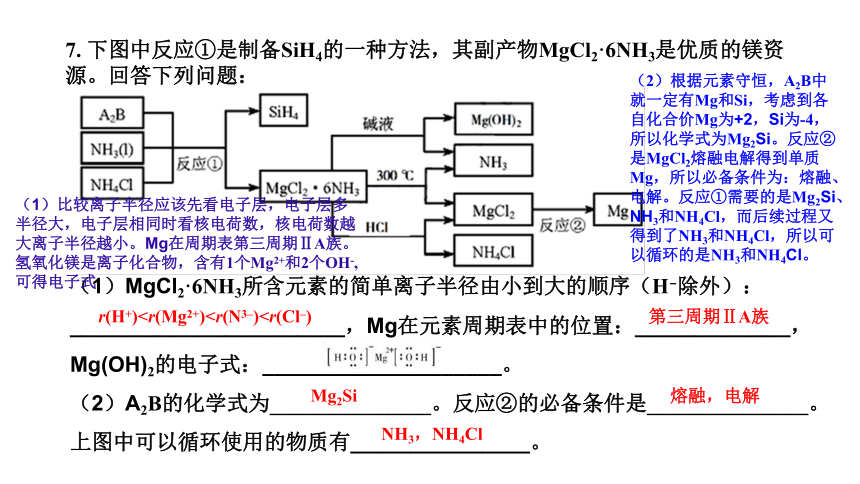
7. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_______________________,Mg在元素周期表中的位置:_____________,Mg(OH)2的电子式:____________________。 (2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
r(H+)第三周期ⅡA族
Mg2Si
熔融,电解
NH3,NH4Cl
(1)比较离子半径应该先看电子层,电子层多半径大,电子层相同时看核电荷数,核电荷数越大离子半径越小。Mg在周期表第三周期ⅡA族。氢氧化镁是离子化合物,含有1个Mg2+和2个OH-,可得电子式
(2)根据元素守恒,A2B中就一定有Mg和Si,考虑到各自化合价Mg为+2,Si为-4,所以化学式为Mg2Si。反应②是MgCl2熔融电解得到单质Mg,所以必备条件为:熔融、电解。反应①需要的是Mg2Si、NH3和NH4Cl,而后续过程又得到了NH3和NH4Cl,所以可以循环的是NH3和NH4Cl。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料___________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:___________________________。
SiC
2Mg(OH)2+2SO2+O2=2MgSO4+2H2O
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料,该耐磨材料一定有Si和C,考虑到课本中介绍了碳化硅的高硬度,所以该物质为SiC。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,二氧化硫是酸性氧化物与氢氧化镁这样的碱应该反应得到盐(亚硫酸镁),考虑到题目要求写出得到稳定化合物的方程式,所以产物应该为硫酸镁(亚硫酸镁被空气中的氧气氧化得到),所以反应为:2Mg(OH)2+2SO2+O2=2MgSO4+2H2O。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
依据上述信息,写出制备所需醛 的
可能结构简式:______________________。
CH3CH2CHO,CH3CHO
(5)利用格氏试剂可以制备,现在要求制备,所以可以选择R为CH3CH2,R’为CH3;或者选择R为CH3,R’为CH3CH2,所以对应的醛R’CHO可以是CH3CH2CHO或CH3CHO。
点睛:本题是一道比较基本的元素综合问题,比较新颖的是在题目的最后一问中加入了一个有机小题,这样的无机有机综合题目是比较少见的,当然难度并不大。第(4)小题中的反应,可以参考必修1的课后练习中涉及的钙基固硫问题。方程式中按道理应该加上反应的条件,例如:加热。
8. 化合物N具有镇痛、消炎等药理作用,其合成路线如下:
(1)A的系统命名为____________,
E中官能团的名称为____________。 (2)A→B的反应类型为
____________,从反应所得液态有机混合物中提纯B的常用方法为 ____________。
(3)C→D的化学方程式为_________________________________________。
1,6-己二醇
碳碳双键,酯基
取代反应
减压蒸馏(或蒸馏)
注意反应可逆。
(2)A→B的反应是将A中的一个羟基替换为溴原子,所以反应类型为取代反应。反应后的液态有机混合物应该是A、B混合,B比A少一个羟基,所以沸点的差距应该较大,可以通过蒸馏的方法分离。实际生产中考虑到A、B的沸点可能较高,直接蒸馏的温度较高可能使有机物炭化,所以会进行减压蒸馏以降低沸点。
(1)A为6个碳的二元醇,在第一个和最后一个碳上各有1个羟基,所以名称为1,6-己二醇。明显E中含有碳碳双键和酯基两个官能团。
(4)C的同分异构体
W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为
____________。
(5)F与G的关系为(填序号)____________。 a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
5
c
所以两者的关系为顺反异构,选项c正确。
(6)M的结构简式为
____________。
(7)参照上述合成路线,
以 为原料,采用如下方法制备医药中间体 。
该路线中试剂与条件1为____________,
X的结构简式为____________; 试剂与条件2为____________,
Y的结构简式为____________。
HBr,△
O2/Cu或Ag,△
9. 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题: Ⅰ.采样
采样步骤: ①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用是______。 (2)C中填充的干燥剂是(填序号)______。 a.碱石灰 b.无水CuSO4 c.P2O5
除尘
c
(1)A的过程叫“过滤”,所以其中玻璃棉的作用一定是除去烟道气中的粉尘。
(2)碱石灰是碱性干燥剂可能与NOX反应,所以不能使用。硫酸铜吸水能力太差,一般不用做干燥剂,所以不能使用。P2O5是酸性干燥剂,与NOX不反应
(3)用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
(4)采样步骤②加热烟道气的目的是_______________。
防止NOx溶于冷凝水
(3)实验室通常用洗气瓶来吸收气体,与D相同应该在洗气瓶中加入强碱(氢氧化钠)溶液
(4)加热烟道气的目的是避免水蒸气冷凝后,NOX溶于水中。
Ⅱ.NOx含量的测定 将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3?,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L?1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L?1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。 (5)NO被H2O2氧化为NO3?的离子方程式是__________________________。
(6)滴定操作使用的玻璃仪器主要有_________________。
2NO+3H2O2=2H++2NO3–+2H2O
锥形瓶、酸式滴定管
(5)NO被H2O2氧化为硝酸
(6)滴定中使用酸式滴定管(本题中的试剂都只能使用酸式滴定管)和锥形瓶。
(7)滴定过程中发生下列反应: 3Fe2++NO3?+4H+=NO↑+3Fe3++2H2O Cr2O72? + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_______________mg·m?3。
(8)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”) 若缺少采样步骤③,会使测试结果___________。 若FeSO4标准溶液部分变质,会使测定结果___________。
偏低
偏高
(8)若缺少采样步骤③,装置中有空气,则实际测定的是烟道气和空气混合气体中NOX的含量,测定结果必然偏低。若FeSO4标准溶液部分变质,一定是部分Fe2+被空气中的氧气氧化,计算时仍然认为这部分被氧化的Fe2+是被硝酸根离子氧化的,所以测定结果偏高。
点睛:注意本题中的流程图,装置D实际不是为了测定含量进行吸收,装置D相当于是尾气吸收。样品气的吸收应该是在“采样处”进行的。
10. CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题: (1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3?)∶c(CO32?)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×10?7;K2=5×10?11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
CO32-
10
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,因为得到溶液的碱性较强,所以CO2主要转化为碳酸根离子(CO32-)。若所得溶液c(HCO3?)∶c(CO32?)=2∶1,,则根据第二步电离平衡常数K2 = =5×10?11,所以氢离子浓度为1×10-10mol/L,pH=10。
①已知上述反应中相关的化学键键能数据如下:
化学键 C—H C=O H—H C O(CO)
键能/kJ·mol?1 413 745 436 1075
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
+120 kJ·mol-1
B
(2)①化学反应的焓变应该等于反应物键能减去生成物的键能,所以焓变为(4×413+2×745)-(2×1075+2×436)= +120 kJ·mol-1。初始时容器A、B的压强相等,A容器恒容,随着反应的进行压强逐渐增大(气体物质的量增加);B容器恒压,压强不变;所以达平衡时压强一定是A中大,B中小,此反应压强减小平衡正向移动,所以B的反应平衡更靠右,反应的更多,吸热也更多。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________________
___________________________________________________________。
900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低。
②根据图3得到,900℃时反应产率已经比较高,温度再升高,反应产率的增大并不明显,而生产中的能耗和成本明显增大,经济效益会下降,所以选择900℃为反应最佳温度。
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 电池的负极反应式:__________________________。 电池的正极反应式:6O2+6e? = 6O2?
6CO2+6O2? = 3C2O42? 反应过程中O2的作用是________。 该电池的总反应式:______________________________。
Al–3e–=Al3+(或2Al–6e–=2Al3+)
催化剂
2Al+6CO2=Al2(C2O4)3
(3)明显电池的负极为Al,所以反应一定是Al失电子,该电解质为氯化铝离子液体,所以Al失电子应转化为Al3+,方程式为:Al–3e–=Al3+(或2Al–6e–=2Al3+)。根据电池的正极反应,氧气再第一步被消耗,又在第二步生成,所以氧气为正极反应的催化剂。将方程式加和得到,总反应为:2Al+6CO2=Al2(C2O4)3。
理综化学试题分步解析
可能用到的相对原子质量:H 1 C 12 N 14 O 16
A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应 B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品 C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士 D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
A
A.谷物中的淀粉在酿造中发生水解反应只能得到葡萄糖,葡萄糖要在酒化酶作用下分解,得到酒精和二氧化碳。酒中含有酒精,醋中含有醋酸,显然都不是只水解就可以的。选项A不合理。
B.商代后期铸造出工艺精湛的后(司)母戊鼎属于青铜器,青铜是铜锡合金。选项B合理。
1. 以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
C.陶瓷的制造原料为黏土。选项C合理。
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,是利用青蒿素在乙醚中溶解度较大的原理,将青蒿素提取到乙醚中,所以属于萃取操作。选项D合理。
A. 溶解度:Na2CO3
碳酸钠的溶解度应该大于碳酸氢钠,实际碳酸氢钠在含钠化合物中属于溶解度相对很小的物质
同周期由左向右非金属的气态氢化物的稳定性逐渐增强,所以稳定性应该是:HCl>PH3
C2H5OH分子中有羟基,可形成分子间氢键,从而提高物质沸点
同周期由左向右最高价氧化物的水化物的碱性逐渐减弱,所以碱性应该是:LiOH>Be(OH)2
2. 下列有关物质性质的比较,结论正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小 B. 铁管镀锌层局部破损后,铁管仍不易生锈 C. 反应活化能越高,该反应越易进行 D. 不能用红外光谱区分C2H5OH和CH3OCH3
B
根据“越弱越水解”的原理,HA的Ka越小,代表HA越弱,所以A-的水解越强,应该是NaA的Kh(水解常数)越大
铁管镀锌层局部破损后,形成锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的腐蚀
反应的活化能越高,该反应进行的越困难(可以简单理解为需要“翻越”的山峰越高,“翻越”越困难)
红外光谱是用来检测有机物中的官能团或特定结构的,
C2H5OH和CH3OCH3的官能团明显有较大差异,所以可以用红外光谱区分
3. 下列叙述正确的是
4. 由下列实验及现象推出的相应结论正确的是
实验 现象 结论
A.某溶液中滴加K3[Fe(CN)6]溶液 产生蓝色沉淀 原溶液中有Fe2+,无Fe3+
B.向C6H5ONa溶液中通入CO2 溶液变浑浊 酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 生成黑色沉淀 Ksp(CuS)
B
A.某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中有Fe2+,但是无法证明是否有Fe3+。
B.向C6H5ONa溶液中通入CO2,溶液变浑浊,说明生成了苯酚,根据强酸制弱酸的原则,得到碳酸的酸性强于苯酚。选B正确。
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,虽然有ZnS不溶物,但是溶液中还有Na2S,加入硫酸铜溶液后,Cu2+一定与溶液中的S2-反应得到黑色CuS沉淀,不能证明发生沉淀转化。选项C错误。
D.向溶液中加入硝酸钡溶液,得到白色沉淀(有很多可能),再加入盐酸时,溶液中就会同时存在硝酸钡电离的硝酸根和盐酸电离的氢离子,溶液具有硝酸的强氧化性。如果上一步得到的是亚硫酸钡沉淀,此步就会被氧化为硫酸钡沉淀,依然不溶,则无法证明原溶液有硫酸根离子。选项D错误。
A. 加入NaOH,可增大乙醇的物质的量 B. 增大HBr浓度,有利于生成C2H5Br C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
5. 室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr ? C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
D
A.加入NaOH,中和HBr,平衡逆向移动,可增大乙醇的物质的量。选项A正确。
B.增大HBr浓度,平衡正向移动,有利于生成C2H5Br。选B正确。
C.若反应物增大至2 mol,实际上就是将反应的浓度都增大至原来的2倍,比例不变(两次实验反应物的比例都是1:1,等于方程式中的系数比),这里有一个可以直接使用的结论:只要反应物的投料比等于系数比,达平衡时反应物的转化率一定是相等的。所以两种反应物的转化率一定是1:1。选项C正确。
D.若起始温度提高至60℃,考虑到HBr是挥发性酸,在此温度下会挥发出去,降低HBr的浓度减慢速率,增加了反应时间。选项D错误。
6. LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[ ]下列有关LiH2PO4溶液的叙述正确的是
A. 溶液中存在3个平衡 B. 含P元素的粒子有H2PO4–、HPO42–、PO43– C. 随c初始(H2PO4–)增大,溶液的pH明显变小 D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,
当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
D
A.溶液中存在H2PO4–的电离平衡和水解平衡,存在HPO42–的电离平衡,存在水的电离平衡,所以至少存在4个平衡。选项A错误。
B.含P元素的粒子有H2PO4–、HPO42–、PO43–和H3PO4。B错误。
C.从图1中得到随着c初始(H2PO4–)增大,溶液的pH不过从5.5减小到4.66,谈不上明显变小,同时达到4.66的pH值以后就不变了。选C错误。
D.由图2得到,pH=4.66的时候,δ=0.994,即溶液中所有含P的成分中H2PO4–占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4。选项D正确。
7. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_______________________,Mg在元素周期表中的位置:_____________,Mg(OH)2的电子式:____________________。 (2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
r(H+)
Mg2Si
熔融,电解
NH3,NH4Cl
(1)比较离子半径应该先看电子层,电子层多半径大,电子层相同时看核电荷数,核电荷数越大离子半径越小。Mg在周期表第三周期ⅡA族。氢氧化镁是离子化合物,含有1个Mg2+和2个OH-,可得电子式
(2)根据元素守恒,A2B中就一定有Mg和Si,考虑到各自化合价Mg为+2,Si为-4,所以化学式为Mg2Si。反应②是MgCl2熔融电解得到单质Mg,所以必备条件为:熔融、电解。反应①需要的是Mg2Si、NH3和NH4Cl,而后续过程又得到了NH3和NH4Cl,所以可以循环的是NH3和NH4Cl。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料___________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:___________________________。
SiC
2Mg(OH)2+2SO2+O2=2MgSO4+2H2O
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料,该耐磨材料一定有Si和C,考虑到课本中介绍了碳化硅的高硬度,所以该物质为SiC。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,二氧化硫是酸性氧化物与氢氧化镁这样的碱应该反应得到盐(亚硫酸镁),考虑到题目要求写出得到稳定化合物的方程式,所以产物应该为硫酸镁(亚硫酸镁被空气中的氧气氧化得到),所以反应为:2Mg(OH)2+2SO2+O2=2MgSO4+2H2O。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
依据上述信息,写出制备所需醛 的
可能结构简式:______________________。
CH3CH2CHO,CH3CHO
(5)利用格氏试剂可以制备,现在要求制备,所以可以选择R为CH3CH2,R’为CH3;或者选择R为CH3,R’为CH3CH2,所以对应的醛R’CHO可以是CH3CH2CHO或CH3CHO。
点睛:本题是一道比较基本的元素综合问题,比较新颖的是在题目的最后一问中加入了一个有机小题,这样的无机有机综合题目是比较少见的,当然难度并不大。第(4)小题中的反应,可以参考必修1的课后练习中涉及的钙基固硫问题。方程式中按道理应该加上反应的条件,例如:加热。
8. 化合物N具有镇痛、消炎等药理作用,其合成路线如下:
(1)A的系统命名为____________,
E中官能团的名称为____________。 (2)A→B的反应类型为
____________,从反应所得液态有机混合物中提纯B的常用方法为 ____________。
(3)C→D的化学方程式为_________________________________________。
1,6-己二醇
碳碳双键,酯基
取代反应
减压蒸馏(或蒸馏)
注意反应可逆。
(2)A→B的反应是将A中的一个羟基替换为溴原子,所以反应类型为取代反应。反应后的液态有机混合物应该是A、B混合,B比A少一个羟基,所以沸点的差距应该较大,可以通过蒸馏的方法分离。实际生产中考虑到A、B的沸点可能较高,直接蒸馏的温度较高可能使有机物炭化,所以会进行减压蒸馏以降低沸点。
(1)A为6个碳的二元醇,在第一个和最后一个碳上各有1个羟基,所以名称为1,6-己二醇。明显E中含有碳碳双键和酯基两个官能团。
(4)C的同分异构体
W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为
____________。
(5)F与G的关系为(填序号)____________。 a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
5
c
所以两者的关系为顺反异构,选项c正确。
(6)M的结构简式为
____________。
(7)参照上述合成路线,
以 为原料,采用如下方法制备医药中间体 。
该路线中试剂与条件1为____________,
X的结构简式为____________; 试剂与条件2为____________,
Y的结构简式为____________。
HBr,△
O2/Cu或Ag,△
9. 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题: Ⅰ.采样
采样步骤: ①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用是______。 (2)C中填充的干燥剂是(填序号)______。 a.碱石灰 b.无水CuSO4 c.P2O5
除尘
c
(1)A的过程叫“过滤”,所以其中玻璃棉的作用一定是除去烟道气中的粉尘。
(2)碱石灰是碱性干燥剂可能与NOX反应,所以不能使用。硫酸铜吸水能力太差,一般不用做干燥剂,所以不能使用。P2O5是酸性干燥剂,与NOX不反应
(3)用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
(4)采样步骤②加热烟道气的目的是_______________。
防止NOx溶于冷凝水
(3)实验室通常用洗气瓶来吸收气体,与D相同应该在洗气瓶中加入强碱(氢氧化钠)溶液
(4)加热烟道气的目的是避免水蒸气冷凝后,NOX溶于水中。
Ⅱ.NOx含量的测定 将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3?,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L?1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L?1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。 (5)NO被H2O2氧化为NO3?的离子方程式是__________________________。
(6)滴定操作使用的玻璃仪器主要有_________________。
2NO+3H2O2=2H++2NO3–+2H2O
锥形瓶、酸式滴定管
(5)NO被H2O2氧化为硝酸
(6)滴定中使用酸式滴定管(本题中的试剂都只能使用酸式滴定管)和锥形瓶。
(7)滴定过程中发生下列反应: 3Fe2++NO3?+4H+=NO↑+3Fe3++2H2O Cr2O72? + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_______________mg·m?3。
(8)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”) 若缺少采样步骤③,会使测试结果___________。 若FeSO4标准溶液部分变质,会使测定结果___________。
偏低
偏高
(8)若缺少采样步骤③,装置中有空气,则实际测定的是烟道气和空气混合气体中NOX的含量,测定结果必然偏低。若FeSO4标准溶液部分变质,一定是部分Fe2+被空气中的氧气氧化,计算时仍然认为这部分被氧化的Fe2+是被硝酸根离子氧化的,所以测定结果偏高。
点睛:注意本题中的流程图,装置D实际不是为了测定含量进行吸收,装置D相当于是尾气吸收。样品气的吸收应该是在“采样处”进行的。
10. CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题: (1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3?)∶c(CO32?)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×10?7;K2=5×10?11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
CO32-
10
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,因为得到溶液的碱性较强,所以CO2主要转化为碳酸根离子(CO32-)。若所得溶液c(HCO3?)∶c(CO32?)=2∶1,,则根据第二步电离平衡常数K2 = =5×10?11,所以氢离子浓度为1×10-10mol/L,pH=10。
①已知上述反应中相关的化学键键能数据如下:
化学键 C—H C=O H—H C O(CO)
键能/kJ·mol?1 413 745 436 1075
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
+120 kJ·mol-1
B
(2)①化学反应的焓变应该等于反应物键能减去生成物的键能,所以焓变为(4×413+2×745)-(2×1075+2×436)= +120 kJ·mol-1。初始时容器A、B的压强相等,A容器恒容,随着反应的进行压强逐渐增大(气体物质的量增加);B容器恒压,压强不变;所以达平衡时压强一定是A中大,B中小,此反应压强减小平衡正向移动,所以B的反应平衡更靠右,反应的更多,吸热也更多。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________________
___________________________________________________________。
900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低。
②根据图3得到,900℃时反应产率已经比较高,温度再升高,反应产率的增大并不明显,而生产中的能耗和成本明显增大,经济效益会下降,所以选择900℃为反应最佳温度。
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 电池的负极反应式:__________________________。 电池的正极反应式:6O2+6e? = 6O2?
6CO2+6O2? = 3C2O42? 反应过程中O2的作用是________。 该电池的总反应式:______________________________。
Al–3e–=Al3+(或2Al–6e–=2Al3+)
催化剂
2Al+6CO2=Al2(C2O4)3
(3)明显电池的负极为Al,所以反应一定是Al失电子,该电解质为氯化铝离子液体,所以Al失电子应转化为Al3+,方程式为:Al–3e–=Al3+(或2Al–6e–=2Al3+)。根据电池的正极反应,氧气再第一步被消耗,又在第二步生成,所以氧气为正极反应的催化剂。将方程式加和得到,总反应为:2Al+6CO2=Al2(C2O4)3。
同课章节目录
