2019年中考科学总复习第36讲 酸和碱(精讲)(课件 33张PPT)
文档属性
| 名称 | 2019年中考科学总复习第36讲 酸和碱(精讲)(课件 33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-21 00:00:00 | ||
图片预览











文档简介
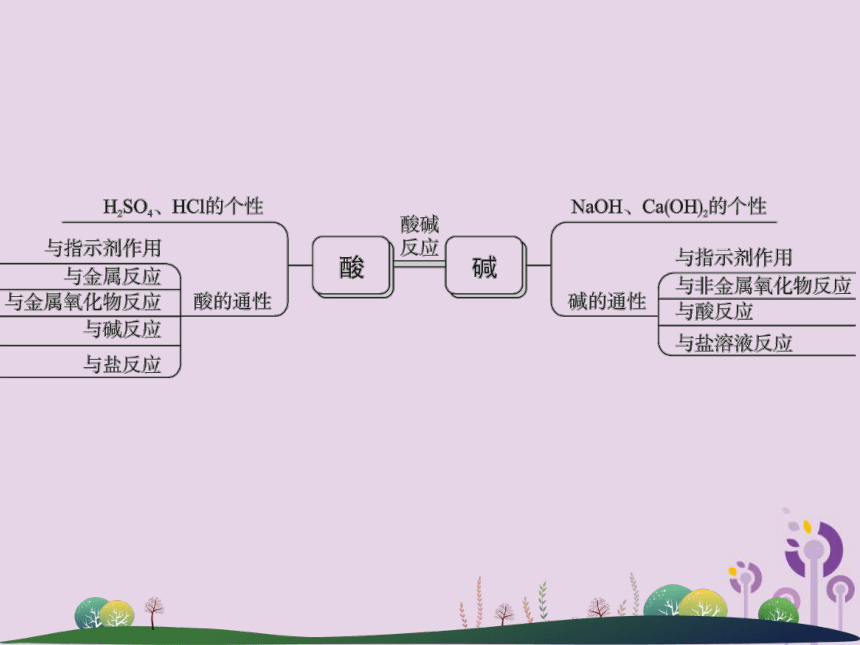
课件33张PPT。第36讲 酸和碱1.酸的定义:电离时所生成的阳离子全部是 _____ 的化合物叫做酸。
2.几种常见的酸H+3.酸的共性
(1)能使紫色石蕊试液变红,不能使无色酚酞试液变色。
(2)酸+碱→盐+水(酸碱反应)
NaOH+HCl=====
Cu(OH)2+H2SO4=====
(3)酸+金属氧化物→盐+水
Fe2O3+3H2SO4=====
CuO+2HCl======
(4)酸+金属→盐+氢气
Mg+2HCl=====
Fe+H2SO4======
(5)酸+盐→新盐+新酸
HCl+AgNO3=====
H2SO4+BaCl2=====
4.酸有相似性质的原因是其在水溶液中电离出的阳离子全部是 。
NaCl+H2OCuSO4+2H2OFe2(SO4)3+3H2OCuCl2+H2OMgCl2+H2↑FeSO4+H2↑AgCl↓+HNO3BaSO4↓+2HClH+1.碱的定义:在溶液中电离出的阴离子全部是 ________ 的化合物叫做碱。
2.几种常见的碱 OH-3.碱的共性
(1)可溶性碱都能使紫色石蕊试液变 ,使无色酚酞试液变 。
(2)碱+非金属氧化物→盐+水
2NaOH+SO2=====
Ca(OH)2+CO2=====
应用:工业上常用碱溶液来吸收SO2气体,澄清石灰水可用来检验CO2气体。
(3)酸+碱→盐+水(酸碱反应)
(4)碱+盐→新碱+新盐
2NaOH+CuCl2===== 现象:产生蓝色絮状沉淀
3NaOH+FeCl3===== 现象:产生红褐色沉淀
Ca(OH)2+Na2CO3=====
应用:用于实验室制取少量的氢氧化钠。
蓝色红色Na2SO3+H2OCaCO3↓+H2OCu(OH)2↓+2NaClFe(OH)3↓+3NaClCaCO3↓+2NaOH4.碱有相似性质的原因是其在水溶液中电离出的阴离子全部是 ______ 。
5.氢氧化钠、氢氧化钙变质的探究(详见实验突破)
6.氢氧化钠有强烈的 ________ ,使用时要十分小心。若不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。OH-腐蚀性1.酸碱反应: _________________________ ,属于复分解反应中的一种。如用“胃舒平”(主要成分是氢氧化铝)治疗胃酸(主要成分是盐酸)过多;用熟石灰降低土壤的酸性等。
2.酸碱反应的实质: 。酸与碱作用生成盐和水的反应OH-+H+=====H2O1.指示剂只能粗略指示溶液的酸碱性(定性指示),而pH则能表示溶液的 ______________ 。
2.pH——酸碱度的表示方法
(1)范围:通常在0~14之间。
(2)测定:最简便的方法是使用pH试纸。用洁净干燥的玻璃棒蘸取待测液滴在 _______ 上,把试纸显示的颜色与 ___________ 对照。
(3)pH大小与溶液的酸碱性和指示剂的关系
酸碱度pH试纸标准比色卡返回氢氧化钠变质的探究
1.NaOH变质的原因
变质的化学反应为 。
2.怎样确定NaOH是否变质?2NaOH+CO2===Na2CO3+H2O3.怎样确定NaOH变质的程度?
4.保存方法:氢氧化钠要 保存。
【知识拓展】 用Ca(OH)2溶液虽然能检验Na2CO3的存在,但对NaOH的检验会产生干扰。密封氢氧化钙变质的探究
1.Ca(OH)2变质的原因:变质的化学反应为
。
2.怎样确定Ca(OH)2是否变质?
取少量样品,向其中滴加足量的 ,如有 产生,则证明Ca(OH)2已经变质。
3.怎样确定Ca(OH)2变质的程度?
4.保存方法:氢氧化钙要 保存。Ca(OH)2+CO2===CaCO3↓+H2O稀盐酸气泡密封返回1.(2018,广西)下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等C2.(2018,常州)利用如图所示的实验探究物质的性质。下列叙述错误的是( )
A.②处有气泡,③处无现象,则可判断锌、铜的金属活动性
B.①②④⑤处有明显现象,则M可能为稀盐酸
C.⑤处固体明显减少,则M可能为稀硫酸
D.⑥处反应放热,则N可能是氢氧化钠溶液C3.(2017,杭州)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“〇”“ ”表示不同离子)。则下列说法正确的是( )
A.〇表示氯离子
B. 表示钠离子
C.●可用适量硝酸银溶液和足量稀硝酸进行检测
D.此反应的实质是 和〇结合生成水分子D4.(2018,宜昌)用pH计测得一些物质的pH值如下:
下列说法中正确的是( )
A.鸡蛋清和牛奶显碱性
B.牛奶比西瓜汁的酸性强
C.炉具清洁剂可除水垢
D.胃酸过多的人应少饮苹果汁D5.(2018,杭州)小金做了如下实验:将4.2克铁粉和4.0克氧化铜粉末均匀混合,然后一次性投入盛有200克9.8%稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液是浅绿色。由此小金作出下列判断,其中不合理的是( )
A.“立即出现红色固体”是由于很快发生了如下转化:
B.“产生大量无色气泡”是由于发生了如下反应:
Fe+H2SO4===FeSO4+H2↑
C.该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应
D.在不同浓度的硫酸铜和稀硫酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应D6.(2018,舟山)在科学拓展课中,甲同学向两个
充满CO2气体的塑料瓶中分别加入NaOH溶液和
Ca(OH)2溶液。迅速盖紧瓶盖后充分振荡,结果
发现两个塑料瓶都变瘪。他认为据此实验现象,
可以判定NaOH和Ca(OH)2均能与CO2发生反应。
(1)乙同学认为上述判定方法还存在不严密之处。
他的理由是 。
(2)两同学根据B瓶中出现的浑浊现象,判定Ca(OH)2与CO2发生了反应,提出了可以从是否有新物质生成的角度去判断。那么,若要判定NaOH和CO2发生了反应。在排除了(1)中的干扰因素后。接下来的方法是
。二氧化碳能够溶于水并且能和水反应取A中适量液体于试管中,加入足量稀盐酸,观察是否产生气泡7.(2017,嘉兴)在拓展性课程活动中,小明利用以下常见物品验证酸的一些性质:白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、苏打(碳酸钠)。
【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
【实验过程】
(1)在鸡蛋壳上滴加白醋,产生无色、无味的气体,该气体能使澄清石灰水变浑浊。则鸡蛋壳中一定含有 (用离子符号表示)。(2)小明知道酸能够与铁发生反应产生氢气,但当他将足量的白醋加入放有铁钉的容器中,没有看到明显的气泡产生。小明很疑惑,于是提出猜想:气泡不明显可能与酸的浓度有关。要验证与酸的浓度有关,应选择下列试剂中的 。(选填编号)
A.3%的盐酸 B.5%的醋酸
C.5%的盐酸
(3)小明利用已有物品还想验证酸与碱的反应,请你帮助完成下列实验设计:
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学。B返回【例1】 如图表示化学反应中溶液的颜色变化。下列叙述错误的是( )
?
A.若X是稀硫酸,a可能是紫色石蕊试液
B.若X是稀硫酸,b可能是氧化物
C.若X是稀盐酸,c不可能是单质
D.若X是稀盐酸,d不可能是单质C1.(2017,深圳)小明同学归纳总结了初中所学稀硫酸的化学性质,并用“H2SO4+X→盐+Y”这种表达式进行整理,下列小明的观点错误的是( )A【例2】 (2017,杭州)小金通过图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量20%的NaOH溶液,振荡集气瓶后打开止水夹。
?
(1)打开止水夹后观察到的现象是
。
(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有 。氯化钙溶液流入左边集气瓶中,并且溶液变浑浊NaOH和NaCl2.对知识的归纳和总结是学好化学的重要方法。在学习了碱的性质后,小丽总结了氢氧化钙的四条化学性质(如图),即氢氧化钙能够与图中四类物质发生化学反应。
?
(1)为了检验反应③能够发生,你可选择下列哪些物质? 。
A.HCl B.FeCl3
C.CaO D.KOH E.Na2CO3
(2)农业上常用氢氧化钙来改良酸性土壤,是利用其化学性质中的
(填序号)。B、E②【例3】 (2018,益阳)某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液pH的变化如图所示。下列说法正确的是( )
A.a点所示溶液呈酸性
B.向b点所示溶液中滴加石蕊溶液,溶液呈紫色
C.该实验是将NaOH溶液逐滴滴入稀硫酸中
D.c点所示溶液中,含有的溶质是Na2SO4和NaOHB3.(2018,南京)如图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。
?
下列说法正确的是( )
A.在a、b、c三种曲线所示的实验中,所用盐酸浓度越大,V时所得溶液的pH越大
B.在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色
C.在a、b、c三种曲线所示的实验中,反应速率相同
D.在a、b、c三种曲线所示的实验中,溶液酸性由强到弱的顺序是a>b>cA【例4】 (2017,鄂州)某实验小组的同学用氢氧化钠溶液和盐酸做酸碱反应的实验,当他们向盛有氢氧化钠溶液的烧杯中滴加一定量的稀盐酸后,发现忘记了滴加指示剂。他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行探究。
(1)写出该酸碱反应的化学方程式: 。
(2)探究烧杯内溶液中的溶质的成分。
【猜想】猜想一:可能是NaCl和NaOH;
猜想二:可能只有NaCl;
猜想三: 。
【进行实验】NaOH+HCl===NaCl+H2O可能是NaCl和HCl4.(2018,宁波)向盛有20g 10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是( )B
2.几种常见的酸H+3.酸的共性
(1)能使紫色石蕊试液变红,不能使无色酚酞试液变色。
(2)酸+碱→盐+水(酸碱反应)
NaOH+HCl=====
Cu(OH)2+H2SO4=====
(3)酸+金属氧化物→盐+水
Fe2O3+3H2SO4=====
CuO+2HCl======
(4)酸+金属→盐+氢气
Mg+2HCl=====
Fe+H2SO4======
(5)酸+盐→新盐+新酸
HCl+AgNO3=====
H2SO4+BaCl2=====
4.酸有相似性质的原因是其在水溶液中电离出的阳离子全部是 。
NaCl+H2OCuSO4+2H2OFe2(SO4)3+3H2OCuCl2+H2OMgCl2+H2↑FeSO4+H2↑AgCl↓+HNO3BaSO4↓+2HClH+1.碱的定义:在溶液中电离出的阴离子全部是 ________ 的化合物叫做碱。
2.几种常见的碱 OH-3.碱的共性
(1)可溶性碱都能使紫色石蕊试液变 ,使无色酚酞试液变 。
(2)碱+非金属氧化物→盐+水
2NaOH+SO2=====
Ca(OH)2+CO2=====
应用:工业上常用碱溶液来吸收SO2气体,澄清石灰水可用来检验CO2气体。
(3)酸+碱→盐+水(酸碱反应)
(4)碱+盐→新碱+新盐
2NaOH+CuCl2===== 现象:产生蓝色絮状沉淀
3NaOH+FeCl3===== 现象:产生红褐色沉淀
Ca(OH)2+Na2CO3=====
应用:用于实验室制取少量的氢氧化钠。
蓝色红色Na2SO3+H2OCaCO3↓+H2OCu(OH)2↓+2NaClFe(OH)3↓+3NaClCaCO3↓+2NaOH4.碱有相似性质的原因是其在水溶液中电离出的阴离子全部是 ______ 。
5.氢氧化钠、氢氧化钙变质的探究(详见实验突破)
6.氢氧化钠有强烈的 ________ ,使用时要十分小心。若不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。OH-腐蚀性1.酸碱反应: _________________________ ,属于复分解反应中的一种。如用“胃舒平”(主要成分是氢氧化铝)治疗胃酸(主要成分是盐酸)过多;用熟石灰降低土壤的酸性等。
2.酸碱反应的实质: 。酸与碱作用生成盐和水的反应OH-+H+=====H2O1.指示剂只能粗略指示溶液的酸碱性(定性指示),而pH则能表示溶液的 ______________ 。
2.pH——酸碱度的表示方法
(1)范围:通常在0~14之间。
(2)测定:最简便的方法是使用pH试纸。用洁净干燥的玻璃棒蘸取待测液滴在 _______ 上,把试纸显示的颜色与 ___________ 对照。
(3)pH大小与溶液的酸碱性和指示剂的关系
酸碱度pH试纸标准比色卡返回氢氧化钠变质的探究
1.NaOH变质的原因
变质的化学反应为 。
2.怎样确定NaOH是否变质?2NaOH+CO2===Na2CO3+H2O3.怎样确定NaOH变质的程度?
4.保存方法:氢氧化钠要 保存。
【知识拓展】 用Ca(OH)2溶液虽然能检验Na2CO3的存在,但对NaOH的检验会产生干扰。密封氢氧化钙变质的探究
1.Ca(OH)2变质的原因:变质的化学反应为
。
2.怎样确定Ca(OH)2是否变质?
取少量样品,向其中滴加足量的 ,如有 产生,则证明Ca(OH)2已经变质。
3.怎样确定Ca(OH)2变质的程度?
4.保存方法:氢氧化钙要 保存。Ca(OH)2+CO2===CaCO3↓+H2O稀盐酸气泡密封返回1.(2018,广西)下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等C2.(2018,常州)利用如图所示的实验探究物质的性质。下列叙述错误的是( )
A.②处有气泡,③处无现象,则可判断锌、铜的金属活动性
B.①②④⑤处有明显现象,则M可能为稀盐酸
C.⑤处固体明显减少,则M可能为稀硫酸
D.⑥处反应放热,则N可能是氢氧化钠溶液C3.(2017,杭州)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“〇”“ ”表示不同离子)。则下列说法正确的是( )
A.〇表示氯离子
B. 表示钠离子
C.●可用适量硝酸银溶液和足量稀硝酸进行检测
D.此反应的实质是 和〇结合生成水分子D4.(2018,宜昌)用pH计测得一些物质的pH值如下:
下列说法中正确的是( )
A.鸡蛋清和牛奶显碱性
B.牛奶比西瓜汁的酸性强
C.炉具清洁剂可除水垢
D.胃酸过多的人应少饮苹果汁D5.(2018,杭州)小金做了如下实验:将4.2克铁粉和4.0克氧化铜粉末均匀混合,然后一次性投入盛有200克9.8%稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液是浅绿色。由此小金作出下列判断,其中不合理的是( )
A.“立即出现红色固体”是由于很快发生了如下转化:
B.“产生大量无色气泡”是由于发生了如下反应:
Fe+H2SO4===FeSO4+H2↑
C.该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应
D.在不同浓度的硫酸铜和稀硫酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应D6.(2018,舟山)在科学拓展课中,甲同学向两个
充满CO2气体的塑料瓶中分别加入NaOH溶液和
Ca(OH)2溶液。迅速盖紧瓶盖后充分振荡,结果
发现两个塑料瓶都变瘪。他认为据此实验现象,
可以判定NaOH和Ca(OH)2均能与CO2发生反应。
(1)乙同学认为上述判定方法还存在不严密之处。
他的理由是 。
(2)两同学根据B瓶中出现的浑浊现象,判定Ca(OH)2与CO2发生了反应,提出了可以从是否有新物质生成的角度去判断。那么,若要判定NaOH和CO2发生了反应。在排除了(1)中的干扰因素后。接下来的方法是
。二氧化碳能够溶于水并且能和水反应取A中适量液体于试管中,加入足量稀盐酸,观察是否产生气泡7.(2017,嘉兴)在拓展性课程活动中,小明利用以下常见物品验证酸的一些性质:白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、苏打(碳酸钠)。
【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
【实验过程】
(1)在鸡蛋壳上滴加白醋,产生无色、无味的气体,该气体能使澄清石灰水变浑浊。则鸡蛋壳中一定含有 (用离子符号表示)。(2)小明知道酸能够与铁发生反应产生氢气,但当他将足量的白醋加入放有铁钉的容器中,没有看到明显的气泡产生。小明很疑惑,于是提出猜想:气泡不明显可能与酸的浓度有关。要验证与酸的浓度有关,应选择下列试剂中的 。(选填编号)
A.3%的盐酸 B.5%的醋酸
C.5%的盐酸
(3)小明利用已有物品还想验证酸与碱的反应,请你帮助完成下列实验设计:
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学。B返回【例1】 如图表示化学反应中溶液的颜色变化。下列叙述错误的是( )
?
A.若X是稀硫酸,a可能是紫色石蕊试液
B.若X是稀硫酸,b可能是氧化物
C.若X是稀盐酸,c不可能是单质
D.若X是稀盐酸,d不可能是单质C1.(2017,深圳)小明同学归纳总结了初中所学稀硫酸的化学性质,并用“H2SO4+X→盐+Y”这种表达式进行整理,下列小明的观点错误的是( )A【例2】 (2017,杭州)小金通过图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量20%的NaOH溶液,振荡集气瓶后打开止水夹。
?
(1)打开止水夹后观察到的现象是
。
(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有 。氯化钙溶液流入左边集气瓶中,并且溶液变浑浊NaOH和NaCl2.对知识的归纳和总结是学好化学的重要方法。在学习了碱的性质后,小丽总结了氢氧化钙的四条化学性质(如图),即氢氧化钙能够与图中四类物质发生化学反应。
?
(1)为了检验反应③能够发生,你可选择下列哪些物质? 。
A.HCl B.FeCl3
C.CaO D.KOH E.Na2CO3
(2)农业上常用氢氧化钙来改良酸性土壤,是利用其化学性质中的
(填序号)。B、E②【例3】 (2018,益阳)某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液pH的变化如图所示。下列说法正确的是( )
A.a点所示溶液呈酸性
B.向b点所示溶液中滴加石蕊溶液,溶液呈紫色
C.该实验是将NaOH溶液逐滴滴入稀硫酸中
D.c点所示溶液中,含有的溶质是Na2SO4和NaOHB3.(2018,南京)如图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。
?
下列说法正确的是( )
A.在a、b、c三种曲线所示的实验中,所用盐酸浓度越大,V时所得溶液的pH越大
B.在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色
C.在a、b、c三种曲线所示的实验中,反应速率相同
D.在a、b、c三种曲线所示的实验中,溶液酸性由强到弱的顺序是a>b>cA【例4】 (2017,鄂州)某实验小组的同学用氢氧化钠溶液和盐酸做酸碱反应的实验,当他们向盛有氢氧化钠溶液的烧杯中滴加一定量的稀盐酸后,发现忘记了滴加指示剂。他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行探究。
(1)写出该酸碱反应的化学方程式: 。
(2)探究烧杯内溶液中的溶质的成分。
【猜想】猜想一:可能是NaCl和NaOH;
猜想二:可能只有NaCl;
猜想三: 。
【进行实验】NaOH+HCl===NaCl+H2O可能是NaCl和HCl4.(2018,宁波)向盛有20g 10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是( )B
同课章节目录
