鲁科版高中化学 选修四 第三章 第三节 沉淀溶解平衡(32张)
文档属性
| 名称 | 鲁科版高中化学 选修四 第三章 第三节 沉淀溶解平衡(32张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-23 08:05:01 | ||
图片预览











文档简介
1、25℃下,在1.00L、0.030mol/LAgNO3溶液中加入0.50L、0.060mol/L的BaCl2溶液,能否生成AgCl沉淀?[Ksp(AgCl)=1.80×10-10]
2、25℃时,Ksp(PbI2)= 7.1×10-9 mol3?l-3求PbI2的饱和溶液中的c(Pb2+)和c(I-).
[解析]: PbI2 Pb2+ + 2I-
浓度关系: X
2X
溶解的PbI2 的浓度为:1.2 ×10-3mol?l-1
Ksp= c(Pb2+).c(I-)2 = c(Pb2+)×22.c(Pb2+)2
4X3 = 7.1×10-9 mol3?l-3
c(Pb2+)=1.2×10-3mol?l-1;
c(I-)=2c(Pb2+)=2.4×10-3mol?l-1
几种难溶电解质在25℃时的溶解平衡和溶度积: AgCl(s) Ag+ (aq) + Cl- (aq)
Ksp= c(Ag+)c(Cl-) = 1.8×10-10mol2?L-2 AgBr(s) Ag+ (aq) + Br- (aq)
Ksp= c(Ag+)c(Br-) = 5.0×10-13mol2?L-2 AgI(s) Ag+ (aq) + I- (aq)
Ksp= c(Ag+)c(I-) = 8.3×10-17mol2?L-2 Mg(OH)2(s) Mg2+ (aq) +2OH- (aq)
Ksp= c(Mg2+)c(OH-)2 = 5.6×10-12mol3?L-3
溶解能力大小有:AgCl > AgBr > AgI
问:AgCl、Mg(OH)2哪个更难溶?能由Ksp直接判断吗?
常温下AgCl、Mg(OH)2哪个更难溶?
[解析]:对AgCl有:
Ksp(AgCl) = c(Ag+).c(Cl-)
= c(Ag+)2= 1.8×10-10mol2?l-2
c(Ag+)=1.34×10-5mol?l-1
即AgCl的溶解浓度为: 1.34×10-5mol ?l-1
对Mg(OH)2有:
Ksp[Mg(OH)2]= c(Mg2+)c(OH-)2=4c(Mg2+)3
= 5.6×10-12mol3?l-3
c(Mg2+)=1.12×10-4mol?l-1 ;
即Mg(OH)2的溶解浓度为:1.12×10-4mol ?l-1。
可以看到:AgCl比Mg(OH)2更难溶!
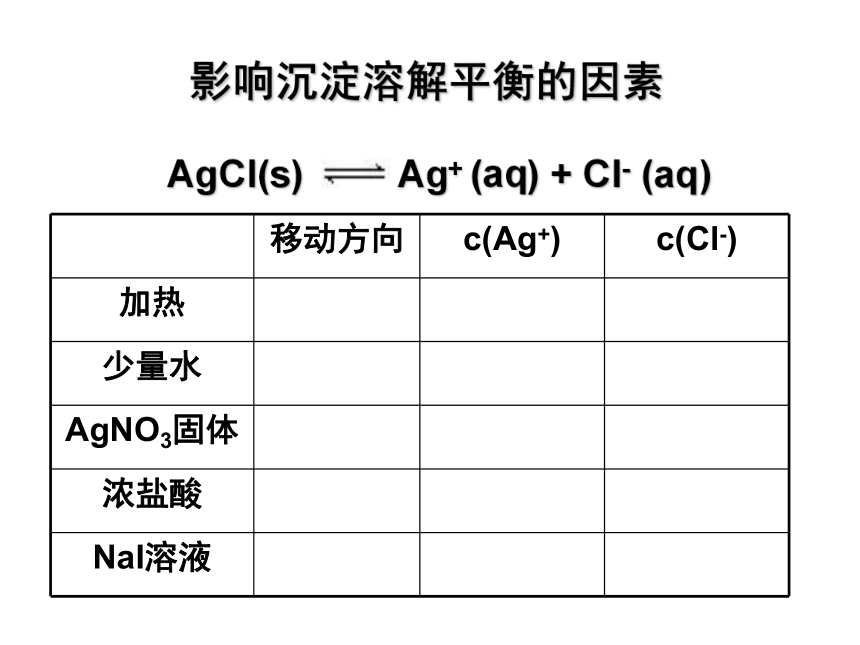
影响沉淀溶解平衡的因素
AgCl(s) Ag+ (aq) + Cl- (aq)
移动方向 c(Ag+) c(Cl-)
加热
少量水
AgNO3固体
浓盐酸
NaI溶液
比较离子积(Q )与溶度积(Ksp)的大小
沉淀溶解平衡的应用
饱和溶液
逆向--产生沉淀
正向--沉淀溶解
1、沉淀的生成
(2)原则:生成沉淀进行得越完全越好。
Q>Ksp,生成沉淀
(3)方法:
(1)应用:除杂或提纯
②加沉淀剂
①调pH值
(1)某工厂将溶液pH调节到3~4,可除1mol·L-1CuSO4溶液中的0.05mol·L-1Fe3+杂质,原因是什么?
已知25℃ 时,Cu(OH)2 Ksp=2.2×10-20,Fe(OH)3的Ksp=2.6×10-39 。
(2)如果误食可溶性钡盐,造成钡中毒,可用给硫酸钠溶液给患者洗胃,为什么?若要有效地除去胃中的Ba2+,所用NaSO4溶液的浓度是多少?
已知:Ksp(BaSO4)=1.1×10-10,且当剩余离子即平衡离子浓度<10-5mol·L-1时,认为离子已沉淀完全或离子已有效除去。
2. 沉淀的溶解
(1)原理:通过反应,使溶解平衡体系中的某种离子浓度减小,平衡向沉淀溶解的方向移动,就达到使沉淀溶解的目的,即使Q < Ksp , 沉淀溶解
(2)应用:
钡餐为什么不用BaCO3?
3、沉淀的转化
(1)定义:由一种难溶物质转化为另一种难溶物质的过程。
(2)实质:沉淀溶解平衡的移动。
一般来说,沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
(3)应用:
除水垢[主要成分为CaCO3、Mg(OH)2等]
你能否通过化学平衡移动的原理
(Q、Ksp关系)解决问题?
1、不刷牙,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,最终形成蛀牙,其原因是 。
Ca5(PO4)3OH(s)
5Ca2+(aq) + 3PO43-(aq) + OH- (aq)
羟基磷灰石
2、含钙牙膏防治龋齿的化学原理
含氟牙膏防治龋齿的化学原理
+ F-
羟基磷灰石
Ca5(PO4)3OH(s)
5Ca2+(aq) + 3PO43-(aq) + OH- (aq)
沉淀转化:
沉淀溶解 + 沉淀生成
难溶物 Ksp(25℃)
Ca5(PO4)3(OH) 6.8×10-37
Ca5(PO4)3F 2.8×10-61
当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成各种奇形异状的溶洞。你知道它是如何形成的吗?
交流·研讨
*
水滴石穿
溶洞的形成
*
滴水成石
*
交流·研讨
珊瑚虫是海洋中的一种腔肠动物,它们可以从周围海水中获取Ca2+和HCO3-,经反应形成石灰石外壳:
Ca2+ + 2HCO3- CaCO3↓ +CO2↑+H2O
珊瑚周围的藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他的化石燃料等因素,都导致空气中CO2 增多,从而海水中CO2 的浓度增大,使平衡
Ca2+ +2HCO3- CaCO3↓+CO2↑+H2O 左移,将珊瑚虫的外壳(CaCO3 )溶解,从而干扰珊瑚的生长,甚至造成珊瑚虫的死亡。
*
沉淀溶解平衡的计算
1.根据溶度积计算离子浓度
例1.25℃时,Ksp(PbI2)=7.1×10-9,求PbI2饱和溶液中的[Pb2+]和[I-]=?在[I-]=0.1mol/L溶液中[Pb2+]的最大值为多少?
2.已知溶度积计算溶解度,反之亦然:
例2.已知Ksp[Mg(OH)2]=5.6×10-12, Ksp(MgCO3)=6.8×10-6,求这两种饱和溶液中的[Mg2+]分别为多少?
例 3. 25℃时,Ksp(PbI2)=7.1×10-9,求PbI2的溶解度S=?
3.有关沉沉生成和溶解的计算
例4.在1L含1.0×10-3mol/L的SO42-溶液中,加入0.01mol BaCl2(假设溶液体积不变)能否有效除去SO42-?已知:Ksp(BaSO4)= 1.1×10-10
例5.将4×10-3mol/L的Pb(NO3)2溶液与4×10-3mol/L的KI溶液等体积混合能否有沉淀析出?Ksp(PbI2)= 7.1×10-9
4.有关沉淀转化计算
例6.在白色ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液为什么会有黑色CuS沉淀生成?已知:Ksp(ZnS)=1.6×10-24,
Ksp(CuS) =1.3×10-36
解:在ZnS沉淀溶解平衡体系中产生的硫离子浓度为:[S2-]=[Zn2+]=(Ksp)1/2
=(1.6×10-24)1/2=1.26×10-12 mol/L
Qc(CuS)=c(Cu2+) ·c(S2-)=(1.0×10- 3)×(1.26×10-12)=1.26×10-15
Qc(CuS)>Ksp(CuS)
一般来说,沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
结论1:
沉淀转化的条件:一般是一种沉淀转化成另一种更难溶的沉淀,但在特殊情况下也可以实现溶解度由小到大的沉淀的转化。
例7.已知BaSO4(Ksp=1.1×10-10)比BaCO3(Ksp=5.1×10-9)的溶解度小,通过计算分析为什么在饱和碳酸钠溶液中能发生由硫酸钡到碳酸钡的转化?
例8.在0.1mol/LKCl和0.1mol/LK2CrO4的混合溶液中,逐滴加入AgNO3溶液,问最先产生哪种沉淀?(已知AgCl的Ksp=1.8×10-10,Ag2CrO4的Ksp=1.1×10-12)
结论2:
当多种难溶物在同一溶液中都可能生成,且都含有同种离子时,则该离子的浓度越小(即溶解度越小),对应的难溶物就越优先沉淀。
*
铜矿污水
达标水
沉淀溶解平衡的计算
怎样使铜矿污水成为达标水?
问题讨论1:
——调节pH法、沉淀剂法
除去不溶性固体杂质后
主要污染物
c(H+)=0.1mol/L pH=1
c(Cu2+ )=0.05mol/L
依照国家GB8978-2003
《污水综合排放标准》
中性水(pH≈7)
c(Cu2+ )≤ 1×10-7mol/L
沉淀的生成
小烧杯中现有含Cu2+的酸性污水10mL,向其中加入氢氧化钙粉末适量,搅拌,加水至40mL,再次搅拌,静置。
问题讨论1:
pH=7的水中c(Cu2+ )达到排放标准吗?
怎样定量分析这个问题?
Ksp=c(Cu2+)×c 2(OH-)
pH=7
c(Cu2+) =2.2×10-6 mol/L
> 1×10-7mol/L
难溶物 Ksp(25℃)
Cu(OH)2 2.2×10-20
依照国家GB8978-2003
《污水综合排放标准》制定
c(Cu2+)≤ 1×10-7mol/L
再思考:
怎样做才能使铜矿污水中的c(Cu2+)达到排放标准?
市
场
调
查
常见含铜难溶物 溶度积常数 Ksp
Cu(OH)2 2.2×10-20
CuS 6.4×10-36
CuCO3
1.4×10-10
常见硫化物 大约价格
Na2S 3000 元/吨
ZnS(闪锌矿) 4050元/吨
FeS(硫化亚铁矿) 800元/吨
8.0×10-28
8.0×10-9
8.0×10-9
问题讨论2:
试定量分析FeS与上层清液中低浓度的Cu2+反应转化为CuS的可行性
常见硫化物 25℃Ksp
FeS 6.4×10-17
CuS 6.4×10-36
FeS(s)
Fe2+
S2-
+
+
Cu2+
(aq)
(aq)
(aq)
CuS(s)
大量
Fe2+
沉淀的转化
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 :BaSO4不溶于酸,但可以用饱和Na2CO3溶液处理转化为易溶于酸的BaCO3
BaSO4 、BaCO3
Ba2+
BaSO4
……
BaCO3
1、 BaSO4的Ksp比 BaCO3小,为什么可以转化?
2、饱和Na2CO3溶液的作用是什么?
3、如何操作才能保证绝大多数BaSO4 转化为BaCO3?
2、25℃时,Ksp(PbI2)= 7.1×10-9 mol3?l-3求PbI2的饱和溶液中的c(Pb2+)和c(I-).
[解析]: PbI2 Pb2+ + 2I-
浓度关系: X
2X
溶解的PbI2 的浓度为:1.2 ×10-3mol?l-1
Ksp= c(Pb2+).c(I-)2 = c(Pb2+)×22.c(Pb2+)2
4X3 = 7.1×10-9 mol3?l-3
c(Pb2+)=1.2×10-3mol?l-1;
c(I-)=2c(Pb2+)=2.4×10-3mol?l-1
几种难溶电解质在25℃时的溶解平衡和溶度积: AgCl(s) Ag+ (aq) + Cl- (aq)
Ksp= c(Ag+)c(Cl-) = 1.8×10-10mol2?L-2 AgBr(s) Ag+ (aq) + Br- (aq)
Ksp= c(Ag+)c(Br-) = 5.0×10-13mol2?L-2 AgI(s) Ag+ (aq) + I- (aq)
Ksp= c(Ag+)c(I-) = 8.3×10-17mol2?L-2 Mg(OH)2(s) Mg2+ (aq) +2OH- (aq)
Ksp= c(Mg2+)c(OH-)2 = 5.6×10-12mol3?L-3
溶解能力大小有:AgCl > AgBr > AgI
问:AgCl、Mg(OH)2哪个更难溶?能由Ksp直接判断吗?
常温下AgCl、Mg(OH)2哪个更难溶?
[解析]:对AgCl有:
Ksp(AgCl) = c(Ag+).c(Cl-)
= c(Ag+)2= 1.8×10-10mol2?l-2
c(Ag+)=1.34×10-5mol?l-1
即AgCl的溶解浓度为: 1.34×10-5mol ?l-1
对Mg(OH)2有:
Ksp[Mg(OH)2]= c(Mg2+)c(OH-)2=4c(Mg2+)3
= 5.6×10-12mol3?l-3
c(Mg2+)=1.12×10-4mol?l-1 ;
即Mg(OH)2的溶解浓度为:1.12×10-4mol ?l-1。
可以看到:AgCl比Mg(OH)2更难溶!
影响沉淀溶解平衡的因素
AgCl(s) Ag+ (aq) + Cl- (aq)
移动方向 c(Ag+) c(Cl-)
加热
少量水
AgNO3固体
浓盐酸
NaI溶液
比较离子积(Q )与溶度积(Ksp)的大小
沉淀溶解平衡的应用
饱和溶液
逆向--产生沉淀
正向--沉淀溶解
1、沉淀的生成
(2)原则:生成沉淀进行得越完全越好。
Q>Ksp,生成沉淀
(3)方法:
(1)应用:除杂或提纯
②加沉淀剂
①调pH值
(1)某工厂将溶液pH调节到3~4,可除1mol·L-1CuSO4溶液中的0.05mol·L-1Fe3+杂质,原因是什么?
已知25℃ 时,Cu(OH)2 Ksp=2.2×10-20,Fe(OH)3的Ksp=2.6×10-39 。
(2)如果误食可溶性钡盐,造成钡中毒,可用给硫酸钠溶液给患者洗胃,为什么?若要有效地除去胃中的Ba2+,所用NaSO4溶液的浓度是多少?
已知:Ksp(BaSO4)=1.1×10-10,且当剩余离子即平衡离子浓度<10-5mol·L-1时,认为离子已沉淀完全或离子已有效除去。
2. 沉淀的溶解
(1)原理:通过反应,使溶解平衡体系中的某种离子浓度减小,平衡向沉淀溶解的方向移动,就达到使沉淀溶解的目的,即使Q < Ksp , 沉淀溶解
(2)应用:
钡餐为什么不用BaCO3?
3、沉淀的转化
(1)定义:由一种难溶物质转化为另一种难溶物质的过程。
(2)实质:沉淀溶解平衡的移动。
一般来说,沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
(3)应用:
除水垢[主要成分为CaCO3、Mg(OH)2等]
你能否通过化学平衡移动的原理
(Q、Ksp关系)解决问题?
1、不刷牙,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,最终形成蛀牙,其原因是 。
Ca5(PO4)3OH(s)
5Ca2+(aq) + 3PO43-(aq) + OH- (aq)
羟基磷灰石
2、含钙牙膏防治龋齿的化学原理
含氟牙膏防治龋齿的化学原理
+ F-
羟基磷灰石
Ca5(PO4)3OH(s)
5Ca2+(aq) + 3PO43-(aq) + OH- (aq)
沉淀转化:
沉淀溶解 + 沉淀生成
难溶物 Ksp(25℃)
Ca5(PO4)3(OH) 6.8×10-37
Ca5(PO4)3F 2.8×10-61
当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成各种奇形异状的溶洞。你知道它是如何形成的吗?
交流·研讨
*
水滴石穿
溶洞的形成
*
滴水成石
*
交流·研讨
珊瑚虫是海洋中的一种腔肠动物,它们可以从周围海水中获取Ca2+和HCO3-,经反应形成石灰石外壳:
Ca2+ + 2HCO3- CaCO3↓ +CO2↑+H2O
珊瑚周围的藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他的化石燃料等因素,都导致空气中CO2 增多,从而海水中CO2 的浓度增大,使平衡
Ca2+ +2HCO3- CaCO3↓+CO2↑+H2O 左移,将珊瑚虫的外壳(CaCO3 )溶解,从而干扰珊瑚的生长,甚至造成珊瑚虫的死亡。
*
沉淀溶解平衡的计算
1.根据溶度积计算离子浓度
例1.25℃时,Ksp(PbI2)=7.1×10-9,求PbI2饱和溶液中的[Pb2+]和[I-]=?在[I-]=0.1mol/L溶液中[Pb2+]的最大值为多少?
2.已知溶度积计算溶解度,反之亦然:
例2.已知Ksp[Mg(OH)2]=5.6×10-12, Ksp(MgCO3)=6.8×10-6,求这两种饱和溶液中的[Mg2+]分别为多少?
例 3. 25℃时,Ksp(PbI2)=7.1×10-9,求PbI2的溶解度S=?
3.有关沉沉生成和溶解的计算
例4.在1L含1.0×10-3mol/L的SO42-溶液中,加入0.01mol BaCl2(假设溶液体积不变)能否有效除去SO42-?已知:Ksp(BaSO4)= 1.1×10-10
例5.将4×10-3mol/L的Pb(NO3)2溶液与4×10-3mol/L的KI溶液等体积混合能否有沉淀析出?Ksp(PbI2)= 7.1×10-9
4.有关沉淀转化计算
例6.在白色ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液为什么会有黑色CuS沉淀生成?已知:Ksp(ZnS)=1.6×10-24,
Ksp(CuS) =1.3×10-36
解:在ZnS沉淀溶解平衡体系中产生的硫离子浓度为:[S2-]=[Zn2+]=(Ksp)1/2
=(1.6×10-24)1/2=1.26×10-12 mol/L
Qc(CuS)=c(Cu2+) ·c(S2-)=(1.0×10- 3)×(1.26×10-12)=1.26×10-15
Qc(CuS)>Ksp(CuS)
一般来说,沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
结论1:
沉淀转化的条件:一般是一种沉淀转化成另一种更难溶的沉淀,但在特殊情况下也可以实现溶解度由小到大的沉淀的转化。
例7.已知BaSO4(Ksp=1.1×10-10)比BaCO3(Ksp=5.1×10-9)的溶解度小,通过计算分析为什么在饱和碳酸钠溶液中能发生由硫酸钡到碳酸钡的转化?
例8.在0.1mol/LKCl和0.1mol/LK2CrO4的混合溶液中,逐滴加入AgNO3溶液,问最先产生哪种沉淀?(已知AgCl的Ksp=1.8×10-10,Ag2CrO4的Ksp=1.1×10-12)
结论2:
当多种难溶物在同一溶液中都可能生成,且都含有同种离子时,则该离子的浓度越小(即溶解度越小),对应的难溶物就越优先沉淀。
*
铜矿污水
达标水
沉淀溶解平衡的计算
怎样使铜矿污水成为达标水?
问题讨论1:
——调节pH法、沉淀剂法
除去不溶性固体杂质后
主要污染物
c(H+)=0.1mol/L pH=1
c(Cu2+ )=0.05mol/L
依照国家GB8978-2003
《污水综合排放标准》
中性水(pH≈7)
c(Cu2+ )≤ 1×10-7mol/L
沉淀的生成
小烧杯中现有含Cu2+的酸性污水10mL,向其中加入氢氧化钙粉末适量,搅拌,加水至40mL,再次搅拌,静置。
问题讨论1:
pH=7的水中c(Cu2+ )达到排放标准吗?
怎样定量分析这个问题?
Ksp=c(Cu2+)×c 2(OH-)
pH=7
c(Cu2+) =2.2×10-6 mol/L
> 1×10-7mol/L
难溶物 Ksp(25℃)
Cu(OH)2 2.2×10-20
依照国家GB8978-2003
《污水综合排放标准》制定
c(Cu2+)≤ 1×10-7mol/L
再思考:
怎样做才能使铜矿污水中的c(Cu2+)达到排放标准?
市
场
调
查
常见含铜难溶物 溶度积常数 Ksp
Cu(OH)2 2.2×10-20
CuS 6.4×10-36
CuCO3
1.4×10-10
常见硫化物 大约价格
Na2S 3000 元/吨
ZnS(闪锌矿) 4050元/吨
FeS(硫化亚铁矿) 800元/吨
8.0×10-28
8.0×10-9
8.0×10-9
问题讨论2:
试定量分析FeS与上层清液中低浓度的Cu2+反应转化为CuS的可行性
常见硫化物 25℃Ksp
FeS 6.4×10-17
CuS 6.4×10-36
FeS(s)
Fe2+
S2-
+
+
Cu2+
(aq)
(aq)
(aq)
CuS(s)
大量
Fe2+
沉淀的转化
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 :BaSO4不溶于酸,但可以用饱和Na2CO3溶液处理转化为易溶于酸的BaCO3
BaSO4 、BaCO3
Ba2+
BaSO4
……
BaCO3
1、 BaSO4的Ksp比 BaCO3小,为什么可以转化?
2、饱和Na2CO3溶液的作用是什么?
3、如何操作才能保证绝大多数BaSO4 转化为BaCO3?
