2019年中考科学总复习第31讲 质量守恒定律及化学方程式(精讲)(课件 31张PPT)
文档属性
| 名称 | 2019年中考科学总复习第31讲 质量守恒定律及化学方程式(精讲)(课件 31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-24 15:18:13 | ||
图片预览











文档简介
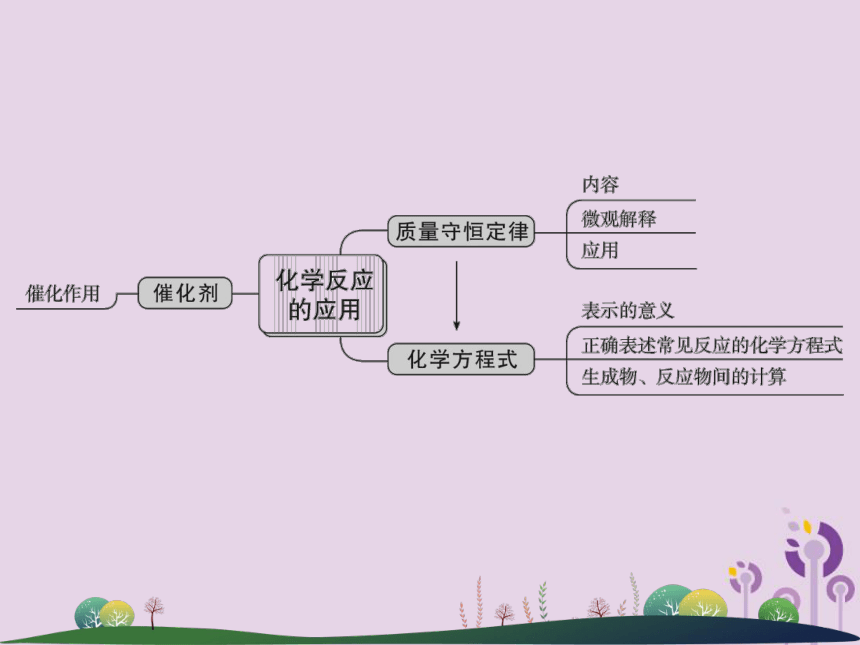
课件31张PPT。第31讲 质量守恒定律及化学方程式1.概念:在化学反应中,能改变其他物质的化学反应 _____ ,而本身的 _____ 和 __________ 在化学反应前后都 ________ 的物质叫做催化剂。在工业上,催化剂也叫触媒。
2.催化剂有“一变二不变”:一变(改变化学反应速率,不一定加快);二不变(自身的 ______ 和 _________ 不变)。
3.我们不能说二氧化锰是催化剂,应该说某一种物质在某个反应中是催化剂。速率质量化学性质没有改变质量化学性质返回验证质量守恒定律【知识拓展】
1.实验误差分析
任何化学反应都遵守质量守恒定律,如果在探究质量守恒定律时,反应前后质量发生了改变,可能原因有:
(1)有气体物质参加了反应;
(2)有气体(或固体)生成物逸散到空气中去了;
(3)反应后,气球胀大,造成气球所受空气的浮力增大等。
2.实验评价:
探究质量守恒定律时,评价实验设计是否合理,主要看以下几点:
(1)所选物质是否发生化学反应;
(2)所用装置是否密闭;
(3)如果有物质燃烧,是否有气体缓冲装置;
(4)产物是否污染空气等。
返回1.(2017,衢州)质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )A2.(2018,重庆)对于2KMnO4 K2MnO4+MnO2+O2↑的反应,下列说法错误的是( )
A.该反应属于分解反应
B.固体减少的质量等于生成O2的质量
C.MnO2加快了反应速率
D.反应前后氧元素的化合价有变化C3.(2018,益阳)铜能与硝酸反应,但不产生H2。根据反应方程式:3Cu+8HNO3(稀)===3Cu(NO3)2+2X↑+4H2O,推测X的化学式是( )
A.N2O3 B.NO2
C.NO D.N2OC4.(2018,随州)在一个密闭容器中放入X、Y、Z、W在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识错误的是( )
A.物质Z可能是该反应的催化剂
B.待测物质的值为15
C.物质Y一定是单质
D.反应中Y、W的质量比为6∶5C5.(2018,衡阳)甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
?
A.参加反应的甲和乙质量比为2∶7
B.丙可能是该反应的催化剂
C.丁一定是化合物
D.x的值是7A6.(2018,黄冈)一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )
A.5.6g B.8.8g C.4.4g D.4.8gC7.(2018,邵阳)下列化学方程式书写正确的是( )
A.2Fe+6HCl===2FeCl3+3H2↑
B.Cu+FeSO4===CuSO4+Fe
C.2Mg+O2 2MgO
D.Fe2O3+CO Fe+CO2C8.(2017,天津)下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.催化剂能改变化学反应速率
C.在化学反应后其质量增加
D.在化学反应后其化学性质发生了变化B9.(2017,金华)为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表:
(1)在反应前后的溶液中,下列元素质量保持不变的是 。
A.钠元素 B.碳元素
C.钡元素 D.氧元素
(2)反应共生成沉淀 克。A19.7(3)原样品中NaOH的质量分数是多少?
解:根据质量守恒定律可得,生成的碳酸钡的质量为
95 g+65 g-140.3 g=19.7 g
设样品中碳酸钠的质量为x
BaCl2+Na2CO3===BaCO3↓+2NaCl
106 197
x 19.7 g
x=10.6 g
样品中氢氧化钠的质量为15 g-10.6 g=4.4 g
样品中氢氧化钠的质量分数为 ×100%≈29.3%返回【例1】 (2018,常州)利用如图所示装置进行如
下实验探究。在锥形瓶中放入一小粒白磷,塞好
瓶塞后玻璃管下端刚好能与白磷接触,将整套装置
放在托盘天平上调节至平衡,取下橡皮塞,将玻璃
管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,
将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是 。
(2)根据白磷引燃前后的变化,可知燃烧的条件是
;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是 。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针
(填“向左偏”“向右偏”或“指向中间”)。
(4)白磷(P4)燃烧生成P2O5,写出该反应的化学方程式:
。先膨胀后缩小 与氧气接触,温度达到可燃物着火点可燃物向左偏P4+5O2 2P2O51.以下是俄国化学家罗蒙诺索夫曾开展的实验:①先用天平称取质量为m1的金属锡粉;②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2;③打开容器,听到了空气进入容器发出的“嘶嘶”的声响,称量所得白色物质的质量为m3;④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)根据所学知识判断,锡的燃烧是 变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量
m3= ,于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)后经多位科学家的共同努力,最终确立了质量守恒定律,请从微观角度解释该定律:
。化学m4-m2+m1 因为化学反应的过程是原子的重新组合过程,反应前后原子的种类不变,总个数不变,原子质量不变,所以化学反应前后物质的总质量相等【例2】 (2018,绥化)在一密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应的认识正确的是( )
A.物质Y一定是单质
B.反应后物质Q的质量为12g
C.反应过程中X、Q的质量比为9∶4
D.物质Z一定是该反应的催化剂B2.如图的反应中,甲、乙、丙三种分子的个数比为1∶3∶2,则从图示中获得的信息正确的是( )
?
A.生成物一定属于氧化物
B.原子种类在化学反应中发生了变化
C.该反应不可能是分解反应
D.乙分子中A与B的原子个数比为1∶2C【例3】 (2017,温州)实验室有一变质的氢氧化钠样品
(样品中只含碳酸钠杂质,且成分均匀),为测量样品中
Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定
质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据如下:
已知实验中发生的化学反应:
NaOH+HCl===NaCl+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2↑(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:
。
(2)表中的m值为 。
(3)根据实验二中的数据计算样品中Na2CO3的质量分数。
(3)解:根据质量守恒定律可得,生成的二氧化碳的质量为
150 g+8 g-155.8 g=2.2 g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 2.2 g
x=5.3 g
样品中Na2CO3的质量分数为 实验三产生的气体的质量为150 g+12 g-158.7 g=3.3 g,实验二产生的气体的质量为150 g+8 g-155.8 g=2.2 g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8 g样品已完全反应152.93.(2018,金华)碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸,已知:NaHCO3+HCl==NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的含量,小科进行了如下实验:
?
(1)小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的 质量。
(2)小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据,同学们认为,测得碳酸氢钠的质量分数会偏大,原因是
(答出一点即可)。二氧化碳 二氧化碳逸出时带走部分水蒸气(3)为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
请计算药片中碳酸氢钠的质量分数。
(3)解:设药片中碳酸氢钠的质量分数为x,
二氧化碳的质量 =1.1g,
NaHCO3+HCl==NaCl+H2O+CO2↑
84 44
3g×x 1.1g
x=70%
2.催化剂有“一变二不变”:一变(改变化学反应速率,不一定加快);二不变(自身的 ______ 和 _________ 不变)。
3.我们不能说二氧化锰是催化剂,应该说某一种物质在某个反应中是催化剂。速率质量化学性质没有改变质量化学性质返回验证质量守恒定律【知识拓展】
1.实验误差分析
任何化学反应都遵守质量守恒定律,如果在探究质量守恒定律时,反应前后质量发生了改变,可能原因有:
(1)有气体物质参加了反应;
(2)有气体(或固体)生成物逸散到空气中去了;
(3)反应后,气球胀大,造成气球所受空气的浮力增大等。
2.实验评价:
探究质量守恒定律时,评价实验设计是否合理,主要看以下几点:
(1)所选物质是否发生化学反应;
(2)所用装置是否密闭;
(3)如果有物质燃烧,是否有气体缓冲装置;
(4)产物是否污染空气等。
返回1.(2017,衢州)质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )A2.(2018,重庆)对于2KMnO4 K2MnO4+MnO2+O2↑的反应,下列说法错误的是( )
A.该反应属于分解反应
B.固体减少的质量等于生成O2的质量
C.MnO2加快了反应速率
D.反应前后氧元素的化合价有变化C3.(2018,益阳)铜能与硝酸反应,但不产生H2。根据反应方程式:3Cu+8HNO3(稀)===3Cu(NO3)2+2X↑+4H2O,推测X的化学式是( )
A.N2O3 B.NO2
C.NO D.N2OC4.(2018,随州)在一个密闭容器中放入X、Y、Z、W在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识错误的是( )
A.物质Z可能是该反应的催化剂
B.待测物质的值为15
C.物质Y一定是单质
D.反应中Y、W的质量比为6∶5C5.(2018,衡阳)甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
?
A.参加反应的甲和乙质量比为2∶7
B.丙可能是该反应的催化剂
C.丁一定是化合物
D.x的值是7A6.(2018,黄冈)一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为( )
A.5.6g B.8.8g C.4.4g D.4.8gC7.(2018,邵阳)下列化学方程式书写正确的是( )
A.2Fe+6HCl===2FeCl3+3H2↑
B.Cu+FeSO4===CuSO4+Fe
C.2Mg+O2 2MgO
D.Fe2O3+CO Fe+CO2C8.(2017,天津)下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.催化剂能改变化学反应速率
C.在化学反应后其质量增加
D.在化学反应后其化学性质发生了变化B9.(2017,金华)为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表:
(1)在反应前后的溶液中,下列元素质量保持不变的是 。
A.钠元素 B.碳元素
C.钡元素 D.氧元素
(2)反应共生成沉淀 克。A19.7(3)原样品中NaOH的质量分数是多少?
解:根据质量守恒定律可得,生成的碳酸钡的质量为
95 g+65 g-140.3 g=19.7 g
设样品中碳酸钠的质量为x
BaCl2+Na2CO3===BaCO3↓+2NaCl
106 197
x 19.7 g
x=10.6 g
样品中氢氧化钠的质量为15 g-10.6 g=4.4 g
样品中氢氧化钠的质量分数为 ×100%≈29.3%返回【例1】 (2018,常州)利用如图所示装置进行如
下实验探究。在锥形瓶中放入一小粒白磷,塞好
瓶塞后玻璃管下端刚好能与白磷接触,将整套装置
放在托盘天平上调节至平衡,取下橡皮塞,将玻璃
管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,
将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是 。
(2)根据白磷引燃前后的变化,可知燃烧的条件是
;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是 。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针
(填“向左偏”“向右偏”或“指向中间”)。
(4)白磷(P4)燃烧生成P2O5,写出该反应的化学方程式:
。先膨胀后缩小 与氧气接触,温度达到可燃物着火点可燃物向左偏P4+5O2 2P2O51.以下是俄国化学家罗蒙诺索夫曾开展的实验:①先用天平称取质量为m1的金属锡粉;②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2;③打开容器,听到了空气进入容器发出的“嘶嘶”的声响,称量所得白色物质的质量为m3;④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)根据所学知识判断,锡的燃烧是 变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量
m3= ,于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)后经多位科学家的共同努力,最终确立了质量守恒定律,请从微观角度解释该定律:
。化学m4-m2+m1 因为化学反应的过程是原子的重新组合过程,反应前后原子的种类不变,总个数不变,原子质量不变,所以化学反应前后物质的总质量相等【例2】 (2018,绥化)在一密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应的认识正确的是( )
A.物质Y一定是单质
B.反应后物质Q的质量为12g
C.反应过程中X、Q的质量比为9∶4
D.物质Z一定是该反应的催化剂B2.如图的反应中,甲、乙、丙三种分子的个数比为1∶3∶2,则从图示中获得的信息正确的是( )
?
A.生成物一定属于氧化物
B.原子种类在化学反应中发生了变化
C.该反应不可能是分解反应
D.乙分子中A与B的原子个数比为1∶2C【例3】 (2017,温州)实验室有一变质的氢氧化钠样品
(样品中只含碳酸钠杂质,且成分均匀),为测量样品中
Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定
质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据如下:
已知实验中发生的化学反应:
NaOH+HCl===NaCl+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2↑(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:
。
(2)表中的m值为 。
(3)根据实验二中的数据计算样品中Na2CO3的质量分数。
(3)解:根据质量守恒定律可得,生成的二氧化碳的质量为
150 g+8 g-155.8 g=2.2 g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 2.2 g
x=5.3 g
样品中Na2CO3的质量分数为 实验三产生的气体的质量为150 g+12 g-158.7 g=3.3 g,实验二产生的气体的质量为150 g+8 g-155.8 g=2.2 g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8 g样品已完全反应152.93.(2018,金华)碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸,已知:NaHCO3+HCl==NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的含量,小科进行了如下实验:
?
(1)小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的 质量。
(2)小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据,同学们认为,测得碳酸氢钠的质量分数会偏大,原因是
(答出一点即可)。二氧化碳 二氧化碳逸出时带走部分水蒸气(3)为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
请计算药片中碳酸氢钠的质量分数。
(3)解:设药片中碳酸氢钠的质量分数为x,
二氧化碳的质量 =1.1g,
NaHCO3+HCl==NaCl+H2O+CO2↑
84 44
3g×x 1.1g
x=70%
同课章节目录
