2019年中考科学总复习第37讲 重要的盐(精讲)(课件 22张PPT)
文档属性
| 名称 | 2019年中考科学总复习第37讲 重要的盐(精讲)(课件 22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-25 00:00:00 | ||
图片预览








文档简介
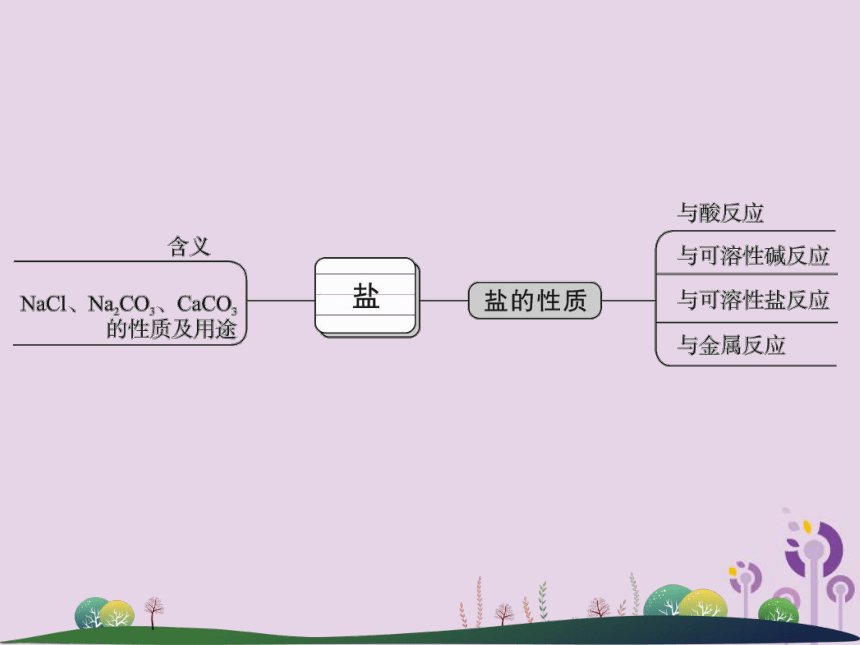
课件22张PPT。第37讲 重要的盐1.几种重要的盐2.盐的溶解性
一般来说,钾盐、钠盐、铵盐、硝酸盐都 ;而大多数碳酸盐都 于水;盐酸盐除 不溶,硫酸盐除 不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。易溶不溶AgClBaSO41.Cl-的检验:加入 AgNO3 溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3。
2. 的检验:加入 Ba(NO3)2 溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,说明样品中含有 。例:
Ba(NO3)2+H2SO4==BaSO4↓+2HNO3。
的检验:向试样中滴加 ,有气体产生,将气体通入澄清的石灰水中变浑浊,说明样品中含有 。例:
CaCO3+2HCl==CaCl2+H2O+CO2↑。稀盐酸返回1.(2017,来宾)下列物质的用途,正确的是( )
A.食盐可作发酵粉
B.石灰石可作建筑材料
C.碳酸氢钠可制玻璃
D.氢氧化钠可改良酸性土壤
2.(2018,湖州)现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A.② B.②③ C.①②③ D.②③④BB3.(2018,衡阳)现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示。下列说法错误的是( )
A.滴加碳酸钠溶液质量为a~c克时,溶液中发生反应为
CaCl2+Na2CO3===2NaCl+CaCO3↓
B.滴加碳酸钠溶液质量至b克时,溶液中含三种溶质
C.滴加碳酸钠溶液质量至a克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴加碳酸钠溶液质量至c克时,溶液呈中性B4.(2017,义乌)以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
(1)加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒
的作用是 。
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐
溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,
②过滤,③加过量的NaOH溶液,④加适量的稀HCl,
⑤加过量的BaCl2溶液,能达到目的顺序是 。
A.⑤③②①④ B.③⑤①④②
C.③⑤①②④
(3)用pH试纸检验溶液是否呈中性的操作是
。引流C用玻璃棒蘸取溶液滴于pH试纸上,与标准比色卡对照5.(2018,广州)硫酸氢钠(NaHSO4)溶于水形成无色溶液,请预测其化学性质,说明预测的依据,并设计实验验证。限选试剂是:NaHSO4溶液、BaCl2溶液、FeSO4溶液、Na2CO3溶液、NaOH溶液、稀盐酸、酚酞溶液、紫色石蕊溶液、镁条、碳粉、氧化铜。6.(2018,杭州)用“盐酸——硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理H2S的方法是 (选填“盈利”或“亏损”)的。盈利(2)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨?(写出计算过程,结果保留1位小数)
解:(2)设需要氢氧化钠质量为x,
2NaOH+H2S===Na2S+2H2O,
80 34
x 10t
x=23.5t,返回【例1】 (2018,贵阳)实验室有一包白色固体,
其中除了碳酸钠以外,还可能含有硝酸钡、硫酸钠
、氢氧化钠中的一种或几种。步骤①:取少量白色
固体于烧杯中,向烧杯中加入足量水并不断搅拌,
固体部分溶解。步骤②:接着向烧杯中加入足量
稀硝酸并不断搅拌,此时固体质量变化如图。下列说法正确的是( )
A.A→B段对应的实验现象是固体部分溶解,无气泡冒出
B.B→C段对应溶液pH逐渐变大
C.C点对应溶液中一定含有的溶质是硝酸、硝酸钠、硝酸钡
D.原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠C1.现有盐酸和CaCl2的混合溶液,向其中
逐滴滴入Na2CO3溶液,生成沉淀质量与
滴入Na2CO3溶液质量的变化关系如下图
所示。下列说法正确的是( )
A.滴至a克时,溶液中反应为CaCl2+Na2CO3===2NaCl+CaCO3↓
B.滴至b克时,溶液中含HCl、NaCl两种溶质
C.滴至c克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d克时,溶液呈中性C【例2】 (2018,青岛)一包不纯的氯化钾粉末,所含杂质可能是氯化钠、硝酸钾、硝酸钙、氯化铜、碳酸钠中的一种或几种。为确定其成分,某兴趣小组的同学们进行如下实验:
(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液。
(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成。
(3)另称取14.9g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成28.7g白色沉淀。根据上述实验判断,下列说法正确的是( )
A.杂质中可能含有硝酸钾、氯化钠
B.杂质中肯定不含硝酸钙、氯化铜、碳酸钠
C.杂质中肯定含有碳酸钠,可能含有氯化钠
D.杂质中肯定含有氯化钠、碳酸钠,可能含有硝酸钾D2.(2017,泰安)现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验,下列判断正确的是( )
?
A.无色溶液B的溶质只有硝酸钙
B.该实验中涉及的基本反应类型不止一种
C.原溶液中的杂质只有氯化钙
D.原溶液中的杂质可能由氯化钙、硝酸钙、氯化钠组成D3.(2018,济宁)不使用其他试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是( )
A.H2SO4、Na2SO4、BaCl2、FeCl3
B.BaCl2、HCl、NaNO3、AgNO3
C.Na2CO3、HNO3、NaNO3、BaCl2
D.H2SO4、NaOH、MgCl2、Ba(NO3)2C
一般来说,钾盐、钠盐、铵盐、硝酸盐都 ;而大多数碳酸盐都 于水;盐酸盐除 不溶,硫酸盐除 不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。易溶不溶AgClBaSO41.Cl-的检验:加入 AgNO3 溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3。
2. 的检验:加入 Ba(NO3)2 溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,说明样品中含有 。例:
Ba(NO3)2+H2SO4==BaSO4↓+2HNO3。
的检验:向试样中滴加 ,有气体产生,将气体通入澄清的石灰水中变浑浊,说明样品中含有 。例:
CaCO3+2HCl==CaCl2+H2O+CO2↑。稀盐酸返回1.(2017,来宾)下列物质的用途,正确的是( )
A.食盐可作发酵粉
B.石灰石可作建筑材料
C.碳酸氢钠可制玻璃
D.氢氧化钠可改良酸性土壤
2.(2018,湖州)现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A.② B.②③ C.①②③ D.②③④BB3.(2018,衡阳)现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示。下列说法错误的是( )
A.滴加碳酸钠溶液质量为a~c克时,溶液中发生反应为
CaCl2+Na2CO3===2NaCl+CaCO3↓
B.滴加碳酸钠溶液质量至b克时,溶液中含三种溶质
C.滴加碳酸钠溶液质量至a克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴加碳酸钠溶液质量至c克时,溶液呈中性B4.(2017,义乌)以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
(1)加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒
的作用是 。
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐
溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,
②过滤,③加过量的NaOH溶液,④加适量的稀HCl,
⑤加过量的BaCl2溶液,能达到目的顺序是 。
A.⑤③②①④ B.③⑤①④②
C.③⑤①②④
(3)用pH试纸检验溶液是否呈中性的操作是
。引流C用玻璃棒蘸取溶液滴于pH试纸上,与标准比色卡对照5.(2018,广州)硫酸氢钠(NaHSO4)溶于水形成无色溶液,请预测其化学性质,说明预测的依据,并设计实验验证。限选试剂是:NaHSO4溶液、BaCl2溶液、FeSO4溶液、Na2CO3溶液、NaOH溶液、稀盐酸、酚酞溶液、紫色石蕊溶液、镁条、碳粉、氧化铜。6.(2018,杭州)用“盐酸——硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理H2S的方法是 (选填“盈利”或“亏损”)的。盈利(2)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨?(写出计算过程,结果保留1位小数)
解:(2)设需要氢氧化钠质量为x,
2NaOH+H2S===Na2S+2H2O,
80 34
x 10t
x=23.5t,返回【例1】 (2018,贵阳)实验室有一包白色固体,
其中除了碳酸钠以外,还可能含有硝酸钡、硫酸钠
、氢氧化钠中的一种或几种。步骤①:取少量白色
固体于烧杯中,向烧杯中加入足量水并不断搅拌,
固体部分溶解。步骤②:接着向烧杯中加入足量
稀硝酸并不断搅拌,此时固体质量变化如图。下列说法正确的是( )
A.A→B段对应的实验现象是固体部分溶解,无气泡冒出
B.B→C段对应溶液pH逐渐变大
C.C点对应溶液中一定含有的溶质是硝酸、硝酸钠、硝酸钡
D.原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠C1.现有盐酸和CaCl2的混合溶液,向其中
逐滴滴入Na2CO3溶液,生成沉淀质量与
滴入Na2CO3溶液质量的变化关系如下图
所示。下列说法正确的是( )
A.滴至a克时,溶液中反应为CaCl2+Na2CO3===2NaCl+CaCO3↓
B.滴至b克时,溶液中含HCl、NaCl两种溶质
C.滴至c克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d克时,溶液呈中性C【例2】 (2018,青岛)一包不纯的氯化钾粉末,所含杂质可能是氯化钠、硝酸钾、硝酸钙、氯化铜、碳酸钠中的一种或几种。为确定其成分,某兴趣小组的同学们进行如下实验:
(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液。
(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成。
(3)另称取14.9g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成28.7g白色沉淀。根据上述实验判断,下列说法正确的是( )
A.杂质中可能含有硝酸钾、氯化钠
B.杂质中肯定不含硝酸钙、氯化铜、碳酸钠
C.杂质中肯定含有碳酸钠,可能含有氯化钠
D.杂质中肯定含有氯化钠、碳酸钠,可能含有硝酸钾D2.(2017,泰安)现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验,下列判断正确的是( )
?
A.无色溶液B的溶质只有硝酸钙
B.该实验中涉及的基本反应类型不止一种
C.原溶液中的杂质只有氯化钙
D.原溶液中的杂质可能由氯化钙、硝酸钙、氯化钠组成D3.(2018,济宁)不使用其他试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是( )
A.H2SO4、Na2SO4、BaCl2、FeCl3
B.BaCl2、HCl、NaNO3、AgNO3
C.Na2CO3、HNO3、NaNO3、BaCl2
D.H2SO4、NaOH、MgCl2、Ba(NO3)2C
同课章节目录
