2.1 化学能与热能 课件
图片预览










文档简介
人教版必修Ⅱ
第二章 化学反应与能量
第一节化学能与热能
新型燃料电池汽车
“神七”发射现场
燃气灶
2、化学反应的本质是什么?
知识回顾
化学反应的本质是旧化学键的断裂和新化学键的形成。
1、什么是化学键?
使离子相结合或原子相结合的强烈的作用力。统称为化学键。
石灰石要经过高温煅烧才能变成生石灰,高温条件提供的热能在石灰石分解反应中起什么作用?
学与问
提供反应进行所需要的能量
煤、石油和天然气等化石燃料的燃烧所产生的能量以什么形式呈现?
这些能量从何而来?它与化学物质及化学反应有什么关系?
学与问
化学反应中的能量变化,主要表现为热量的变化。
一、化学键与化学反应中能量变化的关系
(1)化学反应的本质是什么?
1.化学反应中能量的变化
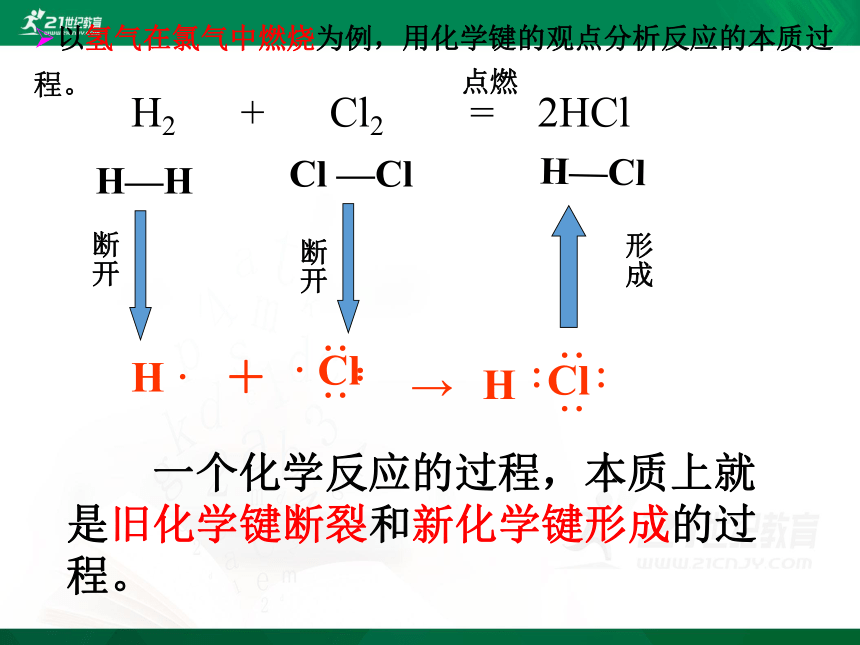
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
H ·
··
· Cl
··
:
+
→
Cl
··
··
H
··
··
H2 + Cl2 = 2HCl
H—H
Cl —Cl
H—Cl
断开
断开
点燃
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
⑵ 化学反应中能量变化的主要原因
H ·
··
· Cl
··
:
+
→
Cl
··
··
H
··
··
H2 + Cl2 = 2HCl
H—H
Cl —Cl
H—Cl
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
⑶ 从化学键的观点来分析能量的变化
一个化学反应的过程,本质上就是旧化学键
断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
在化学反应中,随着物质的变化,既有反应物中化学键的断裂,又有生成物中化学键的形成,化学能也随之而改变。那么,一个化学反应吸收能量还是放出能量是由什么决定的呢?
思考与交流
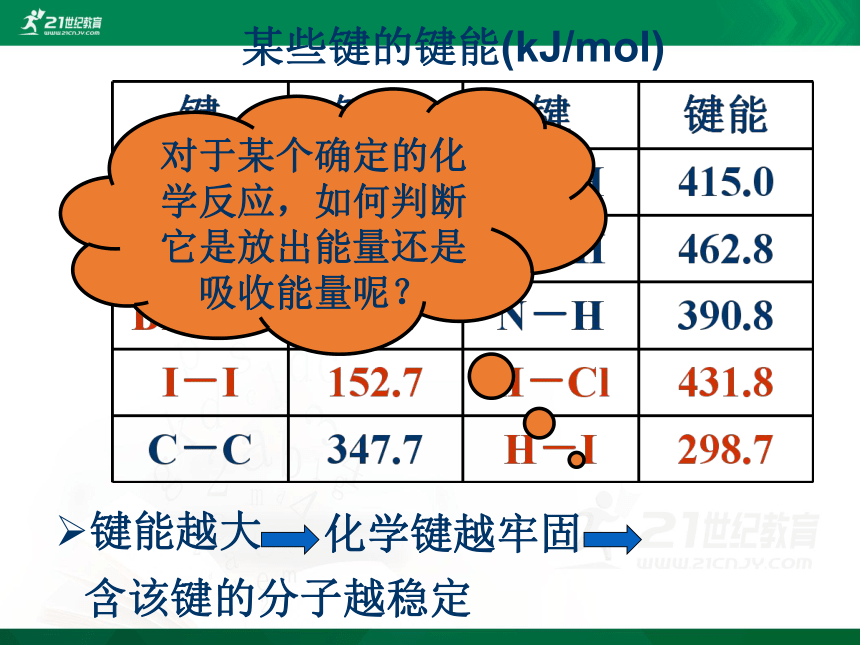
实验测得,在25℃,101KPa条件下,将1molH2(H-H)变为2molH原子需吸收436kJ能量,而2molH原子变成1molH2(H-H)放出436kJ能量,这个能量就是H-H的键能。
某些化学键的键能
某些键的键能(kJ/mol)
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
键能越大
含该键的分子越稳定
化学键越牢固
在反应H2 + Cl2 =2HCl中,已知
H-H 键能为436kJ/mol,Cl-Cl键能为247
kJ/mol,H-Cl键能为431kJ/mol,判断该反应是 反应
放热
课堂练习一
则(1)化学键断裂时需要吸收能量。吸收总能量为:
436kJ+247kJ=683 kJ
(2)化学键形成时需要释放能量。释放总能量为:
431kJ+431kJ=862 kJ
(3)反应中放出的热量的计算:
862kJ—683kJ=179kJ
2、一个化学反应吸收能量还是放出能量的决定因素
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
水由高处向低处流要释放能量(势能转换为动能)
分析化学反应:
反应物的总能量
>生成物的总能量
化学反应放出能量
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
分析化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
能
量
反应过程
0
反应物总能量
生成物总能量
释放能量
能
量
反应过程
0
反应物总能量
生成物总能量
吸收能量
小结: 一个化学反应是放出能量还是吸收能量
取决于反应物的总能量与生成物的总能量的相对大小.
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量=反应物的总能量+吸收的热量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
化学反应
吸热反应
放热反应
化学反应中放出能量的反应。
化学反应中吸收能量的反应。
断键吸收的总能量小于成键放出的总能量的反应或反应物的总能量大于生成物的总能量的反应。
断键吸收的总能量大于成键放出的总能量的反应或反应物的总能量小于生成物的总能量的反应。
3、放热反应和吸热反应
小结:
能量公式化
(能量守恒定律)
E(生成物)-E(反应物)=△H
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
练习:已知反应A+B=C+D为放热反应,
对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定
能发生
C
二、化学能与热能的相互转化
1、两条基本的自然定律
(1)质量守恒定律:自然界的物质可以发生转化,
但是总质量保持不变。
(2)能量守恒定律:一种能量可以转化为另一种能量,总能量保持不变。
2、吸热反应和放热反应
什么是化学能?
化学反应中吸收或者释放的能量就叫做化学能
化学反应中的能量变化,通常表现为热量的变化-吸热或放热。
怎样设计实验来了解反应中的
热量变化情况?
下面我们一起通过实验来认识和感受一下化学能与热能的相互转化!
实验2-1
产生无色无味气体,溶液温度升高。
反应放出热量,
是放热反应。
2Al + 6HCl = 2AlCl3 + 3H2↑
实验 现象
触摸到 拿起烧杯看到 闻到
将Ba(OH)2·8H2O和NH4Cl晶体混合
结论和化学方程式
实验2-2:
20g Ba(OH)2 · 8H2O(研细)+ 10g NH4Cl
烧杯壁
很凉
玻璃片与烧杯黏结在一起
闻到了刺激性气味
反应为吸热反应
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑
+10H2O
实验2-3
酸碱中和反应中的热量变化
1.在50ml烧杯中加入20ml盐酸,测其温度并记录;擦净温度计,另用量筒量取20mlNaOH,测其温度并记录。
2.将NaOH倾入烧杯中,边加边搅拌。观察反应中温度变化。
实质: H+ + OH- = H2O
室温
室温
高于室温
结论: 中和反应是放热反应。
1.该反应是 反应,酸碱中和反是? 反应;
2.? 能转化为? 能。
放热
放热
化学能
热能
新概念
强酸与强碱的稀溶液发生中和反应生成1mol H2O时释放的热量,叫做中和热。
如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学讨论、交流。
三、中和热
在设计实验装置和操作时应该注意哪些问题?
(1)用隔热装置,尽量减少热量散失;
(2)酸碱的量要准确:n=C×V
a、浓度要越精确越好
b、量体积的容器越精确越好
(3)温度计要读准,水银球要
全浸在溶液中
(4)实验操作时动作要快,尽量
减少热量的损失
(5)多做几次,取平均值
交流与讨论
回忆以前所学的知识,归纳出常见的放热反应有哪些?常见的吸热反应有哪些?
总结
常见的放热反应和吸热反应
放热反应
燃料的燃烧(与O2的反应)
中 和 反 应
活泼金属与水或酸的反应
大部分化合反应(生石灰和水)
物质的缓慢氧化
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2·8H2O+NH4Cl
大部分分解反应
化学能的应用
利用反应产生的热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
生物体内的能量转化
柴草时期
火的发现至18世纪产业革命
以树枝杂草为主要能源。通过火(燃烧)
的光和热推动了人类文明的进步,
使人类告别“茹毛饮血”、采集野果的生活
烧陶 炼丹
化石能源时期
18世纪中期至现代
以煤、石油、天然气为主要能源
(仍然是利用燃烧反应所释放的热能)
煤的燃烧 气缸中燃料燃烧
多能源时期
这是将会出现
的能源利用的
新时期。
可再生能源和
清洁能源
(绿色能源)
将成为开发能源
的主力军。
地热能
风能
潮汐能
小结
1.化学能和热能的相互转化:
∑E(反应物)> ∑E(生成物) 放热反应 释放能量
化学能→热能
∑E(反应物)< ∑E(生成物) 吸热反应 贮存能量
热能→化学能
2.常见的吸热反应,放热反应。
3.生产生活中化学能和热能的相互转化。
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
