2.2.1 化学能与电能 课件
文档属性
| 名称 | 2.2.1 化学能与电能 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-28 09:59:37 | ||
图片预览










文档简介
(第一课时)
化学能与电能
第二节
人教版 必修二
病 例 分 析
化学小史
一位年轻的化学家来看望格林太太,并为格林太太揭开了病因。
化学家发现了什么?你能为格林太太开个药方吗?
阅读教材39-40页回答下列问题
1、何为一次能源、二次能源?
2、电能是一次能源还是二次能源?
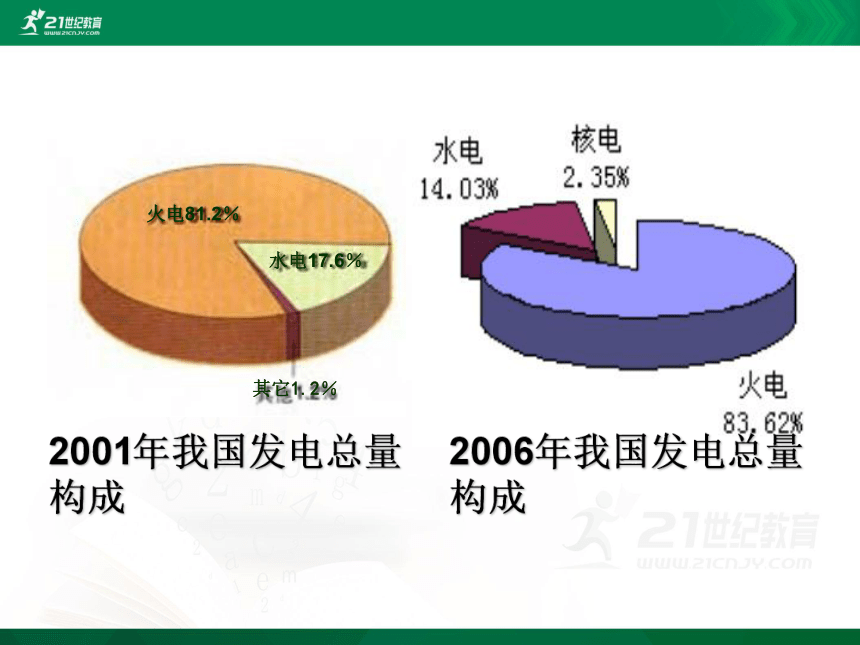
3、根据2001年我国发电总量构成图,我国
( )发电居于首位。
一、一次能源与二次能源
一次能源:
直接从自然界获取的能源称一次能源。如流水、风力、原煤、石油、天然气、天然铀等。
二次能源:
一次能源经过加工、转换得到的能源称为二次能源。如:电力、蒸汽等
火电81.2%
水电17.6%
其它1.2%
2001年我国发电总量构成
2006年我国发电总量构成
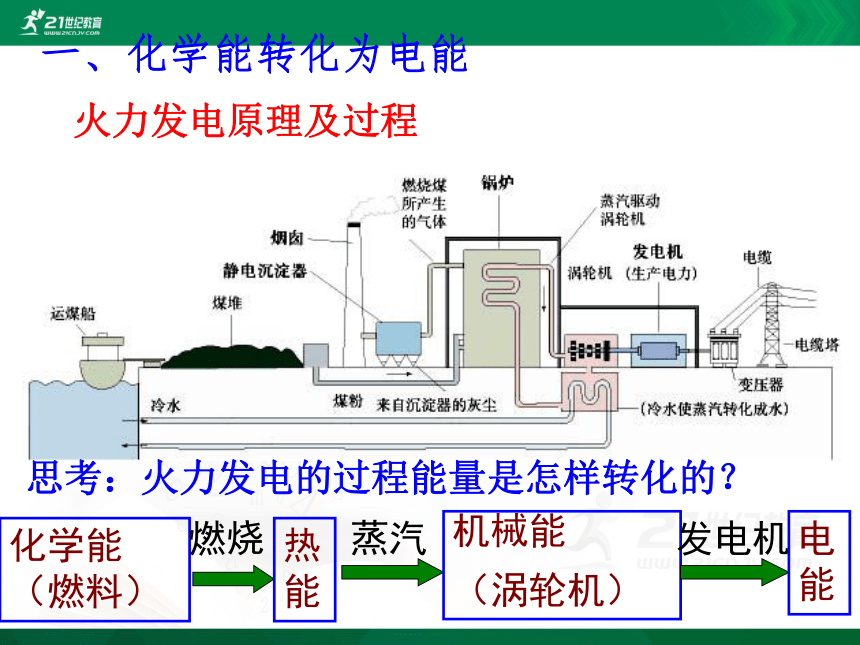
一、化学能转化为电能
火力发电原理及过程
思考:火力发电的过程能量是怎样转化的?
化学能(燃料)
燃烧
热能
蒸汽
机械能
(涡轮机)
发电机
电能
2、火力发电的化学深层本质分析
燃烧
氧化还原反应
氧化剂与还原剂之间发生电子的转移
火力发电
将化学能经一系列能量转化为电 能
旧键断裂和新键形成、体系能量变化
过程
关键
本质
本质
引起
一、化学能转化为电能
【思考与交流】
火
力
发
电
有
什
么
缺
点
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的
利用率低
化学能 电能
直接?
实践活动
自制电池——水果电池。如下图:
稀硫酸
Zn
Cu
将一Zn片、Cu片平行插入稀硫酸中,有什么现象?写出有关反应的离子方程式。
实验探究一
Zn + 2H+ = Zn2++H2
现象:
Zn片上有气泡(H2), Zn片逐溶解;Cu片无明显现象。
解释:
稀硫酸
Zn
Cu
实验探究二
将Cu和Zn以导线连接起来,并在导线中间添加一电流表,然后将其放入稀硫酸中。又会观察到什么实验现象呢?
稀硫酸
Zn
Cu
现象:
Zn片逐渐溶解但无气泡;
Cu片上有气泡(H2);电流计指针偏转。
稀硫酸
Zn
Cu
H+
SO42-
SO42-
H+
H+
H+
原理探究
e-
e-
e-
e-
稀硫酸
Zn
Cu
Zn2+
e-
e-
H+
H+
稀硫酸
Zn
Cu
Zn2+
e-
e-
H+
H+
Zn-2e-=Zn2+
总反应:
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
锌片:氧化反应
实验装置中的化学反应:
铜片:还原反应
一、原电池
(1)定义:将化学能直接转变成电能的装置,称为原电池
(电源)
规定:
负极:
正极:
电子流出(或电流流进)的一极
电子流进(或电流流出)的一极
负极
正极
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
电子从锌片流出
流入铜片
经外电路
H+
Zn2+
SO42-
电流方向
电流方向:正极 负极
外电路
阳离子:移向正极
阴离子移向负极
原电池
“负极出电子,电子回正极”
(2)原电池工作原理
1、电子从负极流向正极。
2、电流方向(外电路):正极到负极。
3、阳离子向正极移动,阴离子向负极移动。
工作原理:
负极
电极材料:Zn
电极反应:失去电子 发生氧化反应
电极反应式:Zn-2e-=Zn2+
正极
电极材料:Cu
电极反应:得到电子 发生还原反应
电极反应式:2H+ +2e-=H2
(3)原电池化学反应本质:氧化还原反应
总反应:
Zn+2H+=Zn2++H2↑
你找到格林太太的病因了吗?
你能为她开一个药方吗?
由于金与铁(钢的主要成分)是活动性不同的两种金属,唾液中含有电解质,故构成了原电池,产生了微小的电流,使得格林太太头痛,因此必须换掉其中的一颗假牙。
回忆思考:通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些?
组成:两电极、导线、电解质溶液以及容器
怎样才能构成一个原电池呢?
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
第一组实验
实验探究:形成原电池的条件
(可以)
(不可以)
形成条件二:电极需浸入电解质溶液中
第二组实验
实验探究:形成原电池的条件
第三组实验
形成条件三:必须形成闭合回路
(不可以)
实验探究:形成原电池的条件
(可以)
实验探究:形成原电池的条件
一
u
(不可以)
第四组实验
形成条件四:必须具备一个自发进行的氧化还原反应
(可以)
4原电池组成条件
① 两种活泼性不同的金属作电极
(或其中一种为能导电 的非金属,如“碳棒”)
其中较活泼金属为负极。
较不活泼金属(或非 金 属)为正极
② 电解质溶液
③ 形成闭合回路
④ 能自发地发生氧化还原反应
两极一液一线一反应
5原电池原理的应用
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
练习
⒈
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式。
①
②
③
(×)
(×)
(√)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(√)
(√)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
Fe-2e-=Fe2+
Cu2++2e-=Cu
Fe+Cu2+=Fe2++Cu
或 Fe+CuSO4=Cu+FeSO4
原电池的正负极的判断方法
微观判断
(根据电子流动方向)
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
质量增加的电极
工作后
质量减少的电极
——负极
——正极
——正极
——负极
工作后,有气泡冒出的电极为正极
发生氧化反应的极
发生还原反应的极
宏观判断:
①根据电极材料
②根据原电池电极发生
的反应
③根据电极增重还是减重
④根据电极有气泡冒出:
——负极
——正极
课堂小结
一、化学能与电能的相互转化
1.火力发电的过程。
2.原电池:将化学能转化为电能的装置。
负极(Zn):Zn-2e-=Zn2+ (氧化反应)
正极(Cu):2H++2e-=H2↑(还原反应)
总反应式:Zn+2H+=Zn2++H2↑
3. 原电池的构成条件:
① 有两种活动性不同的金属(或非金属导体)作电极。
② 电极材料都插入电解质溶液中。
③ 两极相连形成闭合电路。
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
