人教九年级化学下册第十一单元课题2 化学肥料(共33张PPT)
文档属性
| 名称 | 人教九年级化学下册第十一单元课题2 化学肥料(共33张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-31 08:09:44 | ||
图片预览









文档简介
Lorem ipsum dolor sit amet
课题2 化学肥料
化学肥料与农家肥料的比较
化学肥料 农家肥料
所含营养元素的种类单一,但单一营养元素含量大 常含多种营养元素,但单一营养元素的含量较小
一般易溶于水,易于被农作物吸收,肥效快 一般难溶于水,肥效慢但肥效长
便于工业生产,成本较高 便于就地取材,成本低廉
有些化肥如长期大量施用会使土壤酸化板结 能改良土壤结构
1.什么是化肥?
化学肥料是用矿物质、空气、水等作原料,经过化学加工精制而成的肥料。
2.化肥有哪些类型?
氮肥:化肥主要含有氮元素的称氮肥。
磷肥:化肥主要含有磷元素的称磷肥。
钾肥:化肥主要含有钾元素的称钾肥。
复合肥:化肥中含有两种或两种以上
主要营养元素的称复合肥。
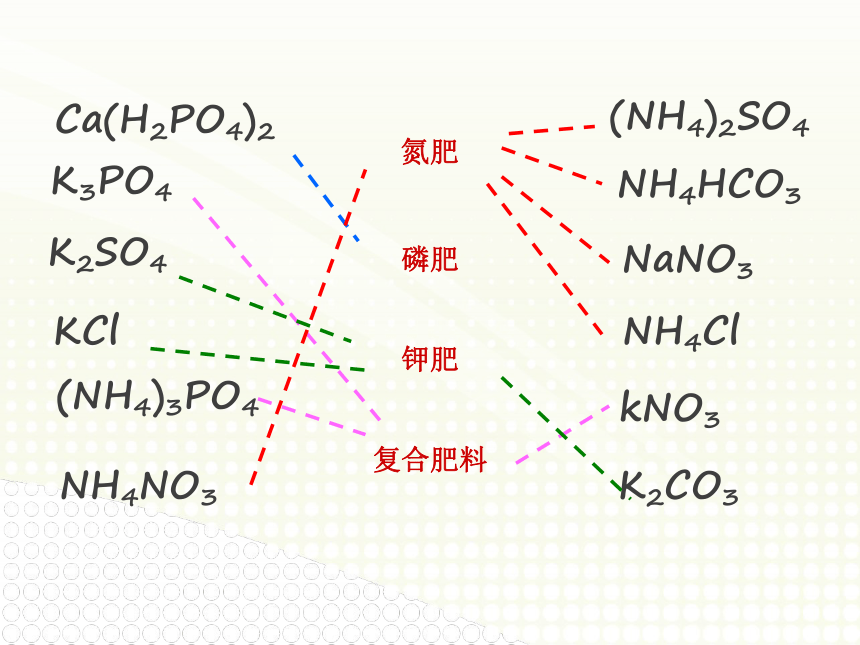
氮肥
磷肥
钾肥
复合肥料
(NH4)2SO4
NH4HCO3
NaNO3
NH4Cl
Ca(H2PO4)2
K3PO4
K2SO4
KCl
kNO3
(NH4)3PO4
K2CO3
NH4NO3
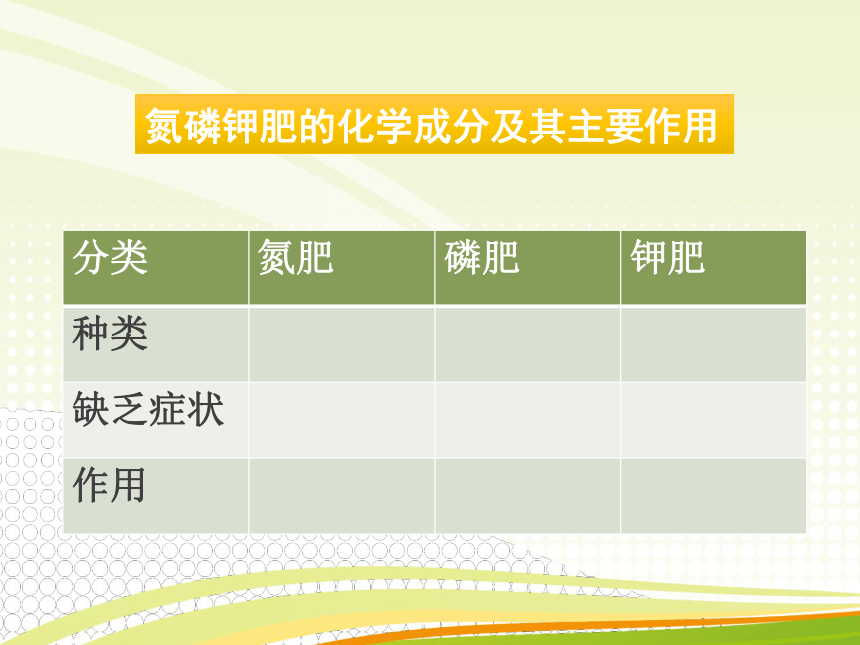
氮磷钾肥的化学成分及其主要作用
分类 氮肥 磷肥 钾肥
种类
缺乏症状
作用
1.氮肥
氮肥的作用:
氮是植物体内核酸、蛋白质和叶绿素的组成元素。
氮肥能促使植物的茎、叶生长茂盛,叶色浓绿。
常见的氮肥:
尿素:CO(NH2)2
氨水:(NH3·H2O)
铵盐:NH4HCO3、NH4Cl、(NH4)2SO4
硝酸盐:NH4NO3、NaNO3
知识积累
①空气中虽然含有大量的氮气,但植物通常只能吸收化合物中氮元素,不能直接吸收空气中的氮气。
②根部有根瘤菌的豆科植物能把氮气转化为含氮的化合物而吸收。
③将氮气转化为氮的化合物的方法叫做氮的固定。
(4)氮肥(铵盐)的制取:
NH3+H2O+CO2=NH4HCO3(碳铵)
2NH3+H2SO4=(NH4)2SO4(硫铵)
2.磷肥
磷是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,参与各种重要的代谢活动,与植物的细胞分裂、生成及有机物的转化等有密切的关系。磷可促进作物生长,使之穗粒饱满,还可增强抗寒、抗旱能力。
作物缺磷的表现:生长迟缓、产量降低。
常见的磷肥:
①磷矿粉:Ca3(PO4)2
②钙镁磷肥:钙和镁的磷酸盐
③过磷酸钙:Ca(H2PO4)2+CaSO4
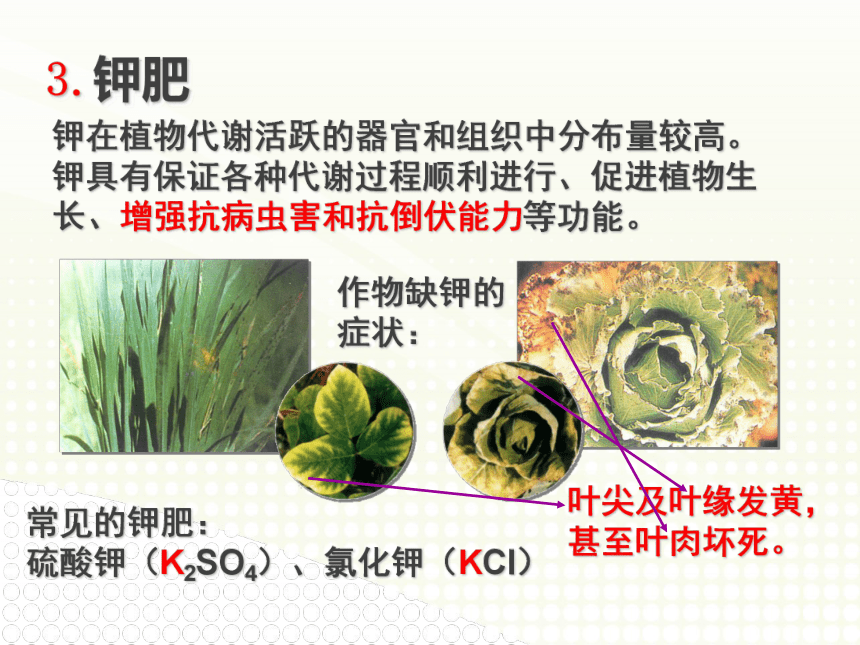
钾在植物代谢活跃的器官和组织中分布量较高。钾具有保证各种代谢过程顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能。
3.钾肥
作物缺钾的症状:
常见的钾肥:
硫酸钾(K2SO4)、氯化钾(KCl)
叶尖及叶缘发黄,甚至叶肉坏死。
这类肥料的特点是能同时均匀地供给作物几种养分,充分发挥营养元素间的相互作用。
复合化肥:含两种或两种以上营养元素的化肥。
如:磷酸二氢铵(NH4H2PO4)、磷酸铵氢(NH4)2HPO4、硝酸钾(KNO3)
4.复合肥料
氮磷钾肥的化学成分及其主要作用
分类 氮肥 磷肥 钾肥
种类 尿铵硝盐 磷酸盐 钾盐
缺乏症状 叶 根 茎
作用 叶色浓绿 抗寒抗旱 抗病虫倒
化肥和农药使用的利与弊:
1.使用化肥农药的利弊
利:农业增产的最有力措施。
弊:不合理施用化肥会带来环境问题。
(1)污染大气:有NH3等不良气体排放。
(2)污染水体:使水体含氮和磷增多,富营养化。
(3)破坏土壤:使土壤酸化,板结。
农药在自然界中的转移
2.建议:合理施用化肥,减少污染,保障食品安全,维护地球的生态平衡。
[注意] 硫酸铵、硫酸钾不宜长期大量施用,以免增加土壤的酸性。长期使用会造成土壤板结,破坏土壤结构,造成环境污染。
化肥的简易鉴别
氮磷钾肥的初步比较
白色晶体
刺激性气味
无气味
无气味
酸味
无气味
溶于水
溶于水
不溶
部分溶
氮肥 磷肥 钾肥
碳酸氢铵 氯化铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾
外观
气味
溶解性
取少量的氯化铵,加入适量的熟石灰粉末,混合、研磨,能否嗅到气味?
铵盐与熟石灰反应:
2NH4NO3+Ca(OH)2=Ca(NO3)2+2H2O+2NH3↑
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?
铵盐与碱(强碱)混合加热,都会产生有刺激性气味的氨气放出。此法用于铵盐的检验。
加NaOH等碱溶液。如果产生使湿润的红色石蕊试纸变蓝的气体,则含有NH4+
因此,使用铵盐作肥料时,不能跟熟石灰等碱混施。
(NH4)2SO4+2NaOH= Na2SO4+2H2O+2NH3↑
NH4HCO3+Ca(OH)2 = CaCO3↓+2H2O+NH3↑
比较下列两个反应,你能否说出能检验铵根离子的试剂?
实验1、向硫酸铵浓溶液中滴加氢氧化钠溶液,发生了什么变化?写出化学方程式。
(NH4)2SO4+2NaOH= Na2SO4+2H2O+2NH3↑
铵盐的性质:
产生一种刺激性气味的气体
实验2、把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化?
使湿润的红色石蕊试纸变蓝
变化的原因是什么?
产生氨气,氨气是碱性的。
铵盐能与碱反应,生成氨气
二、化肥的简易鉴别
氮肥 钾肥 磷肥
看外观 白色晶体 白色晶体 灰白色粉末
加水 能溶于水 能溶于水 大多不溶或部分溶于水
灼烧 可燃烧,熔化起泡或冒烟 不燃烧,跳动或有爆炸声 无明显变化
加熟石灰 放出有刺激性气味的气体 无明显变化 无明显变化
1.氮肥:常见的氮肥有尿素[CO(NH2)2〕、氨水(NH3·H2O)、铵盐(如:NH4HCO3、NH2Cl)、硝酸盐(如:NH4NO3、NaNO3)等含氮化合物。大多数为白色晶体,可溶于水。
(1)有机物——尿素CO(NH2)2(白色或淡黄色晶体,含氮量最高的氮肥)
(2)碱——NH3·H2O(易挥发出氨气,有腐蚀性,稀释后施用)
(3)铵态氮肥——NH4HCO3(易分解,施用时深埋),(NH4)2SO4(长期使用会使土壤酸化,板结)
(4)硝酸盐——NaNO3,NH4NO3(易爆,结块不可使用铁锤砸)
2.磷肥:常见的磷肥有磷矿粉〔Ca3(PO4)2〕、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙(磷酸二氢钙和硫酸钙的混合物)等含磷物质。大部分为灰白色粉末,不溶或者部分溶于水
过磷酸钙:CaSO4和Ca3(H2PO4)2的混合物(部分溶解)
钙镁磷肥:Ca3(PO4)2 和 Mg3(PO4)2 (难溶于水)
磷矿粉: Ca3(PO4)2 (难溶于水)
3.钾肥:常见的钾肥有硫酸钾(K2SO4)、氯化钾(KCI)、 草木灰(成份K2CO3)等含钾化合物。大多数为白色晶体,可溶于水。
化肥的简易鉴别
鉴别方法 氮肥 钾肥 磷肥
看外观 白色晶体
大多数为灰白色粉末
加水 全部溶于水 大多数不溶于水或部分溶于水
加熟石灰研磨 放出有刺激性气味的氨气 没有刺激性气味的氨气放出
如何区分不同种氮肥?
氮肥的简易鉴别
2NH4NO3+Ca(OH)2=Ca(NO3)2+2H2O+2NH3↑
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
课题2 化学肥料
化学肥料与农家肥料的比较
化学肥料 农家肥料
所含营养元素的种类单一,但单一营养元素含量大 常含多种营养元素,但单一营养元素的含量较小
一般易溶于水,易于被农作物吸收,肥效快 一般难溶于水,肥效慢但肥效长
便于工业生产,成本较高 便于就地取材,成本低廉
有些化肥如长期大量施用会使土壤酸化板结 能改良土壤结构
1.什么是化肥?
化学肥料是用矿物质、空气、水等作原料,经过化学加工精制而成的肥料。
2.化肥有哪些类型?
氮肥:化肥主要含有氮元素的称氮肥。
磷肥:化肥主要含有磷元素的称磷肥。
钾肥:化肥主要含有钾元素的称钾肥。
复合肥:化肥中含有两种或两种以上
主要营养元素的称复合肥。
氮肥
磷肥
钾肥
复合肥料
(NH4)2SO4
NH4HCO3
NaNO3
NH4Cl
Ca(H2PO4)2
K3PO4
K2SO4
KCl
kNO3
(NH4)3PO4
K2CO3
NH4NO3
氮磷钾肥的化学成分及其主要作用
分类 氮肥 磷肥 钾肥
种类
缺乏症状
作用
1.氮肥
氮肥的作用:
氮是植物体内核酸、蛋白质和叶绿素的组成元素。
氮肥能促使植物的茎、叶生长茂盛,叶色浓绿。
常见的氮肥:
尿素:CO(NH2)2
氨水:(NH3·H2O)
铵盐:NH4HCO3、NH4Cl、(NH4)2SO4
硝酸盐:NH4NO3、NaNO3
知识积累
①空气中虽然含有大量的氮气,但植物通常只能吸收化合物中氮元素,不能直接吸收空气中的氮气。
②根部有根瘤菌的豆科植物能把氮气转化为含氮的化合物而吸收。
③将氮气转化为氮的化合物的方法叫做氮的固定。
(4)氮肥(铵盐)的制取:
NH3+H2O+CO2=NH4HCO3(碳铵)
2NH3+H2SO4=(NH4)2SO4(硫铵)
2.磷肥
磷是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,参与各种重要的代谢活动,与植物的细胞分裂、生成及有机物的转化等有密切的关系。磷可促进作物生长,使之穗粒饱满,还可增强抗寒、抗旱能力。
作物缺磷的表现:生长迟缓、产量降低。
常见的磷肥:
①磷矿粉:Ca3(PO4)2
②钙镁磷肥:钙和镁的磷酸盐
③过磷酸钙:Ca(H2PO4)2+CaSO4
钾在植物代谢活跃的器官和组织中分布量较高。钾具有保证各种代谢过程顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能。
3.钾肥
作物缺钾的症状:
常见的钾肥:
硫酸钾(K2SO4)、氯化钾(KCl)
叶尖及叶缘发黄,甚至叶肉坏死。
这类肥料的特点是能同时均匀地供给作物几种养分,充分发挥营养元素间的相互作用。
复合化肥:含两种或两种以上营养元素的化肥。
如:磷酸二氢铵(NH4H2PO4)、磷酸铵氢(NH4)2HPO4、硝酸钾(KNO3)
4.复合肥料
氮磷钾肥的化学成分及其主要作用
分类 氮肥 磷肥 钾肥
种类 尿铵硝盐 磷酸盐 钾盐
缺乏症状 叶 根 茎
作用 叶色浓绿 抗寒抗旱 抗病虫倒
化肥和农药使用的利与弊:
1.使用化肥农药的利弊
利:农业增产的最有力措施。
弊:不合理施用化肥会带来环境问题。
(1)污染大气:有NH3等不良气体排放。
(2)污染水体:使水体含氮和磷增多,富营养化。
(3)破坏土壤:使土壤酸化,板结。
农药在自然界中的转移
2.建议:合理施用化肥,减少污染,保障食品安全,维护地球的生态平衡。
[注意] 硫酸铵、硫酸钾不宜长期大量施用,以免增加土壤的酸性。长期使用会造成土壤板结,破坏土壤结构,造成环境污染。
化肥的简易鉴别
氮磷钾肥的初步比较
白色晶体
刺激性气味
无气味
无气味
酸味
无气味
溶于水
溶于水
不溶
部分溶
氮肥 磷肥 钾肥
碳酸氢铵 氯化铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾
外观
气味
溶解性
取少量的氯化铵,加入适量的熟石灰粉末,混合、研磨,能否嗅到气味?
铵盐与熟石灰反应:
2NH4NO3+Ca(OH)2=Ca(NO3)2+2H2O+2NH3↑
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?
铵盐与碱(强碱)混合加热,都会产生有刺激性气味的氨气放出。此法用于铵盐的检验。
加NaOH等碱溶液。如果产生使湿润的红色石蕊试纸变蓝的气体,则含有NH4+
因此,使用铵盐作肥料时,不能跟熟石灰等碱混施。
(NH4)2SO4+2NaOH= Na2SO4+2H2O+2NH3↑
NH4HCO3+Ca(OH)2 = CaCO3↓+2H2O+NH3↑
比较下列两个反应,你能否说出能检验铵根离子的试剂?
实验1、向硫酸铵浓溶液中滴加氢氧化钠溶液,发生了什么变化?写出化学方程式。
(NH4)2SO4+2NaOH= Na2SO4+2H2O+2NH3↑
铵盐的性质:
产生一种刺激性气味的气体
实验2、把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化?
使湿润的红色石蕊试纸变蓝
变化的原因是什么?
产生氨气,氨气是碱性的。
铵盐能与碱反应,生成氨气
二、化肥的简易鉴别
氮肥 钾肥 磷肥
看外观 白色晶体 白色晶体 灰白色粉末
加水 能溶于水 能溶于水 大多不溶或部分溶于水
灼烧 可燃烧,熔化起泡或冒烟 不燃烧,跳动或有爆炸声 无明显变化
加熟石灰 放出有刺激性气味的气体 无明显变化 无明显变化
1.氮肥:常见的氮肥有尿素[CO(NH2)2〕、氨水(NH3·H2O)、铵盐(如:NH4HCO3、NH2Cl)、硝酸盐(如:NH4NO3、NaNO3)等含氮化合物。大多数为白色晶体,可溶于水。
(1)有机物——尿素CO(NH2)2(白色或淡黄色晶体,含氮量最高的氮肥)
(2)碱——NH3·H2O(易挥发出氨气,有腐蚀性,稀释后施用)
(3)铵态氮肥——NH4HCO3(易分解,施用时深埋),(NH4)2SO4(长期使用会使土壤酸化,板结)
(4)硝酸盐——NaNO3,NH4NO3(易爆,结块不可使用铁锤砸)
2.磷肥:常见的磷肥有磷矿粉〔Ca3(PO4)2〕、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙(磷酸二氢钙和硫酸钙的混合物)等含磷物质。大部分为灰白色粉末,不溶或者部分溶于水
过磷酸钙:CaSO4和Ca3(H2PO4)2的混合物(部分溶解)
钙镁磷肥:Ca3(PO4)2 和 Mg3(PO4)2 (难溶于水)
磷矿粉: Ca3(PO4)2 (难溶于水)
3.钾肥:常见的钾肥有硫酸钾(K2SO4)、氯化钾(KCI)、 草木灰(成份K2CO3)等含钾化合物。大多数为白色晶体,可溶于水。
化肥的简易鉴别
鉴别方法 氮肥 钾肥 磷肥
看外观 白色晶体
大多数为灰白色粉末
加水 全部溶于水 大多数不溶于水或部分溶于水
加熟石灰研磨 放出有刺激性气味的氨气 没有刺激性气味的氨气放出
如何区分不同种氮肥?
氮肥的简易鉴别
2NH4NO3+Ca(OH)2=Ca(NO3)2+2H2O+2NH3↑
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
同课章节目录
