【期中复习】浙教版科学八下期中专题复习:组成物质的元素(知识点精讲+课后精炼)
文档属性
| 名称 | 【期中复习】浙教版科学八下期中专题复习:组成物质的元素(知识点精讲+课后精炼) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-04-01 18:05:28 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
浙教版科学八下---组成物质的元素
一、小题精检
1.钙是人体中含量较多的元素之一,幼儿及青少年缺钙会得佝偻病和发行不良,老年人缺钙会发生骨质疏松,容易骨折.人体中的钙元素主要以羟基磷酸Ca?10(PO4)?6(OH?)2钙晶体的形式存在于骨骼和牙齿中.下列对羟基磷酸钙的说法中错误的是?(?? ? )
A.羟基磷酸钙属于混合物 B.羟基磷酸钙的?1?个分子中含有?44?个原子
C.羟基磷酸钙由四种元素?组成 D.羟基磷酸钙中磷元素的化合价为?+5?价
2.如图为元素周期表的一部分(x元素信息不全).下列说法正确的是?(?? ?? )
A. 碳的化学性质活泼 B.?X表示N2
C. 氧原子的质子数是8 D. 三种元素原子的核外电子数相同
3.下列化学用语与含义相符的是?(?? ?? )
A.Al3+—1个铝离子带3个单位正电荷 B.2H2O—2个水分子
C.2H—1个氢分子由2个氢原子构成 D.Na+—钠元素的化合价为+1价
4.录象用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3?xO3+x的化合物。已知其中氧元素为?2价、钴(Co)和铁可能呈现+2价或+3价。且上述化合物中,每种元素只有一种化合价,则x值为 ,铁的化合价为 ,钴的化合价为 .
5.(1)用数字和化学符号表示:
2个铜离子 ,3个硫酸根离子 ,4个亚铁离子 ,
4个铁原子 ,铁元素的化合价为+3 ,3个二氧化硫分子 .
2个四氯化碳分子 ,一个双氧水分子 ,6个碘分子 .
(2)写出下列物质的化学式:
氧化铜 氧化铁 氧化亚铜 氯化钾 硫酸铝
氢氧化亚铁 氯化银 硝酸铜 碳酸钠 二氧化锰
碳酸氢钠 硫酸氢钠 氧化铝 硫酸铁 过氧化氢
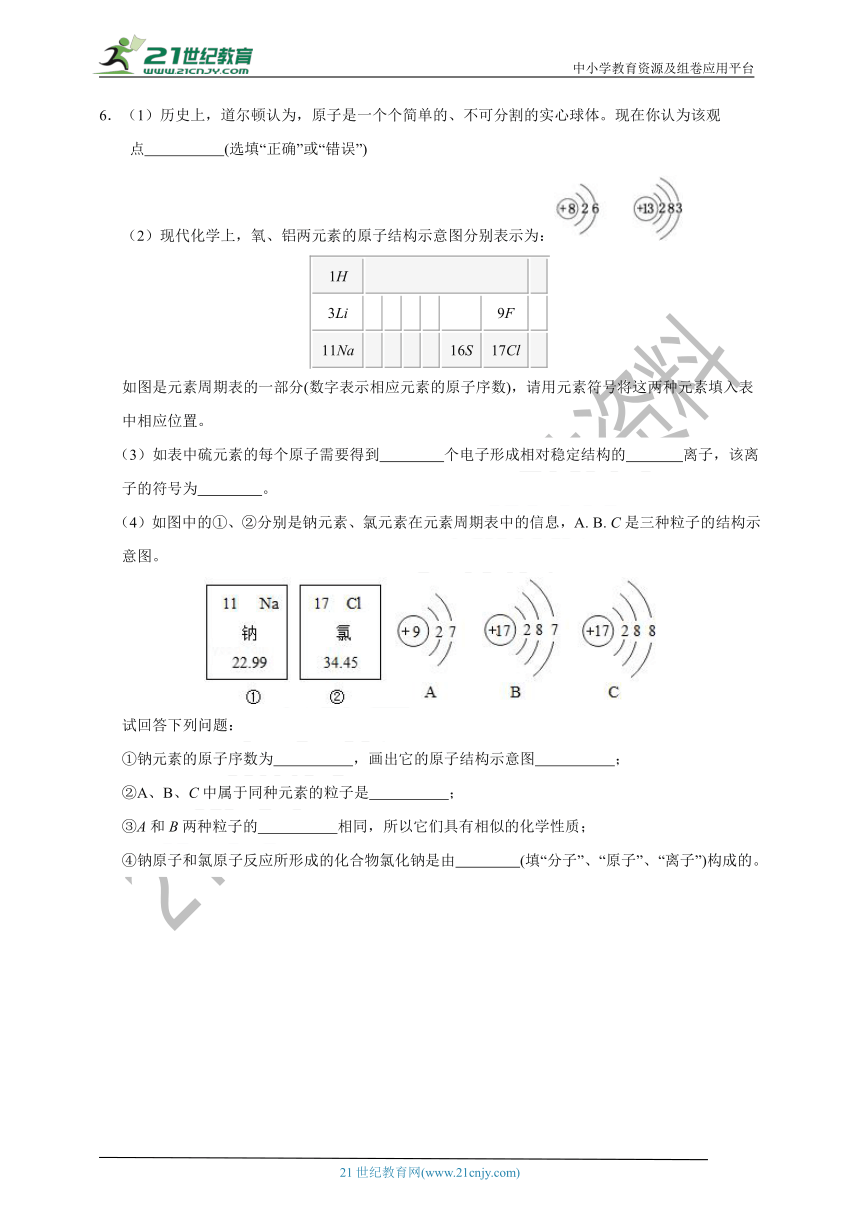
6.(1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体。现在你认为该观
点 ????????? (选填“正确”或“错误”)
(2)现代化学上,氧、铝两元素的原子结构示意图分别表示为:
1H ? ?
3Li ? ? ? ? ? 9F ?
11Na ? ? ? ? 16S 17Cl ?
如图是元素周期表的一部分(数字表示相应元素的原子序数),请用元素符号将这两种元素填入表
中相应位置。
(3)如表中硫元素的每个原子需要得到 ????????? 个电子形成相对稳定结构的 ????????? 离子,该离
子的符号为 ????????? 。
(4)如图中的①、②分别是钠元素、氯元素在元素周期表中的信息,A. B.?C是三种粒子的结构示意图。
试回答下列问题:
①钠元素的原子序数为 ????????? ,画出它的原子结构示意图 ????????? ;
②A、B、C中属于同种元素的粒子是 ????????? ;
③A和B两种粒子的 ????????? 相同,所以它们具有相似的化学性质;
④钠原子和氯原子反应所形成的化合物氯化钠是由 ????????? (填“分子”、“原子”、“离子”)构成的。
二、考点精讲
知识点1:元素的种类
1.元素的分类:(1)金属元素:如:钠、银、汞等;
(2)非金属素:如:氢、碳、溴等;
(3)稀有气体元素:如:氦、氖、氩等。
2.物质分类:
有关物质类别的几个概念
(1)纯净物:由一种物质组成的物质,组成固定 (?http:?/??/?baike.baidu.com?/?view?/?19218.htm" \t "http:?/??/?baike.baidu.com?/?view?/?_blank?),有固定的物理性质 (?http:?/??/?baike.baidu.com?/?view?/?41542.htm" \t "http:?/??/?baike.baidu.com?/?view?/?_blank?)和化学性质 (?http:?/??/?baike.baidu.com?/?view?/?41562.htm" \t "http:?/??/?baike.baidu.com?/?view?/?_blank?)的物质,有专门的化学符号,能用一个化学式表示。纯净物分为单质和化合物。
①单质:由同种元素组成的纯净物叫单质。
②化合物:由不同种元素组成的纯净物叫化合物。
③氧化物:由两种元素组成,有一种是氧元素的化合物叫氧化物。
注:同一种元素组成的物质不一定是单质,也可能是混合物。
(2)根据物质的组成或种类物质简单分类
知识点2:元素的分布
1.地壳中元素的分布:地壳中主要由氧、硅、铝、铁、钙、钠、钾、镁、氢等元素组成。地壳里氧、硅、铝、铁的含量相对较多,而与生物关系密切的氢的含量为0.76%,碳为0.087%,氮为0.03%,相对较少
2.海水中的元素分布
海水中除氢和氧外(氧85.5%,氢10.7%),含量较高的是氯元素(2.0%)和钠、镁元素等,
还有些贵重金属,如金等。每升海水中含量在 1 毫克以上的元素有Cl、Na、Mg、S、Ca、K、
Br、C、Sr、B 和 F 11种,一般称为“主要元素”。每升海水中含量在1毫克以下的元素,叫“微量
元素”或“痕量元素”。
3.有机化合物:含碳元素的一类化合物,此类化合物主要由碳氢氧三种元素组成。如,糖类、脂肪、酒精、蛋白质等。
4.人造元素:通过核反应制的,一部分人造和天然元素具有放射性。
5.人体中的元素
A人体中最多的三种元素:氧65%、碳18%、氢10%。
B最多的金属元素是钙。
C常量元素、微量元素与有害元素
(1)常量元素:人体11中元素为大量元素,约占99.95%,其中每种元素的含量超过0.01%称为常量元素。如:碳氢氧氮硫磷氯钙镁钠钾。
(2)微量元素:人体中以无机盐形式存在的元素含量低于0.01%,称为微量元素。如铁、锌、碘、硒元素等。
(3)有害元素:镉、汞、铅等。这些元素的存在和食物、水体、大气的污染密切相关。
知识点3:元素符号
1.常见元素的元素符号
2.元素符号表示的意义
(1)表示一种元素?(宏观上) (2)表示该元素的一个原子?(微观)
(3)如果物质直接有原子构成,则该元素符号还表示一种物质,如金属、固态非金属、稀有气体。
知识点4:元素周期表
1.为便于研究元素的性质和用途,科学家们把人们已知的110多种元素按照核电荷数科学有序的排列起来,这就得到元素周期表。用不同的颜色对金属元素和非金属元素做了区分。
2.编排结构
(1)横行(周期):每一横行代表一个周期,共7个横行,表示7个周期,同一周期从左到右,
原子的质子数逐渐增加。开头的是金属元素,靠近尾部的是非金属元素,结尾的是稀有气体元素,
这就是周期性的具体表现。
(2)纵列(族):共有18个纵列,16个族。同族元素化学性质很相似。
(3)每一格:每种元素占据一格,均包括元素的原子序数、元素符号、元素名称、相对原子质量等内容。
(4)从元素周期表中可获得的信息
A元素单质的物理状态;元素是人工合成的还是自然存在的;元素是金属、非金属还是稀有气体。
B根据元素所处的位置可知该元素原子的质子数(核电荷数)、核外电子数、元素的化学性质等。
(5)意义:a学习和研究科学的重要工具,为寻找新元素提供理论依据。
b由于元素周期表中位置越靠近的元素性质越相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、农药、催化剂等)
知识点5:化学式
1.定义:用元素符号表示物质的式子称化学式。例如O2、CO2等。
2.意义:便于国际交流,是全世界认同的化学语言。
化学式的含义 以H2O为例
宏观 表示一种物质 表示水这种物质
表示该物质由哪些元素组成 表示水由氢元素和氧元素组成
微观 由分子构成的物质的化学式表示物质的一个分子 表示一个水分子
表示构成物质的一个分子中含有的元素的原子个数或原子个数比 表示一个水分子由两个氢原子和一个氧原子构成
3.化学式的书写规则??
(1)单质化学式的写法?
?????①首先写出组成单质的元素符号,再在元素符号的右下角用数字表示出1个单质分子的原子个数(早经人们实验测定的已知数据)。?
?????②稀有气体、金属单质、固态非金属单质通常用元素符号表示它们的化学式。这样,这类元素符号又增添了一种含义:可以表示某些物质。?
例如:?氧气、氮气、氢气、氯气四种气体(每个分子里含有两个原子。)
金属铝、金属铜、金刚石、固态磷。 氦气、氖气、氩气三种稀有气体(均有单原子构成)。
臭氧气体(分子内含有三个氧原子)。?????
(2)化合物化学式的写法?
? ???①先按一定顺序写出组成化合物的所有元素符号:一般把氧元素符号排右边,另一种元素符号排左边;金属元素、氢元素与和非金属元素组成的化合物,一般把金属元素、氢元素符号排左边,非金属元素符号排右边。(指两种元素组成的化合物)?
???? ②然后在元素符号的右下角用数字写出每个化合物分子中该元素的分子个数。直接由离子构成的化合物,其化学式常常用离子的最简整数比表示。?
【注意】:不同状态下的同一物质组成相同,因此化学式也相同。
4.化学式的读法?
由两种元素组成的化学式,一般是从左到右读作“谋化某”,其顺序与化学式的书写恰好相反。
a要读出各元素的原子个数,但1一般不读出,如?HCl读作氯化氢;?ZnS读作硫化锌;?NaCl读
作氯化钠;?MgO读作氧化镁。
b若两种元素可组成多种不同的物质,在其化学式中,某元素原子个数不同且在这一化学式中该
元素的原子个数为“1”要读出。CO读作一氧化碳;CO2读作二氧化碳;?SO2读作二氧化硫;?SO3
读作三氧化硫。
知识点6:离子的符号
1.离子概念:带电的原子或原子团。原子团是由两种或两种以上元素的原子结合而成的原子集团。在许多化学反应中作为一个整体参加反应。带正电荷的离子称为阳离子,带负电荷的离子称为阴离子。原子得到电子形成阴离子,失去电子形成阴离子。
2.离子符号是在形成该离子的原子的元素符号右上角标出该离子所带的电荷数。
3.离子符号的写法
A只带一个单位电荷,则把个数1省去,直接在元素符号右上角写+或—号。
B带多个单位正电荷,则在元素符号右上角先写电荷数,再写+或—号。
C较为复杂的离子:有些离子的组成不止一种元素,如氢氧根离子,这种离子称为某某跟离子,这些离子是带电的原子团。常见的较为复杂的离子见下表:
离子名称 离子符号 离子所带的电荷
氢氧根离子 OH - -1
硝酸根离子 NO3- -1
硫酸根离子 SO42- -2
碳酸根离子 CO32- -2
碳酸氢根离子 HCO3- -1
铵根离子 NH4+ +1
D多个离子的表示:在离子符号的前面加上数字。
E离子中各个数字的含义归纳:5SO42-:5表示5个SO42-,2表示每个SO42-带有两个单位负电荷,4表示一个SO42-离子中含有4个氧原子。
【注意】:a在化学反应里,常作为一个整体参加反应的原子集团叫原子团,也叫根。原子团也是
离子。原子团和原子团也可形成化合物。
b原子团右上角的而数字表示的是整个原子团所带的电荷,而不是其中的某个原子所带的电荷。
知识点7:化合价
1.定义:用来表示不同元素的原子形成化合物时,原子之间相互化合的数目。
【注意】:化合价是元素的性质,因此通常称为元素的化合价,而不应该称为原子的化合价,所以化合价具有宏观的意义,没有微观的意义。
2.化合价表示的方法
化合价有正、负之分,在元素符号的正上方用带“+”、“—”号的阿拉伯数字表示。一般把“+”、“—”号写在前面,数字写在后面。
3.化合价与离子符号的异同
同种元素(或原子团)的化合价和其离子所带的电荷通常数值相等,正、负号相同,只是位置不同。
4.化合价的规律
A在化合物里,氢元素通常显+1价,氧元素通常显-2价。
B金属元素在化合物里通常显正价。
C非金属元素和金属元素或氢元素化合时显负价,与氧元素化合时显正价。
D元素的化合价是元素的原子在形成化合物时表现出来的一种性质。因此,在单质分子里,元素
的化合价为0。
E有些元素在不同的化合物里可能显相同的化合价,如氧化钙,碳酸钙中钙元素的化合价均为+2价;而有些元素在不同的化合物里可能显不同的化合价,如氧化铁、氧化亚铁中铁的化合价显+3、+2价;而有些元素在同一种化合物里可能显不同的化合价如硝酸铵中氮元素分别显-3价和+5价。
【注意】对于常见的铁元素存在+2价、+3价和铜元素存在+1价、+2价,我们习惯上将显低价的
化合价称为“亚”,如Cu2O读作氧化亚铜,而CuO读作氧化铜。
5.常见元素的化合价
a一价钾钠氢氯银二价氧钙钡镁锌;三铝四硅五价磷;二三铁、二四碳;一至五价都有氮铜汞二
价最常见。
b初中常见原子团化合价口决:
负一硝酸氢氧根,负二硫酸碳酸根,还有负三磷酸根,只有铵根是正一
6.化合价的应用依据:在化合物里正负化合价的代数和为0。?
A根据化学式求元素的化合价
B根据化合价判断化学式正误 例如:判断NaCl2的化学式是否正确。
C根据化合价写出化合物的化学式
三、考点精练
考点1:组成物质的元素
例1.碘盐中含有一定量的碘酸钾.3月15日起,我省实施新的碘盐含碘量标准,碘盐中碘含量从每千克35毫克降至25毫克.这里的“碘”是指( )
A.碘原子 B.碘分子 C.碘元素 D.碘单质
例2.对于Fe、Fe2+、Fe3+三种微粒的判断,正确的是( )
①核电荷数相同????②核外电子数相等? ??③电子层结构完全相同???
④质量几乎相等 ⑤等质量的三种微粒所含的质子数相等????⑥三种粒子的化学性质相似
A. ①④⑤ B. ①③⑤ C. ②③④ D. ①②③④⑤⑥
例3.Al和Al3+属于同一种元素,因为它们的 相同.Al和Al3+属于 (相同或不同)的粒子,因为它们核外的电子总数 (相同或不同).
例4.用下列物质的序号回答有关问题:(注意有的空格不只有一个答案)
(1)已知“?”、“●”表示质子数不同的原子。下列表示的气体物质中,属于化合物的是 表
示的气体物质中,属于混合物的是 。
(2)有下列物质:
①雨水②蒸馏水③雨后洁净的空气④四氧化三铁⑤液氮
⑥高锰酸钾完全分解后的固体产物
其中属于混合物是 ,属于纯净物是 ,属于单质的是 ,属于氧化物的是 。
考点2:元素周期表
例5.如图判断关于汞元素的相关信息正确的是( )
A.汞的化学式为Hg B.汞原子的质量为200.6g
C.汞原子的中子数是80 D.汞为非金属元素
例6.元素周期表是学习和研究化学的重要工具,试根据图示回答相应问题: ????
55??? Cs
? ? 铯
?132.9
? 甲 ? ? ? ? ? ? ? ? ? ??乙
(1)图甲是铯元素在元素周期表中的信息,则铯元素属于 (填“金属”或“非金属”)元
素,该元素原子的核外电子数为 .
(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的 (填
字母序号)。
A.原子序数Z>Y B.核外电子数:X=Y C.Y和Z处于同一周期
考点3:化学式和化合价
例7.化学式H2O所表示的意义中,错误的是(? )
A. 表示水这种物质 B. 表示水分子
C. 表示1个水分子由2个氢元素和1个氧元素构成 D. 表示水由氢元素和氧元素组成
例8.某金属元素R的相对原子质量为M,其氧化物的相对分子质量为N,则该金属元素的化合价可能是( )
A.(N?2M)/16 B.(N?M)/16 C.(N?M)/8 D.(N?2M)/8
例9.有下列三组物质,每组中均有一种与其他物质所属类别不同,请在下面的横线上写出这种物质的化学式。
(1)食醋、牛奶、蒸馏水: .
(2)氧化镁、氯化钠、干冰: .
(3)碳酸钙、氢气、氧氧化钙: .
例10.(1)含磷洗衣粉中含有Na5PXO10,其洗涤废水的任意排放会污染环境,已知在上述化合物中磷的化合价为+5,则X应为 。
(2)元素A与钠形成的化合物的化学式为NaxA,元素B的氯化物的化学式为BCly,若化
合价不变,则A、B两种元素组成的化学式为 。
四、课后精练
一、选择题
1.科学家获得了极具理论研究意义的N4分子,N2、N4分子结构如图所示.下列有关N4?的说法正确的是( )
A、N4约占空气体积的78% B、N4是一种单质
C、N4转化为N?2?是物理变化 D、N4与N2?的组成元素相同,因此性质相同
2.下列五种物质中均含有氮元素,它们是按氮元素的化合价由低到高的顺序排列的:①NH3;②N2;③NO;④X;⑤N2O5.根据排列规律,X不可能是( )
A. N2O3 B. N2O4 C. NaNO2 D. NaNO3
3.与OH-具有相同质子数和电子数的微粒是( )
A.NH3 B.HF C.NH2- D.F
4.2014年5月7日天津某工程检测公司,在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,如图是铱元素在元素周期表中的信息,下列说法正确的是( )
A. 铱原子的相对原子质量为192.2g B. 铱原子核内中子数是77
C. 铱属于非金属元素 D. 铱元素符号为Ir
二、填空题
5.化学是在原子、分子水平上研究物质和创造物质。
A是一种比较清洁的燃料,已知A和B能在一定条件下反应生成C和D。四种物质的微粒示意图如下:
上述物质中属于氧化物的是________(填化学式,下同);属于有机物的是________。
6.用符号表示:
(1)氢元素 ; (2)氧气 ;
(3)2个钠离子 ; (4)3个臭氧分子 ;
(5)7个硫酸根离子 ; (6)n个氮原子 ;
(7)人体含量最多的金属元素符号 ;人体含量最多的非金属元素符号 ;人体含量最多的物质符号 。
X、Y、Z三种元素组成的化合物里,Y为+3价,X为+6价,Z为-2价;X、Z两种元素在化合物 里组成的原子团为-2价,且仅含5个原子。则由X、Y、Z组成的化合物的化学式为 。
8.我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律。下表列出的是1?18号元素的部分最高正化合价和最低负化合价。请你阅读后,回答下列问题:
1H+1 2He0
3Li+1 4Be+2 5B+3 6C+4?4 7N+5?3 8O?2 9F?1 10Ne0
11Na+1 12Mg+2 13Al+3 14Si+4?4 15P+5?3 16S 17Cl+7?1 18Ar0
(1)已知某元素R2+的离子结构示意图为;则该元素的 的最外层电子数为 ,属于 元素(填“金属”或“非金属”);11号元素在化学反应中形成的粒子与 (写元素符号)原子具有相同的核外电子排布。
(2)推测16号元素的最低负化合价为 ,最高正化合价的氧化物的化学式为 。
(3)元素周期表是我们学习化学的重要工具,它缊藏着很多规律。从化合价角度分析,我们可以说出其中的一个规律: 。
9.有下列粒子:a.Fe3+ b.3H ? c.3N2? d. ?e.
按要求填空(填序号):
①表示3个氮分子的是 ,
②表示铁离子的是 ,
③a与d两粒子结合形成物质的化学式是 ,
④电工使用的试电笔触电发红光,是因为管内充 气(填名称)。
10.右图为某化学反应的微观模拟示意图:“”表示氮原予,“”表示氢原子.请你根据图示回答下列问题:
(1)A物质 元素组成(填元素名称):
(2)A、B、C三种物质中属于化合物的是 ;
(3)该反应的化学方程式为 ;
(4)通过反应的微观模拟示意图,还可得出的结论(填一条) .
【提高训练】
1.对下列微粒符号中“2”的理解正确的是( )
A.2Cu中的“2”表示2个铜元素
B.Fe2+中的“2”表示每个亚铁离子带有2个单位的正电荷
C.H2S中的“2”表示两个硫原子
D.FeCl2中的“2”表示铁元素为+2价
2.天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种氧化镍晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另外两个Ni2+被两个Ni3+所取代。结果晶体仍呈电中性,但此化合物中Ni和O的比值却发生了变化。某氧化镍样品组成中粒子个数比为Ni:0=85:100,计算该晶体中Ni3+与Ni2+的离子个数比为 。
3.寻找规律,在横线上填上相应的化学式或名称:
(1)氯元素常见的化合价有?1、+1、+3、+5、十7,下面五种物质都是含氯元素的酸。
HC1O4(高氯酸)、 (氯酸)、HC1O2(亚氯酸)、HC1O(次氯酸)、 (氢氯酸)
(2)有机化合物里有一类物质叫烷烃,分子中碳、氢原子个数呈一定的规律。
CH4(甲烷)、C2?H6(乙烷)、C3H6(丙烷)、C4H10( )、 (戊烷)…
4.如图表示的是地壳里所含各种元素的质量分数。请根据图回答下列问题:
①表示出的金属元素有 种;
②地壳中铝元素的含量为 ;
③地壳中含量最多的非金属元素与含量占第一位的金属元素之间,形成化合物的化学式是 ;
④地壳中含量最多的两种非金属属元素之间形成化合物的化学式是 。
浙教版科学八下---元素符号表示的量参考答案
一、小题精检
1.A 2.C 3.B 4.1;+3;+2 5.略
6.(1)错误;(2)见上图;(3)2,硫,S2?;(4)①11,;②BC;③最外层电子数离子。
三、考点精练
考点1:组成物质的元素
例1.C 例2.A 例3.质子数(或核电荷数);不同;不同;
例4.(1)B;CD;(2)①③⑥;⑤;②④
考点2:元素周期表
例5.A 例6.(1)金属;55;(2)AC.
考点3:化学式和化合价
例7.C
例8.(1)当x为奇数时,R氧化物的化学式为:R2Ox?,可得
???? N=2M+16x,解答? x=N-2M16;
(2)当x为偶数时,R氧化物的化学式为:ROx2;可得N=M+16×x2,解答? x=N-M8;
所以金属元素的化合价可能是=N-2M16?或??N-M8;故选AC.
例9.(1)H2O;(2)NaCl;(3)H2
例10.(1)3;(2)BxAy
四、课后精练
一、选择题
1.B 2.D 3.C 4.D
二、填空题
5.CO2、H2O C2H5OH(或C2H6O)
6.(1)H;(2)O2;(3)2Na+;
(4)3O3;(5)7SO2?4;(6)nN;(7)Ca;O;H2O
7.Y2(XZ4)3
8.(1)2;金属;Ne (2)2;SO3
(3)同一纵行,元素最高正价相同(或其它合理答案也可).
9.①c;②a;③FeCl3;④氖。
10.(1)N;(2)C;(3)N2+3H2═2NH3.(4)化学变化中分子可分原子不可分
【提高训练】
1.B
2.6:11
3.(1)HC1O3,HCl;???(2)丁烷,C5H12.
4.①6;②7.73%;③Al2O3;④SiO2
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
