人教版高中化学必修二2-1化学能与热能(19张PPT)
文档属性
| 名称 | 人教版高中化学必修二2-1化学能与热能(19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-05 20:04:59 | ||
图片预览





文档简介
[ * ]
学与问
煤、石油、天然气的主要化学成分是烃类(烃——含C、H,煤中含有大量的碳)等有机物,它们在燃烧时释放出热能。你一定想知道,这种能量从何而来?它与化学物质及其化学反应有什么关系?
石灰石(主要成分是CaCO3)要经过高温煅烧才能变成生石灰(CaO),高温条件提供的热能在石灰石的分解反应中起到什么作用?
[课本P30]
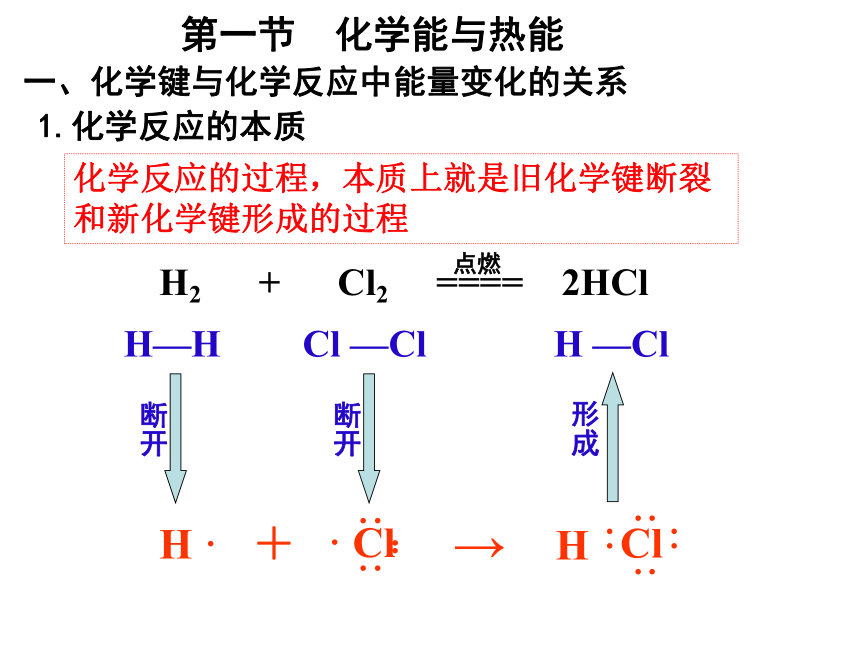
第一节 化学能与热能
一、化学键与化学反应中能量变化的关系
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
1.化学反应的本质
H ·
+
→
H—H
Cl —Cl
H —Cl
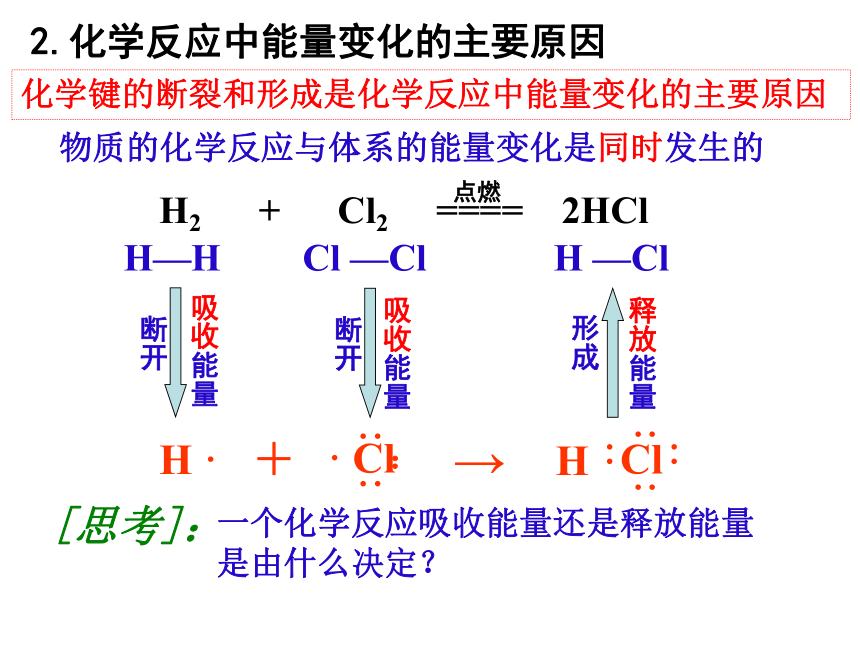
化学键的断裂和形成是化学反应中能量变化的主要原因
2.化学反应中能量变化的主要原因
H ·
+
→
H—H
Cl —Cl
H —Cl
物质的化学反应与体系的能量变化是同时发生的
一个化学反应吸收能量还是释放能量
是由什么决定?
[思考]:
3.决定化学反应吸收能量还是放出能量的因素
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
在25℃,101KPa条件下,
断开1molH-H键要吸收436kJ的能量,
而由H原子形成1molH-H键要放出436kJ的能量,这个能量就是H-H的键能
共价键的键能
(1)微观
某些共价键的键能(kJ/mol)
键能越大→化学键越牢固→分子越稳定
共价键 键能 共价键 键能
H-H 436 C-H 415.0
Cl-Cl 247 O-H 462.8
Br-Br 193.7 N-H 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
已知 H-H : 键能为436kJ,
Cl-Cl : 键能为247kJ,
H-Cl : 键能为431kJ,
则反应 H2+Cl2=2HCl 是吸收能量还是释放能量?
(1)化学键断裂时要吸收能量,吸收的总能量为:
436kJ+247kJ=683kJ
(2)化学键形成时要释放能量,释放的总能量为:
431kJ×2=862 kJ
(3)反应中能量的变化——释放能量:
862kJ—683kJ=179kJ
[结论] 1、物质中的原子之间是通过 相结合的。化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。断键和成键都伴随着能量的变化。当物质发生反应时,断开反应物中的化学键要 能量,而形成生成物的化学键要 能量。
如:2H→H-H 436 kJ能量 H-H→2H 436 kJ能量
C-H→C+H 415kJ能量 CH4→C+4H 吸收 kJ能量
2、化学反应中能量变化的主要原因是: ,
断裂化学键要吸收能量,形成化学键要放出能量,物质的化学反应与体系的能量是 发生的。各个物质因为具有不同的组成、结构,所含 不同,反应时能量变化也就不同。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的________与生成物的________的相对大小
∑E(反应物)_______∑E(生成物)——放出能量
∑E(反应物)_______∑E(生成物)——吸收能量
即:Q=
(2)宏观:
水由高处向低处流释放能量
(势能转换为动能)
将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为
势能)
水能的变化
反应物的总能量<生成物的总能量
化学反应吸收能量
反应物的总能量>生成物的总能量
化学反应释放能量
化学能的变化
取决于反应物的总能量与生成物的总能量的相对大小
[结论] 1、物质中的原子之间是通过 相结合的。化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。断键和成键都伴随着能量的变化。当物质发生反应时,断开反应物中的化学键要 能量,而形成生成物的化学键要 能量。
如:2H→H-H 436 kJ能量 H-H→2H 436 kJ能量
C-H→C+H 415kJ能量 CH4→C+4H 吸收 kJ能量
2、化学反应中能量变化的主要原因是: ,
断裂化学键要吸收能量,形成化学键要放出能量,物质的化学反应与体系的能量是 发生的。各个物质因为具有不同的组成、结构,所含 不同,反应时能量变化也就不同。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的________与生成物的________的相对大小
∑E(反应物)_______∑E(生成物)——放出能量
∑E(反应物)_______∑E(生成物)——吸收能量
即:Q=
二、化学能与热能的相互转化
1.两条基本的自然定律
(1)质量守恒定律
(2)能量守恒定律
一种形式的能量可以转化为另一种形式
的能量,总能量保持不变
化学能是能量的一种形式,可以转化为其他
形式的能量,如热能和电能等
2.化学反应中的能量变化通常主要表现为热量的变化
——吸热或放热
放出热量的化学反应
吸收热量的化学反应
(1)放热反应:
(2)吸热反应:
[实验2-2] Ba(OH)2·8H2O 与 NH4Cl 的反应
[实验2-1] 铝片与盐酸的反应
该反应是放热反应
结 论
放出大量气泡,溶液温度升高
现 象
Ba(OH)2·8H2O与NH4Cl反应过程吸收热量,是吸热反应
有刺激性气味气体产生;玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉
结 论
现 象
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
常见的放热反应和吸热反应
放热反应
物质与氧气的反应
燃烧
中和反应
金属与酸反应
活泼金属与水的反应
生石灰和水反应
大部分化合反应
吸热反应
C+CO2
C+H2O
H2+CuO
Ba(OH)2·8H2O+NH4Cl
Fe+H2O(g)
Na2CO3·10H2O+NH4NO3
大部分分解反应
三、化学能的应用
1.化学能的应用
(1)利用热量进行生活、生产和科研
(2)利用热能使很多化学反应得以发生
(1)燃料充分燃烧
(2)减少污染
注意:
(3)人体内发生的氧化还原反应与体外的燃烧本质相同,
最终产物一样(都是二氧化碳和水),都是放热反应,
所放出的能量也相等,只是二者反应条件不同,所以生
物化学过程在利用“能源”上更为合理、有效。
2.社会发展与能源利用
3.人类利用能源的三个阶段
柴草时期→化石能源时期→多能源结构时期
1、物质发生化学反应的同时还伴随着能量的变化,而这种能量 变化又通常表现为热能变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
4、化学反应中能量转化遵循能量守衡原则。
【小结】
学与问
煤、石油、天然气的主要化学成分是烃类(烃——含C、H,煤中含有大量的碳)等有机物,它们在燃烧时释放出热能。你一定想知道,这种能量从何而来?它与化学物质及其化学反应有什么关系?
石灰石(主要成分是CaCO3)要经过高温煅烧才能变成生石灰(CaO),高温条件提供的热能在石灰石的分解反应中起到什么作用?
[课本P30]
第一节 化学能与热能
一、化学键与化学反应中能量变化的关系
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
1.化学反应的本质
H ·
+
→
H—H
Cl —Cl
H —Cl
化学键的断裂和形成是化学反应中能量变化的主要原因
2.化学反应中能量变化的主要原因
H ·
+
→
H—H
Cl —Cl
H —Cl
物质的化学反应与体系的能量变化是同时发生的
一个化学反应吸收能量还是释放能量
是由什么决定?
[思考]:
3.决定化学反应吸收能量还是放出能量的因素
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
在25℃,101KPa条件下,
断开1molH-H键要吸收436kJ的能量,
而由H原子形成1molH-H键要放出436kJ的能量,这个能量就是H-H的键能
共价键的键能
(1)微观
某些共价键的键能(kJ/mol)
键能越大→化学键越牢固→分子越稳定
共价键 键能 共价键 键能
H-H 436 C-H 415.0
Cl-Cl 247 O-H 462.8
Br-Br 193.7 N-H 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
已知 H-H : 键能为436kJ,
Cl-Cl : 键能为247kJ,
H-Cl : 键能为431kJ,
则反应 H2+Cl2=2HCl 是吸收能量还是释放能量?
(1)化学键断裂时要吸收能量,吸收的总能量为:
436kJ+247kJ=683kJ
(2)化学键形成时要释放能量,释放的总能量为:
431kJ×2=862 kJ
(3)反应中能量的变化——释放能量:
862kJ—683kJ=179kJ
[结论] 1、物质中的原子之间是通过 相结合的。化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。断键和成键都伴随着能量的变化。当物质发生反应时,断开反应物中的化学键要 能量,而形成生成物的化学键要 能量。
如:2H→H-H 436 kJ能量 H-H→2H 436 kJ能量
C-H→C+H 415kJ能量 CH4→C+4H 吸收 kJ能量
2、化学反应中能量变化的主要原因是: ,
断裂化学键要吸收能量,形成化学键要放出能量,物质的化学反应与体系的能量是 发生的。各个物质因为具有不同的组成、结构,所含 不同,反应时能量变化也就不同。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的________与生成物的________的相对大小
∑E(反应物)_______∑E(生成物)——放出能量
∑E(反应物)_______∑E(生成物)——吸收能量
即:Q=
(2)宏观:
水由高处向低处流释放能量
(势能转换为动能)
将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为
势能)
水能的变化
反应物的总能量<生成物的总能量
化学反应吸收能量
反应物的总能量>生成物的总能量
化学反应释放能量
化学能的变化
取决于反应物的总能量与生成物的总能量的相对大小
[结论] 1、物质中的原子之间是通过 相结合的。化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。断键和成键都伴随着能量的变化。当物质发生反应时,断开反应物中的化学键要 能量,而形成生成物的化学键要 能量。
如:2H→H-H 436 kJ能量 H-H→2H 436 kJ能量
C-H→C+H 415kJ能量 CH4→C+4H 吸收 kJ能量
2、化学反应中能量变化的主要原因是: ,
断裂化学键要吸收能量,形成化学键要放出能量,物质的化学反应与体系的能量是 发生的。各个物质因为具有不同的组成、结构,所含 不同,反应时能量变化也就不同。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的________与生成物的________的相对大小
∑E(反应物)_______∑E(生成物)——放出能量
∑E(反应物)_______∑E(生成物)——吸收能量
即:Q=
二、化学能与热能的相互转化
1.两条基本的自然定律
(1)质量守恒定律
(2)能量守恒定律
一种形式的能量可以转化为另一种形式
的能量,总能量保持不变
化学能是能量的一种形式,可以转化为其他
形式的能量,如热能和电能等
2.化学反应中的能量变化通常主要表现为热量的变化
——吸热或放热
放出热量的化学反应
吸收热量的化学反应
(1)放热反应:
(2)吸热反应:
[实验2-2] Ba(OH)2·8H2O 与 NH4Cl 的反应
[实验2-1] 铝片与盐酸的反应
该反应是放热反应
结 论
放出大量气泡,溶液温度升高
现 象
Ba(OH)2·8H2O与NH4Cl反应过程吸收热量,是吸热反应
有刺激性气味气体产生;玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉
结 论
现 象
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
常见的放热反应和吸热反应
放热反应
物质与氧气的反应
燃烧
中和反应
金属与酸反应
活泼金属与水的反应
生石灰和水反应
大部分化合反应
吸热反应
C+CO2
C+H2O
H2+CuO
Ba(OH)2·8H2O+NH4Cl
Fe+H2O(g)
Na2CO3·10H2O+NH4NO3
大部分分解反应
三、化学能的应用
1.化学能的应用
(1)利用热量进行生活、生产和科研
(2)利用热能使很多化学反应得以发生
(1)燃料充分燃烧
(2)减少污染
注意:
(3)人体内发生的氧化还原反应与体外的燃烧本质相同,
最终产物一样(都是二氧化碳和水),都是放热反应,
所放出的能量也相等,只是二者反应条件不同,所以生
物化学过程在利用“能源”上更为合理、有效。
2.社会发展与能源利用
3.人类利用能源的三个阶段
柴草时期→化石能源时期→多能源结构时期
1、物质发生化学反应的同时还伴随着能量的变化,而这种能量 变化又通常表现为热能变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
4、化学反应中能量转化遵循能量守衡原则。
【小结】
