人教高中化学 必修二 1.3.1 离子键PPT
文档属性
| 名称 | 人教高中化学 必修二 1.3.1 离子键PPT |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-06 13:17:10 | ||
图片预览








文档简介
离 子 键
(一)新课引入:
1、为什么物质的种类远远多于元素的种类?
2、分子、原子、离子是怎么构成物质的?
这些微粒之间到底存在怎样的相互作用?
要使氢分子分解成氢原子,需要加热到
2000℃,而且分解率还不够1%。
这说明氢分子里两个氢原子间存在着强烈
的相互作用
在水分子中
氧原子与氢原子直接相邻
氢原子与氢原子非直接相邻
相互作用比较强烈
相互作用比较弱
(H-O-H)
概念要点:
a. 相邻
b.原子之间
C.强烈作用
化学键——相邻的原子之间强烈的 相互作用
化学键主要类型:
a.离子键
b.共价键
(二)新课教学
c.金属键
演示实验:金属钠与氯气的反应钠与氯气的反应_
2Na + Cl2 == 2NaCl
思考:
这个反应的微观过程是怎么样的?
产物NaCl是怎么形成的?
点燃
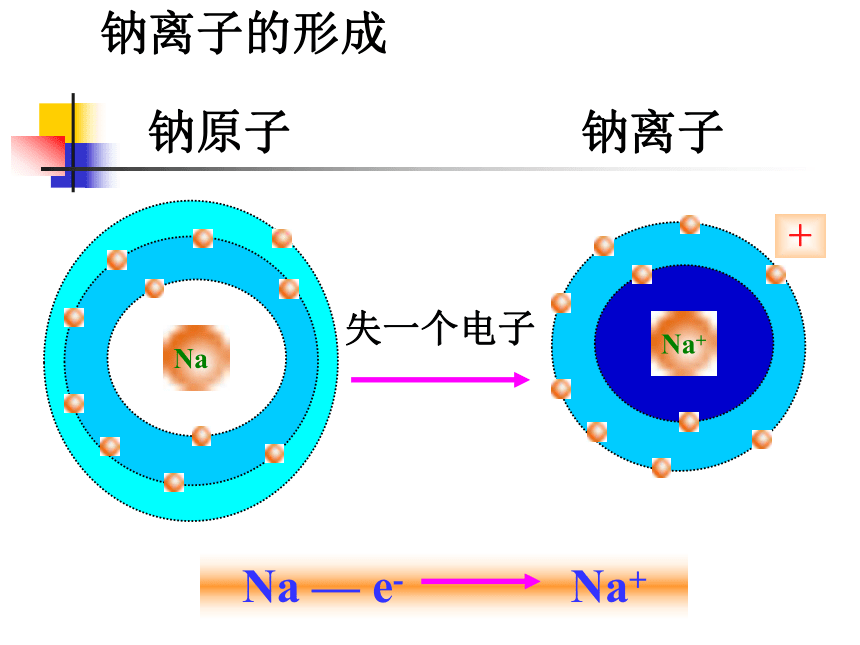
失一个电子
钠原子
钠离子
+
Na
Na+
钠离子的形成
氯离子的形成
得一个电子
氯原子
氯离子
-
3)氯化钠的形成
一、离子键
1. 概念:
阴阳离子间通过静电作用所形成的化学键
概念要点:
成键微粒 ——
阴阳离子
键的实质 ——
静电作用
成键本质 ——
得失电子
活泼金属元素(ⅠA, ⅡA)
活泼非金属元素(ⅤⅠA, ⅤⅡA)
2. 离子键的形成条件:
3.过渡并设问引出电子式:
如何形象地表示原子的最外层电子?
电子式:用“·”或“×”表示原子最外层电子
的式子。
a. 原子的电子式:
b. 阳离子的电子式:
c. 阴离子的电子式:
[ 练习1] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
铝原子 铝离子
Al3+
× Al ×
×
判断下列微粒电子式的正误,并从错误中归纳
总结出书写原子和阴阳离子的要点。
1.金属阳离子的电子式就是其离子符号;
2.非金属阴离子电子式要做到“二标”即标“[ ]”和“电荷数”。
书写要点:
d:离子化合物的电子式:
AB型
AB2型
A2B型
NaCl
Na2S
Na2O
MgCl2
注:阴、阳离子的电子式相间写,相同离子不能合并。
d:离子化合物的电子式:
d:离子化合物的电子式:
d:离子化合物的电子式:
1.相同的原子可以合并写,相同的离子要单个写;
2.不能把“→”写成“=”;?
3.用箭头标明电子转移方向。
4、用电子式表示离子化合物的形成过程
例:
书写要点:
⑴ 用电子式表示KBr 的形成过程
⑵ 用电子式表示 Na2O的形成过程
注:在箭头左边是原子的电子式,右边是离子化合物的电子式,相同原子的电子式可合并,但不建议,但离子化合物中相同离子不能合并。
[ 练习2]
(三)课堂小结
离子键:阴、阳离子间通过静电作用所形成的化学键.
例
例
化学键——相邻的原子之间强烈的 相互作用。
1.下列电子式有误的是 ( )
A.氯原子 ? Cl∶ B.硫离子∶S∶
C.溴离子 [∶Br∶]- D.钙离子Ca2+
2.下列化合物电子式书写正确的是( )
A.Ca2+[∶Cl∶]-2 B.Na+[∶S∶]2-Na+
C. [Mg2+][∶O∶]2- D. Na+ [∶F∶]-
随堂检测
( )
板书设计
化学键:相邻的原子之间强烈的相互作用,叫做化学键。
一、离子键
1、定义:阴、阳离子间通过静电作用所形成的化学键.
成键本质:得失电子
成键微粒:阴、阳离子
相互作用:静电作用(静电引力、斥力)
存在物质:离子化合物
2.离子键的形成条件:活泼金属元素与活泼非金属元素
3、电子式:在元素符号周围用“·”或“×”来表示原子最外层电子的式子。
a 原子
b 离子(阴、阳离子)
C 离子化合物的电子式:
AB型、A2B型、AB2型
d 用电子式表示离子化合物的形成过程
(一)新课引入:
1、为什么物质的种类远远多于元素的种类?
2、分子、原子、离子是怎么构成物质的?
这些微粒之间到底存在怎样的相互作用?
要使氢分子分解成氢原子,需要加热到
2000℃,而且分解率还不够1%。
这说明氢分子里两个氢原子间存在着强烈
的相互作用
在水分子中
氧原子与氢原子直接相邻
氢原子与氢原子非直接相邻
相互作用比较强烈
相互作用比较弱
(H-O-H)
概念要点:
a. 相邻
b.原子之间
C.强烈作用
化学键——相邻的原子之间强烈的 相互作用
化学键主要类型:
a.离子键
b.共价键
(二)新课教学
c.金属键
演示实验:金属钠与氯气的反应钠与氯气的反应_
2Na + Cl2 == 2NaCl
思考:
这个反应的微观过程是怎么样的?
产物NaCl是怎么形成的?
点燃
失一个电子
钠原子
钠离子
+
Na
Na+
钠离子的形成
氯离子的形成
得一个电子
氯原子
氯离子
-
3)氯化钠的形成
一、离子键
1. 概念:
阴阳离子间通过静电作用所形成的化学键
概念要点:
成键微粒 ——
阴阳离子
键的实质 ——
静电作用
成键本质 ——
得失电子
活泼金属元素(ⅠA, ⅡA)
活泼非金属元素(ⅤⅠA, ⅤⅡA)
2. 离子键的形成条件:
3.过渡并设问引出电子式:
如何形象地表示原子的最外层电子?
电子式:用“·”或“×”表示原子最外层电子
的式子。
a. 原子的电子式:
b. 阳离子的电子式:
c. 阴离子的电子式:
[ 练习1] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
铝原子 铝离子
Al3+
× Al ×
×
判断下列微粒电子式的正误,并从错误中归纳
总结出书写原子和阴阳离子的要点。
1.金属阳离子的电子式就是其离子符号;
2.非金属阴离子电子式要做到“二标”即标“[ ]”和“电荷数”。
书写要点:
d:离子化合物的电子式:
AB型
AB2型
A2B型
NaCl
Na2S
Na2O
MgCl2
注:阴、阳离子的电子式相间写,相同离子不能合并。
d:离子化合物的电子式:
d:离子化合物的电子式:
d:离子化合物的电子式:
1.相同的原子可以合并写,相同的离子要单个写;
2.不能把“→”写成“=”;?
3.用箭头标明电子转移方向。
4、用电子式表示离子化合物的形成过程
例:
书写要点:
⑴ 用电子式表示KBr 的形成过程
⑵ 用电子式表示 Na2O的形成过程
注:在箭头左边是原子的电子式,右边是离子化合物的电子式,相同原子的电子式可合并,但不建议,但离子化合物中相同离子不能合并。
[ 练习2]
(三)课堂小结
离子键:阴、阳离子间通过静电作用所形成的化学键.
例
例
化学键——相邻的原子之间强烈的 相互作用。
1.下列电子式有误的是 ( )
A.氯原子 ? Cl∶ B.硫离子∶S∶
C.溴离子 [∶Br∶]- D.钙离子Ca2+
2.下列化合物电子式书写正确的是( )
A.Ca2+[∶Cl∶]-2 B.Na+[∶S∶]2-Na+
C. [Mg2+][∶O∶]2- D. Na+ [∶F∶]-
随堂检测
( )
板书设计
化学键:相邻的原子之间强烈的相互作用,叫做化学键。
一、离子键
1、定义:阴、阳离子间通过静电作用所形成的化学键.
成键本质:得失电子
成键微粒:阴、阳离子
相互作用:静电作用(静电引力、斥力)
存在物质:离子化合物
2.离子键的形成条件:活泼金属元素与活泼非金属元素
3、电子式:在元素符号周围用“·”或“×”来表示原子最外层电子的式子。
a 原子
b 离子(阴、阳离子)
C 离子化合物的电子式:
AB型、A2B型、AB2型
d 用电子式表示离子化合物的形成过程
