人教版高中化学选修5课件:2.1 脂肪烃37张PPT
文档属性
| 名称 | 人教版高中化学选修5课件:2.1 脂肪烃37张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-07 19:17:18 | ||
图片预览










文档简介
课件37张PPT。第二章 烃和卤代烃
第一节 脂 肪 烃生活中常见的轮胎、PVC管材等都是以烃为主要原
料的产品,而脂肪烃是一类常见的烃。哪些有机物
属于脂肪烃?它们又有什么样的特性呢?1.了解烷烃、烯烃物理性质的变化与分子中碳原子数目的关系。
2.能掌握烷、烯、炔烃的结构与性质。(重点)
3.了解烷烃、烯烃的特征结构及烯烃的顺反异构。
4.了解乙炔的实验室制法。
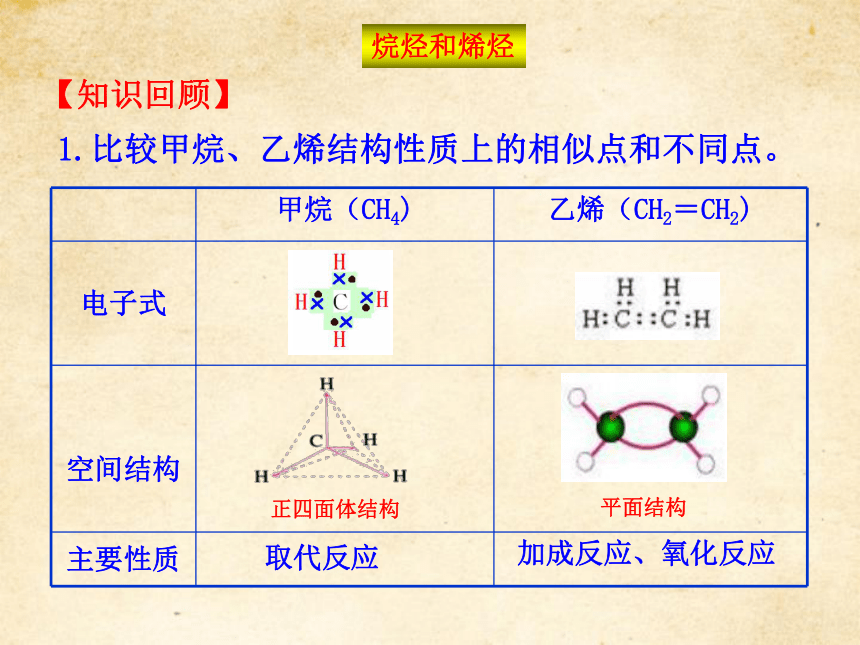
5.了解脂肪烃的重要应用及其来源。1.比较甲烷、乙烯结构性质上的相似点和不同点。正四面体结构平面结构取代反应加成反应、氧化反应【知识回顾】烷烃和烯烃2.什么是同系物?同系物的性质有什么规律?同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的物质。
由于同系物含有相同的官能团所以它们在化学性质上是相似的;由于所含碳原子数不同,所以在物理性质上存在递变规律。【小组讨论】烷烃和烯烃在结构上有什么不同点?在性质上有
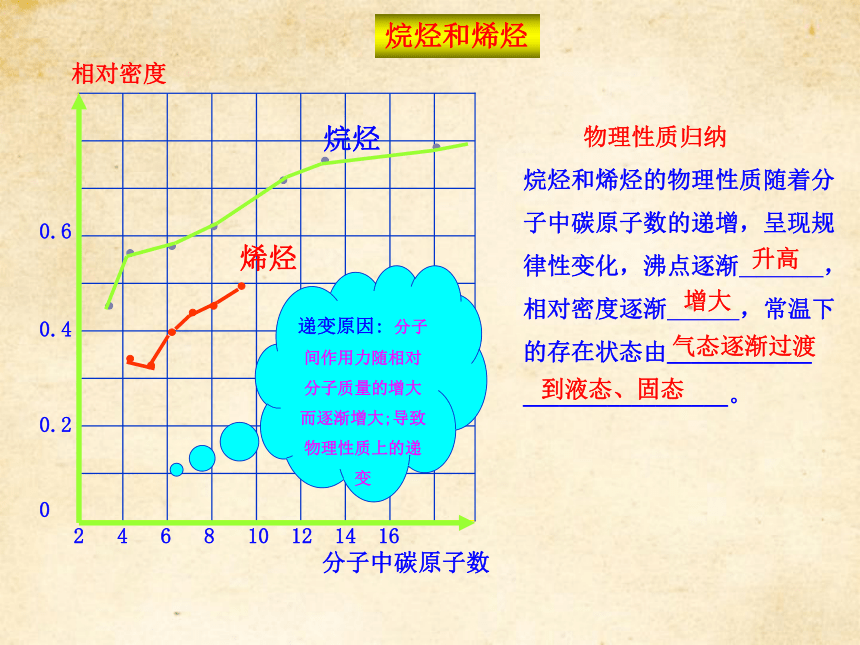
什么不同点?各自有什么规律?烷烃和烯烃【活动探究】 根据教材P28表2-1和表2-2中给出的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。【思考交流】根据做出的曲线图,你能得到什么信息?脂肪烃的物理性质递变规律烷烃和烯烃【归纳总结】同系物物理性质的递变规律烷烃和烯烃分子中碳原子数相对密度2 4 6 8 10 12 14 16 0.6
0.4
0.2
0烷烃烯烃递变原因: 分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变 物理性质归纳
烷烃和烯烃的物理性质随着分
子中碳原子数的递增,呈现规
律性变化,沸点逐渐 ,
相对密度逐渐 ,常温下
的存在状态由____________
_________________。 升高增大 气态逐渐过渡
到液态、固态烷烃和烯烃【即时巩固】下列有关烷烃的叙述中,正确的是( )
A. 烷烃的特征反应是取代反应
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫
色褪去
C.分子通式为CnH2n+2的烃不一定是烷烃
D.乙烷在光照条件下能与溴水发生取代反应A 烷烃(1)通式:CnH2n(n≥2)(2)物理性质随着分子中碳原子数的增多,烯烃同系物的物
理性质呈现规律性变化,即沸点逐渐升高,相
对密度逐渐增大。 烯烃烯烃(3)化学性质——与乙烯相似 ①加成反应(与H2、Br2、HX、H2O等):使溴水褪色,可用于检测烯烃②氧化反应a.燃烧:火焰明亮,冒黑烟b.催化氧化:c.与酸性高锰酸钾溶液反应,使酸性高锰酸钾溶液褪色 烯烃③加聚反应 由相对分子质量小的化合物分子互相结合成相
对分子质量大的高分子化合物的反应叫作聚合反应。
由不饱和的相对分子质量小的化合物分子结合
成相对分子质量大的化合物分子,这样的聚合反应
同时也是加成反应,所以这样的聚合反应又叫作加
聚反应。 烯烃【即时巩固】既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中
混有的乙烯的方法是( )
A.通入足量溴水中
B.与足量的液溴反应
C.通入高锰酸钾酸性溶液中
D.一定条件下与H2反应A【提示】除去甲烷中混有的乙烯不能用高锰酸钾酸
性溶液,因为乙烯会被高锰酸钾酸性溶液氧化生成
二氧化碳气体,而引入新杂质。 烯烃(1)通式: 1,3-丁二烯 CH2=CH-CH=CH2(2)代表物: CnH2n-2【归纳总结】二烯烃二烯烃比较丁烷和1,3-丁二烯的结构【问题探究】【思考交流】
烷烃和二烯烃的结构和化学性质有什么区别?①加成反应②加聚反应(3)化学性质: 二烯烃由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。(1)具有碳碳双键。(2)组成双键的每个碳原子必须连接两个不同的原子或原子团。即a′?b′,a?b,且a=a′、b=b′至少有一个存在。1.顺反异构2.顺反异构产生的条件【归纳总结】烯烃的顺反异构【思考交流】
什么是顺反异构?顺反异构产生的原因是什么?两个相同的原子或原子团在双键的同一侧时称为顺式异构。两个相同的原子或原子团在双键的两侧时称为反式异构。思考:互为顺反异构的物质在性质上有何关系?【提示】化学性质几乎相同,物理性质略有差异。3.顺式异构和反式异构烯烃的顺反异构下列物质中不存在顺反异构的是( )
A.1,2-二氯乙烯 B.1,2-二氯丙烯
C.2-甲基-2-丁烯 D.2-氯-2-丁烯 C 【特别提醒】
能否形成顺反异构要看两个方面,一看是否有双键;二看双键两端的基团是否相同。【即时巩固】烯烃的顺反异构分子里含有碳碳三键的一类脂肪烃称为炔烃。1.概念:2.炔烃的通式:CnH2n-2(n≥2)3.炔烃的通性:
(1)物理性质:随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加;碳原子数小于等于4时为气态。
(2)化学性质:能发生氧化反应、加成反应。炔烃炔烃乙炔(1)乙炔的分子结构:H—C≡C—H 结构简式:CH≡CH或HC≡CH结构式:直线型,键角180°空间结构:1.碳碳三键的键能并不是碳碳单键的三倍,也不是碳碳双键和碳碳单键之和。说明三键中有两个键不稳定,容易断裂,有一个键较稳定。
2.含有三键结构的相邻四原子在同一直线上。
3.链烃分子里含有碳碳三键的不饱和烃称为炔烃。
4.乙炔是最简单的炔烃。 炔烃分子式:
电子式: C2H2①氧化反应:a.可燃性:火焰明亮,并伴有浓烟b.乙炔能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液
褪色(2)乙炔的化学性质:炔烃 c.与HX等的反应:②加成反应a.使溴水褪色:b.催化加氢:CH≡CH+2Br2 CHBr2CHBr2CH≡CH+2H2 CH3CH3催化剂催化剂炔烃A.原料:CaC2与H2OCaC2 +2H—OH C2H2↑+Ca(OH)2
C.装置:
D.收集方法:
E.净化:B.反应原理: 乙炔的实验室制取【实验探究】 实验中采用块状
CaC2和饱和食盐水,
为什么?实验中为什么要采用分液漏斗?制出的乙炔气体为什么先通入硫酸铜溶液? 乙炔的实验室制取【特别提醒】
(1)反应装置不能用启普发生器,要改用圆底烧瓶
和分液漏斗。(2)实验中常用饱和食盐水代替水,目的是为了减
缓反应速率,得到平稳的乙炔气流。
(3)纯净的乙炔气体是无色无味的气体。用电石和
水反应制取的乙炔,常闻到恶臭气味,是因为不纯净的电石与水作用时生成H2S、ASH3、PH3等有特殊气味的杂质气体,因此用硫酸铜溶液除去。 乙炔的实验室制取下列关于乙炔的结构和性质的叙述中,既不同于乙烯,
也不同于乙烷的是( )
A.存在不饱和键
B.不易发生取代反应,易发生加成反应
C.分子中的所有原子都处在同一条直线上
D.能使酸性KMnO4溶液褪色C【即时巩固】炔烃脂肪烃的来源及其应用【思考交流】与同学交流分析原油的分馏及裂化的
产品和用途。 脂肪烃的来源有石油、天然气和煤等。
1. 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等;而减压分馏可以得到润滑油、石蜡等分子质量较大的烷烃;通过石油的催化及裂解可以得到较多的轻质油和气态烯烃,气态烯烃是最基本的化工原料;而催化重整是获得芳香烃的主要途径。 脂肪烃的来源及其应用脂肪烃的来源及其应用 2.天然气是高效清洁燃料,主要是烃类气体,以甲烷为主。
3.煤也是获得有机化合物的源泉。通过煤焦油的分馏可以获得各种芳香烃;通过煤的直接或间接液化,可以获得燃料油及多种化工原料。脂肪烃的来源及其应用烷烃
(碳碳单键)烯烃
(碳碳双键)炔烃
(碳碳三键)取代反应加成反应
加聚反应加氢加氢加氢1.(2018·全国卷Ⅱ)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
√2.欲制取较纯净的1,2-二氯乙烷,可采用的方法
是
A.乙烯和HCl加成
B.乙烯和氯气加成
C.乙烷和Cl2按1:2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的氯气在
光照条件下反应【提示】取代反应不能得到纯净的取代产物,故C、D不正确;乙烯和HCl加成,产物为一氯乙烷,故A不正确。√3.由乙烯推测丙烯的结构或性质正确的是
A.分子中3个碳原子在同一直线上
B.分子中所有原子在同一平面上
C.与氯化氢加成只生成一种产物
D.能使酸性KMnO4溶液褪色【提示】丙烯的结构简式为CH3CH=CH2,分子中3个碳原子在
同一平面上,但不在同一直线上,A错误;丙烯分子中的—CH3
中C与H并不共面,B错误;丙烯与HCl加成可生成CH3CH2CH2Cl或CH3CHClCH3,C错误;丙烯分子中含有双键,可使酸性KMnO4溶液褪色,D正确。√4.下列关于乙炔的描述中,不正确的是
A.乙炔是无色有特殊臭味的气体
B.不能用启普发生器制取乙炔气体
C.乙炔易与溴水发生加成反应
D.乙炔分子中所有原子都在同一直线上【提示】乙炔是一种无色、无味的气体,实验室制
得的乙炔因混有H2S和PH3而具有特殊的臭味;乙炔
为直线型分子,其分子中所有原子处于同一直线上。√5.下列叙述中,不正确的是
A.天然气是以甲烷为主要成分的高效清洁燃料
B.煤的干馏可得到煤焦油,通过煤焦油的分馏可
获得各种芳香烃
C.石油中含有烷烃和环烷烃,因此由石油不可能
获得芳香烃
D.通过石油的催化裂化及裂解可以得到轻质油和
气态烯烃√一种美好的心情,比十副良药更能解除生理上的疲惫和痛楚。 ——马克思
第一节 脂 肪 烃生活中常见的轮胎、PVC管材等都是以烃为主要原
料的产品,而脂肪烃是一类常见的烃。哪些有机物
属于脂肪烃?它们又有什么样的特性呢?1.了解烷烃、烯烃物理性质的变化与分子中碳原子数目的关系。
2.能掌握烷、烯、炔烃的结构与性质。(重点)
3.了解烷烃、烯烃的特征结构及烯烃的顺反异构。
4.了解乙炔的实验室制法。
5.了解脂肪烃的重要应用及其来源。1.比较甲烷、乙烯结构性质上的相似点和不同点。正四面体结构平面结构取代反应加成反应、氧化反应【知识回顾】烷烃和烯烃2.什么是同系物?同系物的性质有什么规律?同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的物质。
由于同系物含有相同的官能团所以它们在化学性质上是相似的;由于所含碳原子数不同,所以在物理性质上存在递变规律。【小组讨论】烷烃和烯烃在结构上有什么不同点?在性质上有
什么不同点?各自有什么规律?烷烃和烯烃【活动探究】 根据教材P28表2-1和表2-2中给出的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。【思考交流】根据做出的曲线图,你能得到什么信息?脂肪烃的物理性质递变规律烷烃和烯烃【归纳总结】同系物物理性质的递变规律烷烃和烯烃分子中碳原子数相对密度2 4 6 8 10 12 14 16 0.6
0.4
0.2
0烷烃烯烃递变原因: 分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变 物理性质归纳
烷烃和烯烃的物理性质随着分
子中碳原子数的递增,呈现规
律性变化,沸点逐渐 ,
相对密度逐渐 ,常温下
的存在状态由____________
_________________。 升高增大 气态逐渐过渡
到液态、固态烷烃和烯烃【即时巩固】下列有关烷烃的叙述中,正确的是( )
A. 烷烃的特征反应是取代反应
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫
色褪去
C.分子通式为CnH2n+2的烃不一定是烷烃
D.乙烷在光照条件下能与溴水发生取代反应A 烷烃(1)通式:CnH2n(n≥2)(2)物理性质随着分子中碳原子数的增多,烯烃同系物的物
理性质呈现规律性变化,即沸点逐渐升高,相
对密度逐渐增大。 烯烃烯烃(3)化学性质——与乙烯相似 ①加成反应(与H2、Br2、HX、H2O等):使溴水褪色,可用于检测烯烃②氧化反应a.燃烧:火焰明亮,冒黑烟b.催化氧化:c.与酸性高锰酸钾溶液反应,使酸性高锰酸钾溶液褪色 烯烃③加聚反应 由相对分子质量小的化合物分子互相结合成相
对分子质量大的高分子化合物的反应叫作聚合反应。
由不饱和的相对分子质量小的化合物分子结合
成相对分子质量大的化合物分子,这样的聚合反应
同时也是加成反应,所以这样的聚合反应又叫作加
聚反应。 烯烃【即时巩固】既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中
混有的乙烯的方法是( )
A.通入足量溴水中
B.与足量的液溴反应
C.通入高锰酸钾酸性溶液中
D.一定条件下与H2反应A【提示】除去甲烷中混有的乙烯不能用高锰酸钾酸
性溶液,因为乙烯会被高锰酸钾酸性溶液氧化生成
二氧化碳气体,而引入新杂质。 烯烃(1)通式: 1,3-丁二烯 CH2=CH-CH=CH2(2)代表物: CnH2n-2【归纳总结】二烯烃二烯烃比较丁烷和1,3-丁二烯的结构【问题探究】【思考交流】
烷烃和二烯烃的结构和化学性质有什么区别?①加成反应②加聚反应(3)化学性质: 二烯烃由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。(1)具有碳碳双键。(2)组成双键的每个碳原子必须连接两个不同的原子或原子团。即a′?b′,a?b,且a=a′、b=b′至少有一个存在。1.顺反异构2.顺反异构产生的条件【归纳总结】烯烃的顺反异构【思考交流】
什么是顺反异构?顺反异构产生的原因是什么?两个相同的原子或原子团在双键的同一侧时称为顺式异构。两个相同的原子或原子团在双键的两侧时称为反式异构。思考:互为顺反异构的物质在性质上有何关系?【提示】化学性质几乎相同,物理性质略有差异。3.顺式异构和反式异构烯烃的顺反异构下列物质中不存在顺反异构的是( )
A.1,2-二氯乙烯 B.1,2-二氯丙烯
C.2-甲基-2-丁烯 D.2-氯-2-丁烯 C 【特别提醒】
能否形成顺反异构要看两个方面,一看是否有双键;二看双键两端的基团是否相同。【即时巩固】烯烃的顺反异构分子里含有碳碳三键的一类脂肪烃称为炔烃。1.概念:2.炔烃的通式:CnH2n-2(n≥2)3.炔烃的通性:
(1)物理性质:随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加;碳原子数小于等于4时为气态。
(2)化学性质:能发生氧化反应、加成反应。炔烃炔烃乙炔(1)乙炔的分子结构:H—C≡C—H 结构简式:CH≡CH或HC≡CH结构式:直线型,键角180°空间结构:1.碳碳三键的键能并不是碳碳单键的三倍,也不是碳碳双键和碳碳单键之和。说明三键中有两个键不稳定,容易断裂,有一个键较稳定。
2.含有三键结构的相邻四原子在同一直线上。
3.链烃分子里含有碳碳三键的不饱和烃称为炔烃。
4.乙炔是最简单的炔烃。 炔烃分子式:
电子式: C2H2①氧化反应:a.可燃性:火焰明亮,并伴有浓烟b.乙炔能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液
褪色(2)乙炔的化学性质:炔烃 c.与HX等的反应:②加成反应a.使溴水褪色:b.催化加氢:CH≡CH+2Br2 CHBr2CHBr2CH≡CH+2H2 CH3CH3催化剂催化剂炔烃A.原料:CaC2与H2OCaC2 +2H—OH C2H2↑+Ca(OH)2
C.装置:
D.收集方法:
E.净化:B.反应原理: 乙炔的实验室制取【实验探究】 实验中采用块状
CaC2和饱和食盐水,
为什么?实验中为什么要采用分液漏斗?制出的乙炔气体为什么先通入硫酸铜溶液? 乙炔的实验室制取【特别提醒】
(1)反应装置不能用启普发生器,要改用圆底烧瓶
和分液漏斗。(2)实验中常用饱和食盐水代替水,目的是为了减
缓反应速率,得到平稳的乙炔气流。
(3)纯净的乙炔气体是无色无味的气体。用电石和
水反应制取的乙炔,常闻到恶臭气味,是因为不纯净的电石与水作用时生成H2S、ASH3、PH3等有特殊气味的杂质气体,因此用硫酸铜溶液除去。 乙炔的实验室制取下列关于乙炔的结构和性质的叙述中,既不同于乙烯,
也不同于乙烷的是( )
A.存在不饱和键
B.不易发生取代反应,易发生加成反应
C.分子中的所有原子都处在同一条直线上
D.能使酸性KMnO4溶液褪色C【即时巩固】炔烃脂肪烃的来源及其应用【思考交流】与同学交流分析原油的分馏及裂化的
产品和用途。 脂肪烃的来源有石油、天然气和煤等。
1. 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等;而减压分馏可以得到润滑油、石蜡等分子质量较大的烷烃;通过石油的催化及裂解可以得到较多的轻质油和气态烯烃,气态烯烃是最基本的化工原料;而催化重整是获得芳香烃的主要途径。 脂肪烃的来源及其应用脂肪烃的来源及其应用 2.天然气是高效清洁燃料,主要是烃类气体,以甲烷为主。
3.煤也是获得有机化合物的源泉。通过煤焦油的分馏可以获得各种芳香烃;通过煤的直接或间接液化,可以获得燃料油及多种化工原料。脂肪烃的来源及其应用烷烃
(碳碳单键)烯烃
(碳碳双键)炔烃
(碳碳三键)取代反应加成反应
加聚反应加氢加氢加氢1.(2018·全国卷Ⅱ)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
√2.欲制取较纯净的1,2-二氯乙烷,可采用的方法
是
A.乙烯和HCl加成
B.乙烯和氯气加成
C.乙烷和Cl2按1:2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的氯气在
光照条件下反应【提示】取代反应不能得到纯净的取代产物,故C、D不正确;乙烯和HCl加成,产物为一氯乙烷,故A不正确。√3.由乙烯推测丙烯的结构或性质正确的是
A.分子中3个碳原子在同一直线上
B.分子中所有原子在同一平面上
C.与氯化氢加成只生成一种产物
D.能使酸性KMnO4溶液褪色【提示】丙烯的结构简式为CH3CH=CH2,分子中3个碳原子在
同一平面上,但不在同一直线上,A错误;丙烯分子中的—CH3
中C与H并不共面,B错误;丙烯与HCl加成可生成CH3CH2CH2Cl或CH3CHClCH3,C错误;丙烯分子中含有双键,可使酸性KMnO4溶液褪色,D正确。√4.下列关于乙炔的描述中,不正确的是
A.乙炔是无色有特殊臭味的气体
B.不能用启普发生器制取乙炔气体
C.乙炔易与溴水发生加成反应
D.乙炔分子中所有原子都在同一直线上【提示】乙炔是一种无色、无味的气体,实验室制
得的乙炔因混有H2S和PH3而具有特殊的臭味;乙炔
为直线型分子,其分子中所有原子处于同一直线上。√5.下列叙述中,不正确的是
A.天然气是以甲烷为主要成分的高效清洁燃料
B.煤的干馏可得到煤焦油,通过煤焦油的分馏可
获得各种芳香烃
C.石油中含有烷烃和环烷烃,因此由石油不可能
获得芳香烃
D.通过石油的催化裂化及裂解可以得到轻质油和
气态烯烃√一种美好的心情,比十副良药更能解除生理上的疲惫和痛楚。 ——马克思
