2.2.2 发展中的化学电源 课件
文档属性
| 名称 | 2.2.2 发展中的化学电源 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-11 00:00:00 | ||
图片预览







文档简介
第二章 化学反应与能量
化学
必修2
第二课时
第二节 化学能与电能
发展中的
化学电源
人教版 必修二
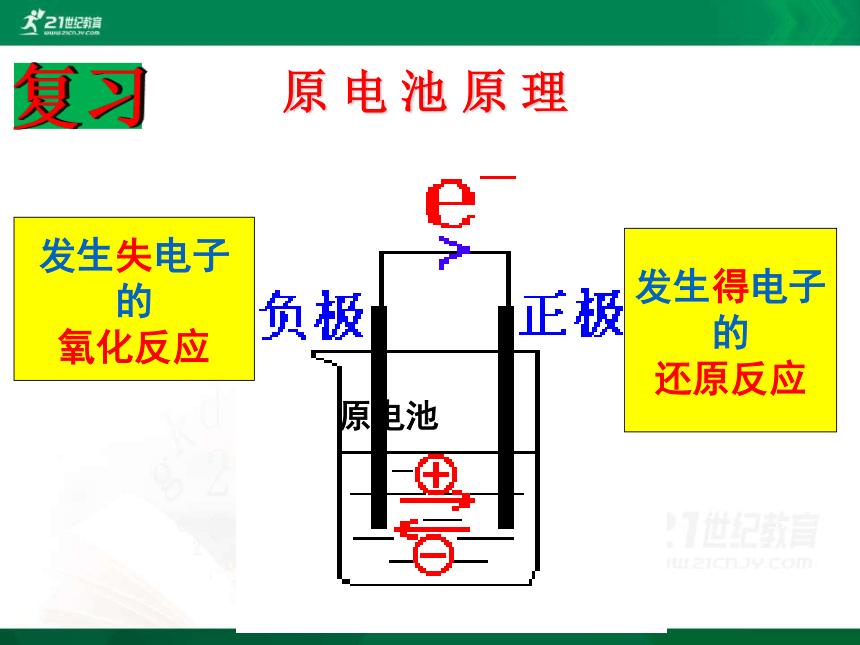
原电池
发生失电子
的
氧化反应
发生得电子
的
还原反应
原 电 池 原 理
复习
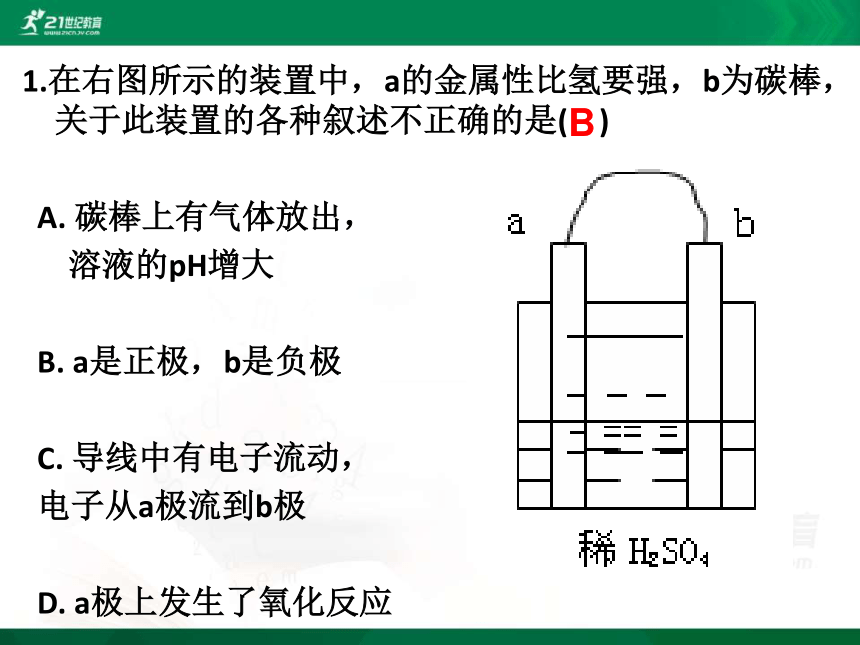
1.在右图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
A. 碳棒上有气体放出,
溶液的pH增大
B. a是正极,b是负极
C. 导线中有电子流动,
电子从a极流到b极
D. a极上发生了氧化反应
B
问:课本中对化学电池如何分类?举出各类电池的具体电池名称。
化学电池
的分类:
干电池
充电电池
燃料电池
锌锰电池、碱性锌锰电池
铅蓄电池、镍镉电池、锂电池
氢氧燃料电池、甲烷燃料电池
一、发展中的化学电源
二、常见的化学电池
1、干电池
干电池是一种伏打电池,利用某种吸收剂(如木屑或明胶)使内含物成为不会外溢的糊状。常用作手电筒照明、收音机等的电源。
酸性锌锰干电池是最早进入市场的实用电池
(1)普通锌锰干电池
优点:制作简单、价格便宜。
缺点:放电时间短,电压下降快。
1.干电池(一次性电池)
电极:Zn为负极,碳棒为正极
电解液:NH4Cl
电极方程式:
负极(Zn):Zn-2e-=Zn2+
正极(C):2MnO2 + 2NH4+ + 2e-= Mn2O3+2NH3+H2O
(1)锌锰干电池(使用寿命短,易泄露)
电池反应: Zn+ 2MnO2+2NH4+= Zn2+ + Mn2O3+2NH3↑+ H2O
锌-锰干电池在使用过程中,锌会逐渐溶解,
锌外壳变薄,最后内部的糊状电解质泄露出来,对
电器腐蚀。
为了防止泄露,在外壳套上金属筒或塑料筒,制成防漏电池。
为了延长电池寿命和提高其性能,人们将电池内的电解质 换成湿的 ,制成了 电池。
P42【思考与交流】
为什么锌锰干电池放置过久会失效?
NH4Cl
KOH
碱性锌锰
负极:Zn +OH- – 2e- == Zn(OH)2
(2)碱性干电池
碱性电池是个人音响、照相机等地首选电源。
碱性电池
电解液:酸性 NH4Cl→碱性KOH(离子导电性更好)
负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)
优点:能量储存时间有所提高,不易泄露
负极(Zn):Zn-2e-+2OH- = Zn(OH)2
正极(C):
2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH-
电解液:KOH
总反应:
Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
一次电池用过之后不能复原,因为一次电池中的氧化还原反应是不可逆的,放完电之后就不能再使用。
二次电池充电后能继续使用,二次电池中的氧化还原反应是可逆的,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使生成物恢复原状。
一次电池和二次电池用何区别?原因何在?P43
2、充电电池(二次电池能够重复使用)
充电电池:氧化还原反应在充电时可以逆向进行。
手机专用电池
摄像机专用电池
笔记本电脑专用电池
化学能
放电
充电
电能
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
铅蓄电池:最早使用的充电电池。
(1)铅蓄电池
特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。
铅蓄电池
铅蓄电池:
放电时:
正极材料:
负极材料 :
电解液:
PbO2
Pb
H2SO4
负极:
正极:
总反应:
Pb + SO42-—2e-=PbSO4
PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
(2)镍镉充电电池:
负极:
正极:
电解质:
优缺点:
应用:
Cd
NiO(OH)
KOH
具有残留性记忆,可重复使用500次以上,体积小;但镉有致癌作用,如不回收,会产生严重污染
广泛用于收录机、无线对讲机、电子闪光灯、
电动剃须刀等
镍
镉
电
池
镉有致癌作用,有被镍氢电池取代的趋势。
(3)锂离子电池
锂离子电池是新一代可充电的绿色电池。
特点:高能电池,电压高,质量轻,贮存时间长等。
用途:现已成为笔记本电脑、移动电话、摄像机、手表、心脏起搏器等低功耗电器的主流。
笔记本电脑专用电池
锂电池(有机溶剂电解液)
负极:Li - e- = Li+
正极:其他导体
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
废旧电池的回收利用
(3)燃料电池——高效、环境友好的化学电池
它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,
活性炭电极等。
(例如:H2和O2的燃料电池,CH4和O2的燃料电池)
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。
小型高性能燃料电池
氢氧燃料电池工作原理:
总反应:2H2 + O2 =2H2 O
通入的气体在电极表面放电,电池只是作为一个反应器。
与其它电池区别:反应物不是储存在电池内。
用途:氢氧燃料电池目前已应用于航天、军事通讯、
电视中继站等领域
燃料电池
H2
O2
负极H2:
H2-2e- =2H+
正极O2:
O2+2H2O +4e- =4OH-
总反应: O2+2H2 =2H2 O
H+
OH-
H2O
2H2 - 4e- = 4H+
O2 + 4e- + 2H2O = 4OH-
2H2 - 4e- = 4H+
O2 + 4e- + 4H+ = 4H2O
2H2 - 4e- +4OH- = 4H2O
O2 + 4e- + 2H2O = 4OH-
*氢氧燃料电池的电极反应
一定要会判断:酸性有H+ (肯定没OH- );
碱性有OH- (肯定没 H+ )
⑵甲烷氧气燃料电池
该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4+10OH- -8e- = CO32- + 7H2O
2O2+4H2O+8e-= 8OH-
CH4+ 2O2+2KOH =K2CO3 +3H2O
第二节 化学能与电能
1.电极反应式的书写 (见优化设计)
(1)负极反应式的书写
①活泼金属作负极时,电极本身被氧化:
若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,
如:Zn-2e-===Zn2+,Cu-2e-===Cu2+。
若生成的金属阳离子与电解质溶液反应,其电极反应式为两反应合并后的反应式.
如:Mg-Al(KOH)原电池,
负极反应式为:Al-3e-+4OH-==AlO2—+2H2O;铅蓄电池负极反应式:Pb-2e- +SO42—==PbSO4。
二、电极反应式、原电池反应式的书写
第二节 化学能与电能
(2)正极反应式的书写
①首先判断在正极发生反应的物质。
a. 当负极材料与电解质溶液能发生自发的化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种粒子;
b. 当负极材料与电解质溶液不能发生自发的化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。
②负极本身不反应时,常见书写方法为:
氢氧(酸性)燃料电池,负极反应式为:
H2-2e-===2H+
氢氧(碱性)燃料电池,负极反应式为:
H2-2e-+2OH-=2H2O
第二节 化学能与电能
2.原电池反应式的书写
两电极反应式,得失电子数相等时,将两电极反应式相加即得原电池反应式。
②然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若反应也要书写叠加式。
如:氢氧(酸性)燃料电池,正极反应式为:
O2+4e-+4H+===2H2O
氢氧(碱性)燃料电池,正极反应式为:
O2+4e-+2H2O===4OH-
化学能与电能
一、发展中的化学电源
一次性电池——干电池
二次电池(充电电池)
燃料电池
普通锌锰电池
碱性锌锰电池
铅蓄电池
镍镉充电电池
锂电池
氢氧燃料
CH4燃料电池
小结
1.下列电池中不属于二次电池的( )
A.碱性锌锰电池 B.铅蓄电池
C.镍镉电池 D.锂离子电池
A
课堂练习
2.下列化学电池不易造成环境污染的是
A.氢氧燃料电池 B.锌锰电池
C.镍镉电池 D.铅蓄电池
A
3.阿波罗宇宙飞船使用的是氢氧燃料电池,其电极反应为:
2H2+4 OH- → 4 H2O+4e-,
O2+2 H2O+4e- → 4 OH-。
在负极上发生反应的物质是 正极发生的是 . (填氧化或还原)反应.
H2
还原
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
化学
必修2
第二课时
第二节 化学能与电能
发展中的
化学电源
人教版 必修二
原电池
发生失电子
的
氧化反应
发生得电子
的
还原反应
原 电 池 原 理
复习
1.在右图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
A. 碳棒上有气体放出,
溶液的pH增大
B. a是正极,b是负极
C. 导线中有电子流动,
电子从a极流到b极
D. a极上发生了氧化反应
B
问:课本中对化学电池如何分类?举出各类电池的具体电池名称。
化学电池
的分类:
干电池
充电电池
燃料电池
锌锰电池、碱性锌锰电池
铅蓄电池、镍镉电池、锂电池
氢氧燃料电池、甲烷燃料电池
一、发展中的化学电源
二、常见的化学电池
1、干电池
干电池是一种伏打电池,利用某种吸收剂(如木屑或明胶)使内含物成为不会外溢的糊状。常用作手电筒照明、收音机等的电源。
酸性锌锰干电池是最早进入市场的实用电池
(1)普通锌锰干电池
优点:制作简单、价格便宜。
缺点:放电时间短,电压下降快。
1.干电池(一次性电池)
电极:Zn为负极,碳棒为正极
电解液:NH4Cl
电极方程式:
负极(Zn):Zn-2e-=Zn2+
正极(C):2MnO2 + 2NH4+ + 2e-= Mn2O3+2NH3+H2O
(1)锌锰干电池(使用寿命短,易泄露)
电池反应: Zn+ 2MnO2+2NH4+= Zn2+ + Mn2O3+2NH3↑+ H2O
锌-锰干电池在使用过程中,锌会逐渐溶解,
锌外壳变薄,最后内部的糊状电解质泄露出来,对
电器腐蚀。
为了防止泄露,在外壳套上金属筒或塑料筒,制成防漏电池。
为了延长电池寿命和提高其性能,人们将电池内的电解质 换成湿的 ,制成了 电池。
P42【思考与交流】
为什么锌锰干电池放置过久会失效?
NH4Cl
KOH
碱性锌锰
负极:Zn +OH- – 2e- == Zn(OH)2
(2)碱性干电池
碱性电池是个人音响、照相机等地首选电源。
碱性电池
电解液:酸性 NH4Cl→碱性KOH(离子导电性更好)
负极:锌片→锌粉(反应面积成倍增长,使放电电流大幅度提高)
优点:能量储存时间有所提高,不易泄露
负极(Zn):Zn-2e-+2OH- = Zn(OH)2
正极(C):
2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH-
电解液:KOH
总反应:
Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
一次电池用过之后不能复原,因为一次电池中的氧化还原反应是不可逆的,放完电之后就不能再使用。
二次电池充电后能继续使用,二次电池中的氧化还原反应是可逆的,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使生成物恢复原状。
一次电池和二次电池用何区别?原因何在?P43
2、充电电池(二次电池能够重复使用)
充电电池:氧化还原反应在充电时可以逆向进行。
手机专用电池
摄像机专用电池
笔记本电脑专用电池
化学能
放电
充电
电能
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还广泛用于国防、生产、生活等领域。
铅蓄电池:最早使用的充电电池。
(1)铅蓄电池
特点:铅蓄电池的电压稳定,使用方便安全可靠,可再次充电使用。
铅蓄电池
铅蓄电池:
放电时:
正极材料:
负极材料 :
电解液:
PbO2
Pb
H2SO4
负极:
正极:
总反应:
Pb + SO42-—2e-=PbSO4
PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
(2)镍镉充电电池:
负极:
正极:
电解质:
优缺点:
应用:
Cd
NiO(OH)
KOH
具有残留性记忆,可重复使用500次以上,体积小;但镉有致癌作用,如不回收,会产生严重污染
广泛用于收录机、无线对讲机、电子闪光灯、
电动剃须刀等
镍
镉
电
池
镉有致癌作用,有被镍氢电池取代的趋势。
(3)锂离子电池
锂离子电池是新一代可充电的绿色电池。
特点:高能电池,电压高,质量轻,贮存时间长等。
用途:现已成为笔记本电脑、移动电话、摄像机、手表、心脏起搏器等低功耗电器的主流。
笔记本电脑专用电池
锂电池(有机溶剂电解液)
负极:Li - e- = Li+
正极:其他导体
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
废旧电池的回收利用
(3)燃料电池——高效、环境友好的化学电池
它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,
活性炭电极等。
(例如:H2和O2的燃料电池,CH4和O2的燃料电池)
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。
小型高性能燃料电池
氢氧燃料电池工作原理:
总反应:2H2 + O2 =2H2 O
通入的气体在电极表面放电,电池只是作为一个反应器。
与其它电池区别:反应物不是储存在电池内。
用途:氢氧燃料电池目前已应用于航天、军事通讯、
电视中继站等领域
燃料电池
H2
O2
负极H2:
H2-2e- =2H+
正极O2:
O2+2H2O +4e- =4OH-
总反应: O2+2H2 =2H2 O
H+
OH-
H2O
2H2 - 4e- = 4H+
O2 + 4e- + 2H2O = 4OH-
2H2 - 4e- = 4H+
O2 + 4e- + 4H+ = 4H2O
2H2 - 4e- +4OH- = 4H2O
O2 + 4e- + 2H2O = 4OH-
*氢氧燃料电池的电极反应
一定要会判断:酸性有H+ (肯定没OH- );
碱性有OH- (肯定没 H+ )
⑵甲烷氧气燃料电池
该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4+10OH- -8e- = CO32- + 7H2O
2O2+4H2O+8e-= 8OH-
CH4+ 2O2+2KOH =K2CO3 +3H2O
第二节 化学能与电能
1.电极反应式的书写 (见优化设计)
(1)负极反应式的书写
①活泼金属作负极时,电极本身被氧化:
若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,
如:Zn-2e-===Zn2+,Cu-2e-===Cu2+。
若生成的金属阳离子与电解质溶液反应,其电极反应式为两反应合并后的反应式.
如:Mg-Al(KOH)原电池,
负极反应式为:Al-3e-+4OH-==AlO2—+2H2O;铅蓄电池负极反应式:Pb-2e- +SO42—==PbSO4。
二、电极反应式、原电池反应式的书写
第二节 化学能与电能
(2)正极反应式的书写
①首先判断在正极发生反应的物质。
a. 当负极材料与电解质溶液能发生自发的化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种粒子;
b. 当负极材料与电解质溶液不能发生自发的化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。
②负极本身不反应时,常见书写方法为:
氢氧(酸性)燃料电池,负极反应式为:
H2-2e-===2H+
氢氧(碱性)燃料电池,负极反应式为:
H2-2e-+2OH-=2H2O
第二节 化学能与电能
2.原电池反应式的书写
两电极反应式,得失电子数相等时,将两电极反应式相加即得原电池反应式。
②然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若反应也要书写叠加式。
如:氢氧(酸性)燃料电池,正极反应式为:
O2+4e-+4H+===2H2O
氢氧(碱性)燃料电池,正极反应式为:
O2+4e-+2H2O===4OH-
化学能与电能
一、发展中的化学电源
一次性电池——干电池
二次电池(充电电池)
燃料电池
普通锌锰电池
碱性锌锰电池
铅蓄电池
镍镉充电电池
锂电池
氢氧燃料
CH4燃料电池
小结
1.下列电池中不属于二次电池的( )
A.碱性锌锰电池 B.铅蓄电池
C.镍镉电池 D.锂离子电池
A
课堂练习
2.下列化学电池不易造成环境污染的是
A.氢氧燃料电池 B.锌锰电池
C.镍镉电池 D.铅蓄电池
A
3.阿波罗宇宙飞船使用的是氢氧燃料电池,其电极反应为:
2H2+4 OH- → 4 H2O+4e-,
O2+2 H2O+4e- → 4 OH-。
在负极上发生反应的物质是 正极发生的是 . (填氧化或还原)反应.
H2
还原
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
