第7章 第1节 物体是由大量分子组成的(35张ppt)
文档属性
| 名称 | 第7章 第1节 物体是由大量分子组成的(35张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 267.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2019-04-10 21:05:42 | ||
图片预览









文档简介
课件35张PPT。物体是由大量分子组成的第七章《分子动理论》1、怎样才能观察到分子的排布? 2、怎样才能知道分子的大小呢? 3、如何求解单分子油膜层的厚度(即分子直径)呢? 阅读课文,回答以下问题: 组成物质的分子是很小的,不但用肉眼不能直接看到它们,就是用扫描隧道显微镜也看不到它们(能有放大几亿倍) 。 我国科学家用扫描隧道显微镜拍摄的石墨表面原子的排布图,图中的每个亮斑都是一个碳原子. 、怎样才能观察到分子的排布? 问题:1放大上亿倍的蛋白质分子结构模型问题:2.怎样才能知道分子的大小呢?2.具体做法是:
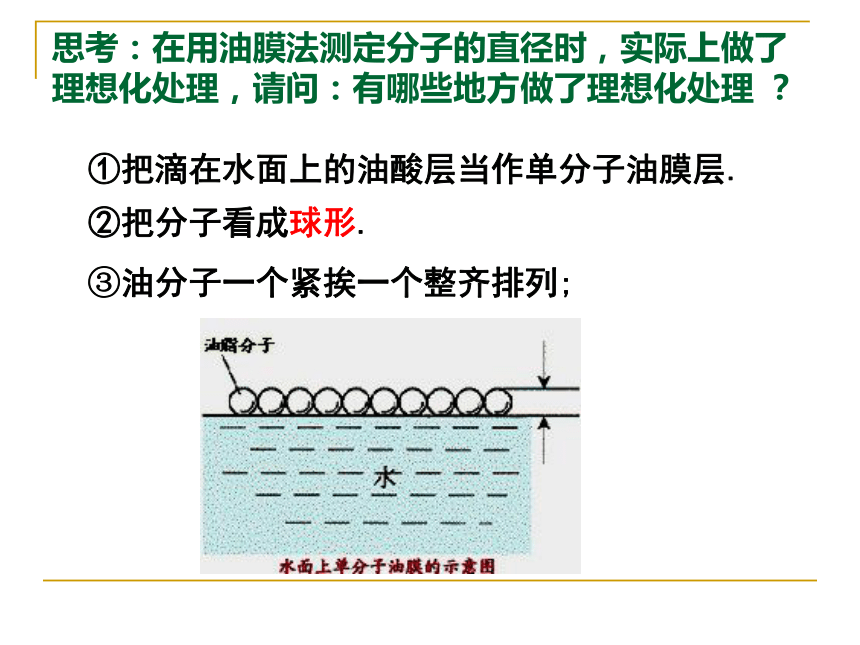
把一滴油酸滴到水面上,油酸在水面上散开形成单分子油膜,如果把分子看成球形,单分子油膜的厚度就可认为等于油膜分子的直径.1.有一种粗略测定分子大小的方法叫油膜法.问题:3.如何求解单分子油膜层的厚度(即分子直径)呢? 1.先测出一滴油酸的体积V: 2.测出水面上漂浮的油膜的表面积S; 3.单分子油膜的厚度等于油滴体积V与油膜面积S的比值:方法小结:通过测量较大量来研究较小量。思考:在用油膜法测定分子的直径时,实际上做了理想化处理,请问:有哪些地方做了理想化处理 ?
②把分子看成球形. ①把滴在水面上的油酸层当作单分子油膜层.③油分子一个紧挨一个整齐排列;请详细叙述用油膜法估测分子的大小操作步骤1.配制溶液(稀释)配
2.精测一滴液体体积
3.水盘取水,撒痱子粉(显示油膜边界)撒
4.滴一滴溶液形成单层表面薄膜 滴
5.描油膜形状 描
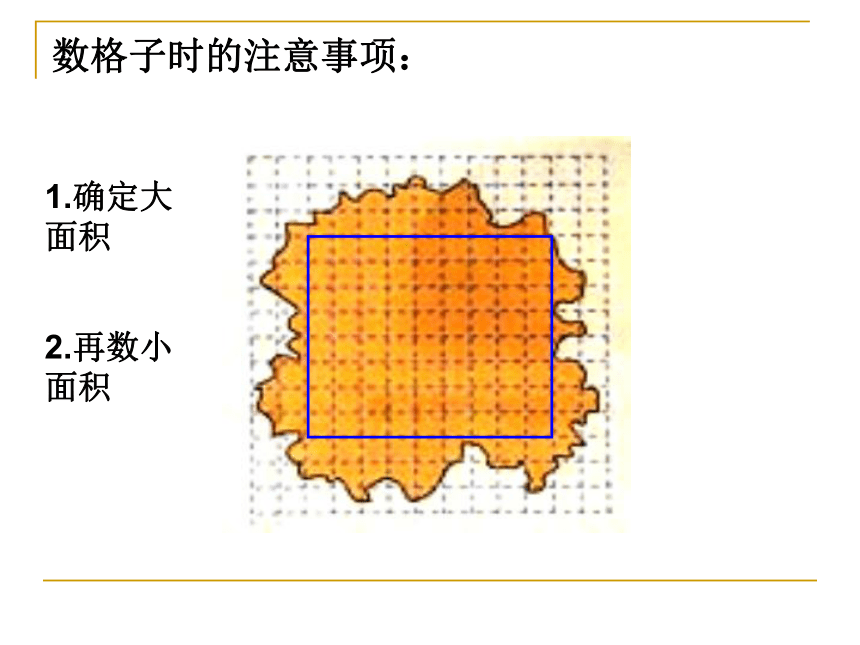
6.数格数,计算油膜面积 数
7.求分子直径 求数格子时的注意事项:1.确定大面积2.再数小面积例1、将1cm3油酸溶于酒精,制成200cm3的油酸酒精溶液,已知1cm3溶液有50滴,现取1滴油酸酒精溶液滴到水面上,随着酒精溶于水,油酸在水面上形成一单分子薄层,已测出这一薄层的面积为0.2m2,由此可估测油酸分子直径是多少? 1滴油酸酒精的体积为1/50cm3
其中含油酸体积为10-10m3
油酸膜的厚度为5×10-10m一些数据太大或很小,为了书写方便,习惯上用科学记数法写成10的乘方数,如 3×10-10m。我们把10的乘方数叫做数量级, 1×10-10m和 9×10-10m,数量级都是 10-10m。
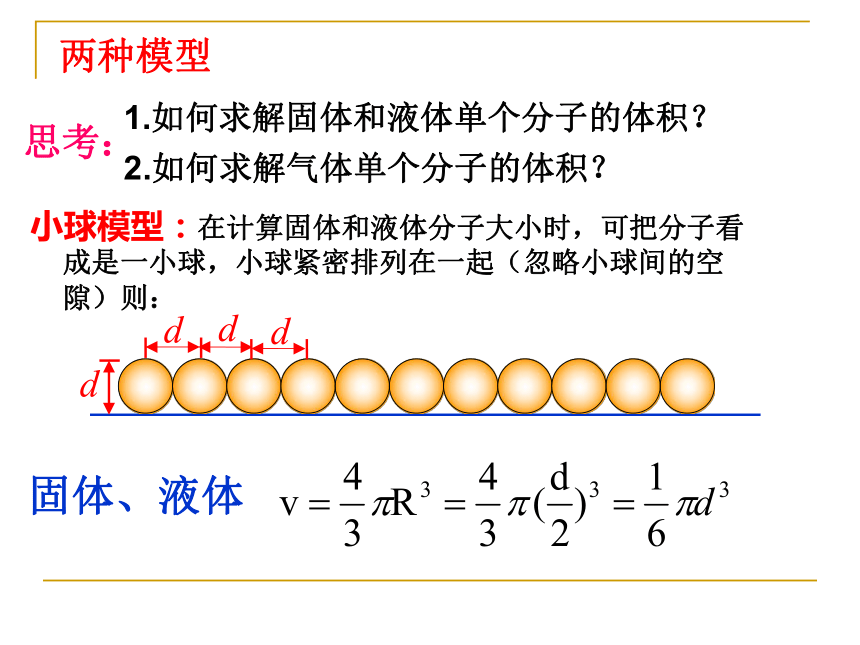
一般分子直径的数量级为10-10m(除少数有机物大分子以外)分子直径的数量级两种模型1.如何求解固体和液体单个分子的体积?
2.如何求解气体单个分子的体积?固体、液体小球模型:在计算固体和液体分子大小时,可把分子看成是一小球,小球紧密排列在一起(忽略小球间的空隙)则: 思考:气体立方体模型:在计算气体分子大小时,把每个分子和其占有的空间当作一个小立方体,气体分子位于每个立方体的中心,这个小立方体的边长等于分子间的平均距离.(d为立方体的边长)二、阿伏加德罗常数 1.回忆化学中学过的阿伏加德罗常数. 1 mol的任何物质都含有相同的粒子数,这个数就叫阿伏加德罗常数 。例:已知水的摩尔体积是1.8×10-5 m3/mol,每个水分子的直径是4×10-10m ,设想水分子是一个挨一个排列的,求1 mol水中所含的水分子数.2. 根据分子的大小,可以计算出阿伏加德罗常数 一个分子的体积:1 mol水中所含的水分子数:. =6.0×1023 mol-1N=二、阿伏加德罗常数 例:已知水的摩尔体积是1.8×10-5 m3/mol,每个水分子的直径是4×10-10m ,设想水分子是一个挨一个排列的,求1 mol水中所含的水分子数.3.阿伏加德罗常数意义结论:(1)已知物质的摩尔质量M,物体的密度p,阿伏加德罗常数NA,物质的质量 m
则:分子的质量 m分子=M/NA
分子的体积 v分子=V摩尔/ NA= ( M /p ) / NA ②
所含分子的个数 n=摩尔数×NA
=(m /M) ×NA
(2)标准状态下,1 mol气体的体积为22.4升。
气体分子占有的空间体积
V0=V摩尔/NA(该式对气体适用)判断下列说法是否正确,如果正确请求解要求量。1.已知固体和液体的摩尔体积为Vmol和一个分子的体积Vo,可以求解阿伏伽德罗常数NA3.已知物质的摩尔质量为M和一个分子的质量mo,可以求解阿伏伽德罗常数NA2.已知气体的摩尔体积为Vmol和一个分子的体积Vo,可以求解阿伏伽德罗常数NA4.已知某物质的体积V和摩尔体积Vmol,可以求解物质的分子数n5.已知某物质的质量m和摩尔质量M,可以求解物质的分子数nB、计算分子的质量分子质量的数量级: 10-26--10-27kg例4.已知:水和氢气的摩尔质量分别是1.8×10-2kg/mol和2×10-3kg/mol,求水分子和氢分子的质量(已知NA=6.0×1023mol-1)随堂练习1、下列哪一组已知数据中能求出阿伏加德罗常数 。 ( )
A物质分子的质量和体积
B物体的质量和它的摩尔质量
C物体的质量、密度和它的分子体积
D物体的摩尔体积、密度及其分子质量
DD2、1克水中含有的水分子个数为( ) A 6.02×1023 B 3.01×1023
C 6.02×1022 D 3.34×10223.只要知道下列哪一组物理量,就可以估算出气体中分子的平均距离 ( )
A.阿伏加德罗常数、该气体的摩尔质量和质量
B.阿伏加德罗常数、该气体的摩尔质量和密度
C.阿伏加德罗常数、该气体的摩尔质量和体积
D.该气体的密度、体积和摩尔质量B4.若以μ表示水的摩尔质量,υ表示在标准状态下水蒸气的摩尔体积,ρ为表示在标准状态下水蒸气的密度,NA为阿伏加德罗常数,m、Δ分别表示每个水分子的质量和体积,下面是四个关系式
① NA =υρ/m ② ρ =μ/NAΔ
③ m = μ/NA ④Δ= υ/NA
其中
A.①和②都是正确的;B.①和③都是正确的;
C.②和④都是正确的;D.①和④都是正确的。答案:B[小结]1.一般物体中的分子数目是很大的.
2.一般分子的质量也是很小的.一般分子质量数量级是10-26Kg
3.阿伏加德罗常数是联系微观世界和宏观世界的桥梁,通过该常数把摩尔质量、摩尔体积跟分子质量、分子大小等微观物理量联系起来了. 一般分子直径的数量级为10-10 m分子的模型:把分子看成球形或正方体模型。6.下列数据能求出阿伏加德罗常数的是( )
A.水的密度和水的摩尔质量
B.水的摩尔质量和水分子的体积
C.水分子的体积和水分子的质量
D.水分子的质量和水的摩尔质量D例5.已知水的摩尔质量是18×10-3kg/mol,水的密度是1×103kg/m3,求水分子的体积(已知NA=6.0×1023mol-1)C、计算分子的体积不适用于求气体分子的体积
但能计算气体分子所占的空间体积4.已知阿伏加德罗常数为NA,铜的摩尔质量为M,密度为ρ(均为国际单位),则( )
A.1m3铜原子含原子数目为ρNA/M
B.1个铜原子质量是M /NA
C.1个铜原子的体积是M/ρNA
D.1kg铜所含原子的数目是ρNA
ABC 7.水的分子量18,水的密度为103kg/m3,阿伏加德罗常数为NA=6.02×1023个/ mol,则:(1)水的摩尔质量M=__________18g/mol(2)水的摩尔体积V=__________M/ρ=18/1=18g/cm3 (3)一个水分子的质量m0 =_____________M/ NA =18 / 6.02×1023 =2.99 ×10-26 kg(4)一个水分子的体积V0 =_____________V/ NA =2.99 ×10-23 cm3(5)10g水中含有的分子数目N=___________________mNA/M=3.344 ×1021 解:设想油酸分子一个挨一个排列,1 mol 油酸分子的质量为M,密度为ρ,油酸分子的直径为d,把每个油酸分子当作小球.则其体积为: 1 mol油酸的体积 :1 mol油酸所含的微粒数,即阿伏加德罗常数为NA .? ∴NA=6×1023 mol-1 练习2.由油滴实验测得油酸分子的直径为1.12×10-9 m,已知油酸的密度为6.37×102 kg/m3,已知油酸的摩尔质量为282 g/mol,试求阿伏加德罗常数.例6.若已知铁的原子量是56,铁的密度是7.8×103kg/m3,求:
1)质量是1g的铁块中铁原子的数目(取1位有效数字)
2)计算出铁原子的直径是多少米?8.估算在标准状态下气体分子间的距离。
解:将每个空气分子所占据的空间设为小立方体,则小立方体的边长为气体分子间的距离。(V摩尔=22.4×10-3 m3)
NA×d3=V摩尔
d= (V摩尔 / NA )1/3
=[22.4×10-3 /( 6.02×1023 )]1/3m
=3.8 ×10-9 m
例题:已知空气的摩尔质量是
,则空气中气体分子的平均质量多大?成年人做一次深呼吸,约吸入450cm3的空气,则做一次深呼吸所吸入的空气质量是多少?所吸入的气体分子数量是多少?(按标准状况估算)解析 :1.空气分子的平均质量为: 2.成年人做一次深呼吸所吸入的空气质量为: 3.所吸入的分子数为:
把一滴油酸滴到水面上,油酸在水面上散开形成单分子油膜,如果把分子看成球形,单分子油膜的厚度就可认为等于油膜分子的直径.1.有一种粗略测定分子大小的方法叫油膜法.问题:3.如何求解单分子油膜层的厚度(即分子直径)呢? 1.先测出一滴油酸的体积V: 2.测出水面上漂浮的油膜的表面积S; 3.单分子油膜的厚度等于油滴体积V与油膜面积S的比值:方法小结:通过测量较大量来研究较小量。思考:在用油膜法测定分子的直径时,实际上做了理想化处理,请问:有哪些地方做了理想化处理 ?
②把分子看成球形. ①把滴在水面上的油酸层当作单分子油膜层.③油分子一个紧挨一个整齐排列;请详细叙述用油膜法估测分子的大小操作步骤1.配制溶液(稀释)配
2.精测一滴液体体积
3.水盘取水,撒痱子粉(显示油膜边界)撒
4.滴一滴溶液形成单层表面薄膜 滴
5.描油膜形状 描
6.数格数,计算油膜面积 数
7.求分子直径 求数格子时的注意事项:1.确定大面积2.再数小面积例1、将1cm3油酸溶于酒精,制成200cm3的油酸酒精溶液,已知1cm3溶液有50滴,现取1滴油酸酒精溶液滴到水面上,随着酒精溶于水,油酸在水面上形成一单分子薄层,已测出这一薄层的面积为0.2m2,由此可估测油酸分子直径是多少? 1滴油酸酒精的体积为1/50cm3
其中含油酸体积为10-10m3
油酸膜的厚度为5×10-10m一些数据太大或很小,为了书写方便,习惯上用科学记数法写成10的乘方数,如 3×10-10m。我们把10的乘方数叫做数量级, 1×10-10m和 9×10-10m,数量级都是 10-10m。
一般分子直径的数量级为10-10m(除少数有机物大分子以外)分子直径的数量级两种模型1.如何求解固体和液体单个分子的体积?
2.如何求解气体单个分子的体积?固体、液体小球模型:在计算固体和液体分子大小时,可把分子看成是一小球,小球紧密排列在一起(忽略小球间的空隙)则: 思考:气体立方体模型:在计算气体分子大小时,把每个分子和其占有的空间当作一个小立方体,气体分子位于每个立方体的中心,这个小立方体的边长等于分子间的平均距离.(d为立方体的边长)二、阿伏加德罗常数 1.回忆化学中学过的阿伏加德罗常数. 1 mol的任何物质都含有相同的粒子数,这个数就叫阿伏加德罗常数 。例:已知水的摩尔体积是1.8×10-5 m3/mol,每个水分子的直径是4×10-10m ,设想水分子是一个挨一个排列的,求1 mol水中所含的水分子数.2. 根据分子的大小,可以计算出阿伏加德罗常数 一个分子的体积:1 mol水中所含的水分子数:. =6.0×1023 mol-1N=二、阿伏加德罗常数 例:已知水的摩尔体积是1.8×10-5 m3/mol,每个水分子的直径是4×10-10m ,设想水分子是一个挨一个排列的,求1 mol水中所含的水分子数.3.阿伏加德罗常数意义结论:(1)已知物质的摩尔质量M,物体的密度p,阿伏加德罗常数NA,物质的质量 m
则:分子的质量 m分子=M/NA
分子的体积 v分子=V摩尔/ NA= ( M /p ) / NA ②
所含分子的个数 n=摩尔数×NA
=(m /M) ×NA
(2)标准状态下,1 mol气体的体积为22.4升。
气体分子占有的空间体积
V0=V摩尔/NA(该式对气体适用)判断下列说法是否正确,如果正确请求解要求量。1.已知固体和液体的摩尔体积为Vmol和一个分子的体积Vo,可以求解阿伏伽德罗常数NA3.已知物质的摩尔质量为M和一个分子的质量mo,可以求解阿伏伽德罗常数NA2.已知气体的摩尔体积为Vmol和一个分子的体积Vo,可以求解阿伏伽德罗常数NA4.已知某物质的体积V和摩尔体积Vmol,可以求解物质的分子数n5.已知某物质的质量m和摩尔质量M,可以求解物质的分子数nB、计算分子的质量分子质量的数量级: 10-26--10-27kg例4.已知:水和氢气的摩尔质量分别是1.8×10-2kg/mol和2×10-3kg/mol,求水分子和氢分子的质量(已知NA=6.0×1023mol-1)随堂练习1、下列哪一组已知数据中能求出阿伏加德罗常数 。 ( )
A物质分子的质量和体积
B物体的质量和它的摩尔质量
C物体的质量、密度和它的分子体积
D物体的摩尔体积、密度及其分子质量
DD2、1克水中含有的水分子个数为( ) A 6.02×1023 B 3.01×1023
C 6.02×1022 D 3.34×10223.只要知道下列哪一组物理量,就可以估算出气体中分子的平均距离 ( )
A.阿伏加德罗常数、该气体的摩尔质量和质量
B.阿伏加德罗常数、该气体的摩尔质量和密度
C.阿伏加德罗常数、该气体的摩尔质量和体积
D.该气体的密度、体积和摩尔质量B4.若以μ表示水的摩尔质量,υ表示在标准状态下水蒸气的摩尔体积,ρ为表示在标准状态下水蒸气的密度,NA为阿伏加德罗常数,m、Δ分别表示每个水分子的质量和体积,下面是四个关系式
① NA =υρ/m ② ρ =μ/NAΔ
③ m = μ/NA ④Δ= υ/NA
其中
A.①和②都是正确的;B.①和③都是正确的;
C.②和④都是正确的;D.①和④都是正确的。答案:B[小结]1.一般物体中的分子数目是很大的.
2.一般分子的质量也是很小的.一般分子质量数量级是10-26Kg
3.阿伏加德罗常数是联系微观世界和宏观世界的桥梁,通过该常数把摩尔质量、摩尔体积跟分子质量、分子大小等微观物理量联系起来了. 一般分子直径的数量级为10-10 m分子的模型:把分子看成球形或正方体模型。6.下列数据能求出阿伏加德罗常数的是( )
A.水的密度和水的摩尔质量
B.水的摩尔质量和水分子的体积
C.水分子的体积和水分子的质量
D.水分子的质量和水的摩尔质量D例5.已知水的摩尔质量是18×10-3kg/mol,水的密度是1×103kg/m3,求水分子的体积(已知NA=6.0×1023mol-1)C、计算分子的体积不适用于求气体分子的体积
但能计算气体分子所占的空间体积4.已知阿伏加德罗常数为NA,铜的摩尔质量为M,密度为ρ(均为国际单位),则( )
A.1m3铜原子含原子数目为ρNA/M
B.1个铜原子质量是M /NA
C.1个铜原子的体积是M/ρNA
D.1kg铜所含原子的数目是ρNA
ABC 7.水的分子量18,水的密度为103kg/m3,阿伏加德罗常数为NA=6.02×1023个/ mol,则:(1)水的摩尔质量M=__________18g/mol(2)水的摩尔体积V=__________M/ρ=18/1=18g/cm3 (3)一个水分子的质量m0 =_____________M/ NA =18 / 6.02×1023 =2.99 ×10-26 kg(4)一个水分子的体积V0 =_____________V/ NA =2.99 ×10-23 cm3(5)10g水中含有的分子数目N=___________________mNA/M=3.344 ×1021 解:设想油酸分子一个挨一个排列,1 mol 油酸分子的质量为M,密度为ρ,油酸分子的直径为d,把每个油酸分子当作小球.则其体积为: 1 mol油酸的体积 :1 mol油酸所含的微粒数,即阿伏加德罗常数为NA .? ∴NA=6×1023 mol-1 练习2.由油滴实验测得油酸分子的直径为1.12×10-9 m,已知油酸的密度为6.37×102 kg/m3,已知油酸的摩尔质量为282 g/mol,试求阿伏加德罗常数.例6.若已知铁的原子量是56,铁的密度是7.8×103kg/m3,求:
1)质量是1g的铁块中铁原子的数目(取1位有效数字)
2)计算出铁原子的直径是多少米?8.估算在标准状态下气体分子间的距离。
解:将每个空气分子所占据的空间设为小立方体,则小立方体的边长为气体分子间的距离。(V摩尔=22.4×10-3 m3)
NA×d3=V摩尔
d= (V摩尔 / NA )1/3
=[22.4×10-3 /( 6.02×1023 )]1/3m
=3.8 ×10-9 m
例题:已知空气的摩尔质量是
,则空气中气体分子的平均质量多大?成年人做一次深呼吸,约吸入450cm3的空气,则做一次深呼吸所吸入的空气质量是多少?所吸入的气体分子数量是多少?(按标准状况估算)解析 :1.空气分子的平均质量为: 2.成年人做一次深呼吸所吸入的空气质量为: 3.所吸入的分子数为:
