课题3 硝酸钾晶体的制备
图片预览




文档简介
课件18张PPT。物质的分离和提出课题3 硝酸钾晶体的制备练习:用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合适? (1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF一、过滤:“一贴、二低、三靠”漏斗、烧杯、玻璃棒实验注意事项:1、常压过滤缺点:①速度比较缓慢
②滤渣不够干燥2、减压过滤
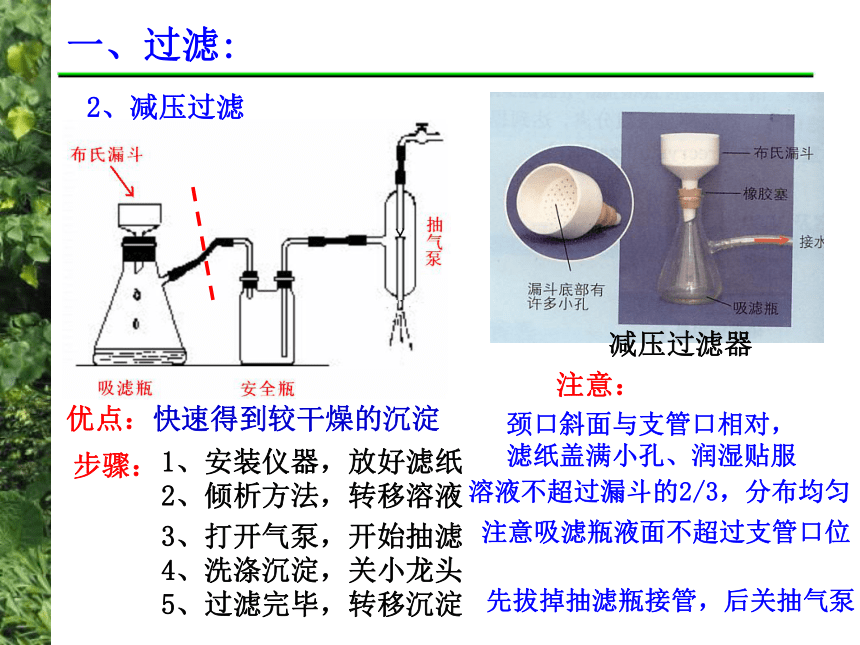
(也称抽滤或吸滤)P14 操作向导一、过滤:2、减压过滤优点:快速得到较干燥的沉淀减压过滤器1、安装仪器,放好滤纸 2、倾析方法,转移溶液3、打开气泵,开始抽滤4、洗涤沉淀,关小龙头5、过滤完毕,转移沉淀 步骤:注意:颈口斜面与支管口相对,
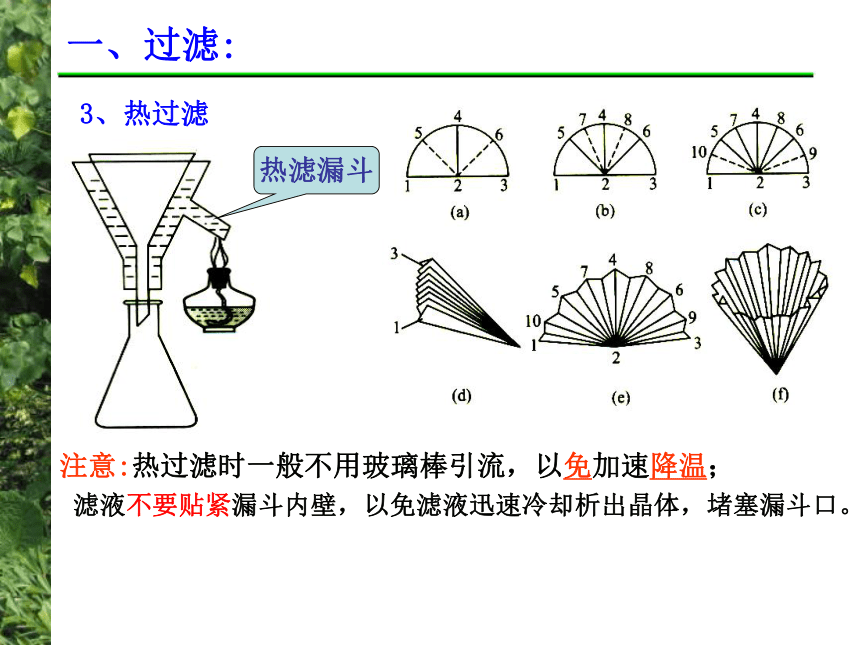
滤纸盖满小孔、润湿贴服溶液不超过漏斗的2/3,分布均匀注意吸滤瓶液面不超过支管口位先拔掉抽滤瓶接管,后关抽气泵 一、过滤:3、热过滤热滤漏斗 注意:热过滤时一般不用玻璃棒引流,以免加速降温;滤液不要贴紧漏斗内壁,以免滤液迅速冷却析出晶体,堵塞漏斗口。二、硝酸钾晶体的制备 硝 酸 钾
既是一种重要的工业原料又是一种优质的无氯钾氮复合肥.
在工业上,硝酸钾主要用作工业原料,应用于火药、焰火、
金属焊接助剂、氨催化剂、玻璃制品等等,
在食品和医药行业也有一定的应用。
在农业上,主要用于烟草、花卉、柑橘以及其他对氯离子敏
感的经济作物,可以明显提高作物的产量和品质,还可以用来
作氮磷钾复合肥,被誉为硫酸钾之后的“第三代钾肥” 在智利等地有一些硝酸钾天然矿物称
硝石或火硝,主要成分为硝酸钾、氯化钠
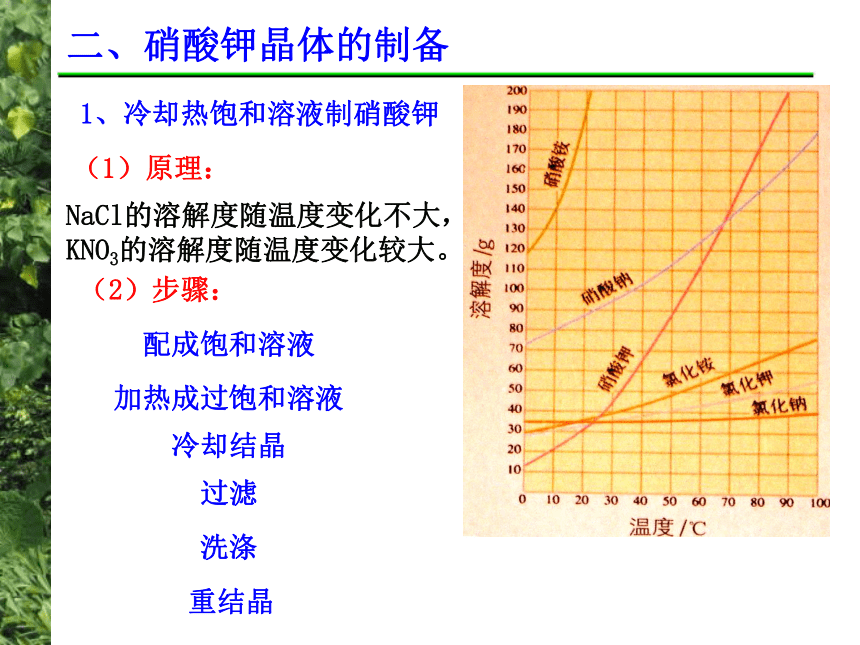
等无机盐,如何利用硝石制得纯净的KNO3? 二、硝酸钾晶体的制备1、冷却热饱和溶液制硝酸钾(1)原理:NaCl的溶解度随温度变化不大,
KNO3的溶解度随温度变化较大。(2)步骤:配成饱和溶液加热成过饱和溶液冷却结晶过滤洗涤重结晶2、以硝酸钠、氯化钾为原料的复分解法制硝酸钾思考:我国工业上大多以硝酸钠和氯化钾为主要原料生产KNO3,副产品为氯化钠。反应方程为:NaNO3 + KCl ==NaCl + KNO3(1)、反应原理: 将一定浓渡的硝酸钠和氯化钾混合溶液加热到沸腾,使溶液
浓缩,将有氯化钠晶体析出。趁热过滤,即可分离出氯化钠晶体。将滤液冷却至室温,可使硝酸钾晶体析出。经减压过滤就
可以分离出硝酸钾晶体。溶解度随温度变化:较大 较小 小 大↓(2)、硝酸钾晶体的实验方案设计:1)固体溶解2)蒸发、热过滤3)冷却、减压过滤4)重结晶5)称量6)检验Cl-粗KNO3提纯KNO3纯度的检验天平、烧杯、 玻璃棒、酒精灯铁架台、铜质保温漏斗布氏漏斗、吸滤瓶、安全瓶、抽气泵2、以硝酸钠、氯化钾为原料的复分解法制硝酸钾(1)、反应原理:NaNO3 + KCl ==NaCl↓ + KNO3承接液2mL水NaNO3 KCl NaCl KNO3NaClKNO3NaClKNO3思考:
请设计一个实验来检验两种情况下制备得到产品的纯度大小?(1)检验所得产品中是否Cl-的目的是 。 看是否硝酸钾纯净 结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。 m2/m1Ⅹ100%交流与讨论:(2)、制备硝酸钾晶体时,为什么要趁热过滤?防止过滤是硝酸钾晶体析出(5)、如果要制备颗粒较大的硝酸钾晶体,应该怎样选择结晶条件?应该尽量缓慢地冷却,并保持容器静置,切不可震荡容器,以使晶体缓慢析出,形成较大的晶体颗粒.(3)步骤③过滤装置如图1—8所示,采用这种装置
过滤的主要目的是 ,
这种装置工作的主要原理是 , 加快过滤速度,得到较干燥的晶体 抽气泵给吸滤瓶减压,
造成瓶被布氏漏斗液面的压力差,从而加快过滤速度 (4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取
溶液,上述实验步骤中一般需要用到玻璃棒的是__________①②③⑥ 1、某实验小组只领取了下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只用上述仪器或用品,下列实验操作不能进行的是( )
A、蒸发 B、萃取
C、过滤 D、蒸馏CD练习:2、减压吸滤装备和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是( )
A、可过滤胶状沉淀
B、可过滤颗粒更小的沉淀
C、可使沉淀中的杂质减少
D、可得到较干燥的沉淀D练习:3、将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾,有晶体析出。趁热过滤,分离出晶体A。将上述滤液冷却至室温,又有晶体的B析出。
(1)晶体A的主要成分是________,含有的少量杂质是_________,要除去晶体 A中的少量杂质的方法是_______________.
(2)晶体B的主要成分是________,含有的少量杂质是_________,要除去晶体 B中的少量杂质的方法是_______________.
(3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的方法,这种方法适用于晶体 ____(填A或B)NaClKNO3加少量水溶解再热过滤KNO3NaCl重结晶A练习:纸层析法惰性支撑物:滤纸或其它载体固定相:流动相:水有机溶剂1、纸层析法组成(展开剂)2、纸层析法原理 样品混合物中各组分在水或有机溶剂中的溶解能力各不相同,
各组分会在水与有机溶剂两相中发生溶解分配现象,毛细现象:是物质分子间作用力的结果。纸层析法1、纸层析法组成2、纸层析法原理3、纸层析法的操作方法裁纸点样展开显色配液1.5cm×20cm 离滤纸末端约2cm处用铅笔画一条细线用毛细管取样品,轻轻点样于原点上,晾干,重复3~5次。
斑点直径小于0.5cm展开剂选择:亲脂性成分溶解度即不能太大也不能太小取展开剂:不能粘到试管壁上滤纸不可触及试管的内壁,纸条末端浸入展开剂约0.5cm,
不能让试样点浸入展开剂 展开:试样点约2cm如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败。①层析过程中的实验现象②氨熏后的实验现象氯化铁层硫酸铜层(3)、实验现象上端出现红棕色,
下方出现蓝色
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合适? (1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF一、过滤:“一贴、二低、三靠”漏斗、烧杯、玻璃棒实验注意事项:1、常压过滤缺点:①速度比较缓慢
②滤渣不够干燥2、减压过滤
(也称抽滤或吸滤)P14 操作向导一、过滤:2、减压过滤优点:快速得到较干燥的沉淀减压过滤器1、安装仪器,放好滤纸 2、倾析方法,转移溶液3、打开气泵,开始抽滤4、洗涤沉淀,关小龙头5、过滤完毕,转移沉淀 步骤:注意:颈口斜面与支管口相对,
滤纸盖满小孔、润湿贴服溶液不超过漏斗的2/3,分布均匀注意吸滤瓶液面不超过支管口位先拔掉抽滤瓶接管,后关抽气泵 一、过滤:3、热过滤热滤漏斗 注意:热过滤时一般不用玻璃棒引流,以免加速降温;滤液不要贴紧漏斗内壁,以免滤液迅速冷却析出晶体,堵塞漏斗口。二、硝酸钾晶体的制备 硝 酸 钾
既是一种重要的工业原料又是一种优质的无氯钾氮复合肥.
在工业上,硝酸钾主要用作工业原料,应用于火药、焰火、
金属焊接助剂、氨催化剂、玻璃制品等等,
在食品和医药行业也有一定的应用。
在农业上,主要用于烟草、花卉、柑橘以及其他对氯离子敏
感的经济作物,可以明显提高作物的产量和品质,还可以用来
作氮磷钾复合肥,被誉为硫酸钾之后的“第三代钾肥” 在智利等地有一些硝酸钾天然矿物称
硝石或火硝,主要成分为硝酸钾、氯化钠
等无机盐,如何利用硝石制得纯净的KNO3? 二、硝酸钾晶体的制备1、冷却热饱和溶液制硝酸钾(1)原理:NaCl的溶解度随温度变化不大,
KNO3的溶解度随温度变化较大。(2)步骤:配成饱和溶液加热成过饱和溶液冷却结晶过滤洗涤重结晶2、以硝酸钠、氯化钾为原料的复分解法制硝酸钾思考:我国工业上大多以硝酸钠和氯化钾为主要原料生产KNO3,副产品为氯化钠。反应方程为:NaNO3 + KCl ==NaCl + KNO3(1)、反应原理: 将一定浓渡的硝酸钠和氯化钾混合溶液加热到沸腾,使溶液
浓缩,将有氯化钠晶体析出。趁热过滤,即可分离出氯化钠晶体。将滤液冷却至室温,可使硝酸钾晶体析出。经减压过滤就
可以分离出硝酸钾晶体。溶解度随温度变化:较大 较小 小 大↓(2)、硝酸钾晶体的实验方案设计:1)固体溶解2)蒸发、热过滤3)冷却、减压过滤4)重结晶5)称量6)检验Cl-粗KNO3提纯KNO3纯度的检验天平、烧杯、 玻璃棒、酒精灯铁架台、铜质保温漏斗布氏漏斗、吸滤瓶、安全瓶、抽气泵2、以硝酸钠、氯化钾为原料的复分解法制硝酸钾(1)、反应原理:NaNO3 + KCl ==NaCl↓ + KNO3承接液2mL水NaNO3 KCl NaCl KNO3NaClKNO3NaClKNO3思考:
请设计一个实验来检验两种情况下制备得到产品的纯度大小?(1)检验所得产品中是否Cl-的目的是 。 看是否硝酸钾纯净 结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。 m2/m1Ⅹ100%交流与讨论:(2)、制备硝酸钾晶体时,为什么要趁热过滤?防止过滤是硝酸钾晶体析出(5)、如果要制备颗粒较大的硝酸钾晶体,应该怎样选择结晶条件?应该尽量缓慢地冷却,并保持容器静置,切不可震荡容器,以使晶体缓慢析出,形成较大的晶体颗粒.(3)步骤③过滤装置如图1—8所示,采用这种装置
过滤的主要目的是 ,
这种装置工作的主要原理是 , 加快过滤速度,得到较干燥的晶体 抽气泵给吸滤瓶减压,
造成瓶被布氏漏斗液面的压力差,从而加快过滤速度 (4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取
溶液,上述实验步骤中一般需要用到玻璃棒的是__________①②③⑥ 1、某实验小组只领取了下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只用上述仪器或用品,下列实验操作不能进行的是( )
A、蒸发 B、萃取
C、过滤 D、蒸馏CD练习:2、减压吸滤装备和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是( )
A、可过滤胶状沉淀
B、可过滤颗粒更小的沉淀
C、可使沉淀中的杂质减少
D、可得到较干燥的沉淀D练习:3、将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾,有晶体析出。趁热过滤,分离出晶体A。将上述滤液冷却至室温,又有晶体的B析出。
(1)晶体A的主要成分是________,含有的少量杂质是_________,要除去晶体 A中的少量杂质的方法是_______________.
(2)晶体B的主要成分是________,含有的少量杂质是_________,要除去晶体 B中的少量杂质的方法是_______________.
(3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的方法,这种方法适用于晶体 ____(填A或B)NaClKNO3加少量水溶解再热过滤KNO3NaCl重结晶A练习:纸层析法惰性支撑物:滤纸或其它载体固定相:流动相:水有机溶剂1、纸层析法组成(展开剂)2、纸层析法原理 样品混合物中各组分在水或有机溶剂中的溶解能力各不相同,
各组分会在水与有机溶剂两相中发生溶解分配现象,毛细现象:是物质分子间作用力的结果。纸层析法1、纸层析法组成2、纸层析法原理3、纸层析法的操作方法裁纸点样展开显色配液1.5cm×20cm 离滤纸末端约2cm处用铅笔画一条细线用毛细管取样品,轻轻点样于原点上,晾干,重复3~5次。
斑点直径小于0.5cm展开剂选择:亲脂性成分溶解度即不能太大也不能太小取展开剂:不能粘到试管壁上滤纸不可触及试管的内壁,纸条末端浸入展开剂约0.5cm,
不能让试样点浸入展开剂 展开:试样点约2cm如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败。①层析过程中的实验现象②氨熏后的实验现象氯化铁层硫酸铜层(3)、实验现象上端出现红棕色,
下方出现蓝色
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
