2019中考科学复习课件:专题13 构成物质的微粒 元素(课件 37张ppt)
文档属性
| 名称 | 2019中考科学复习课件:专题13 构成物质的微粒 元素(课件 37张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-04-14 22:07:39 | ||
图片预览








文档简介
(共37张PPT)
专题13 构成物质的微粒 元素
考点一 构成物质的三种微粒
说出物质是由分子、原子或离子构成(a)
考纲要求
知识回顾
构成物质的三种微粒有: 、 和
。分子是保持物质 的一种微粒;原子是 中的最小微粒;离子是 的原子或原子团,带正电的为阳离子,带负电的为阴离子。
(1)有的物质是由 构成的,如一些化合物(H2O、CO2等)、一些气态单质(O2、H2等)。
(2)有些物质是由 直接构成的,如金属单质(Fe、Al等)、一些非金属单质(金刚石等)、稀有气体(He、Ar等)。
(3)有些物质是由 构成的,如大多数碱和盐(NaOH、CuSO4等)。
分子
原子
离子
化学性质
化学变化
带电
分子
原子
离子
应用示例
练习1 (2017·南京)下列物质由分子构成的是( )
A.氩气 B.硫酸铜
C.C60 D.金刚石
C
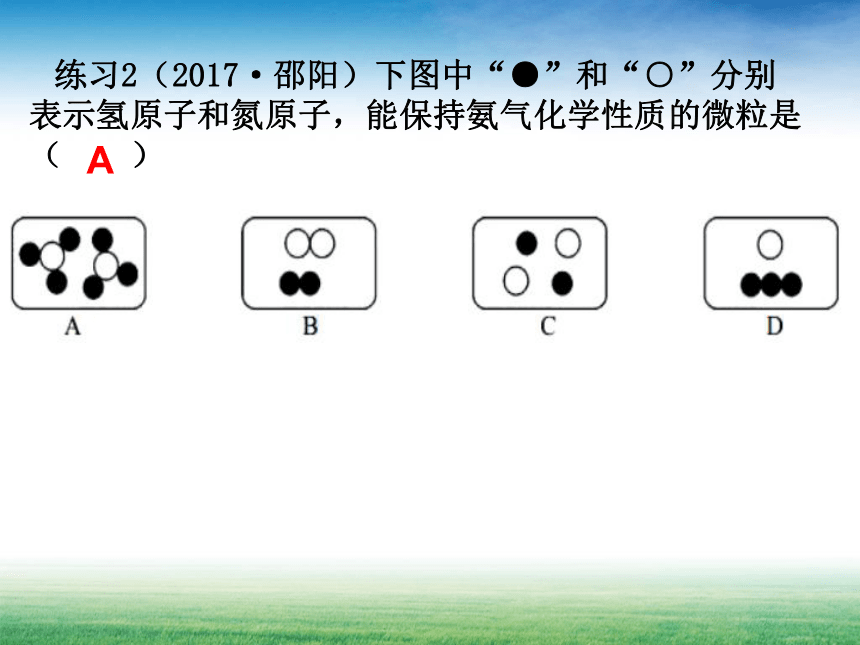
练习2(2017·邵阳)下图中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A
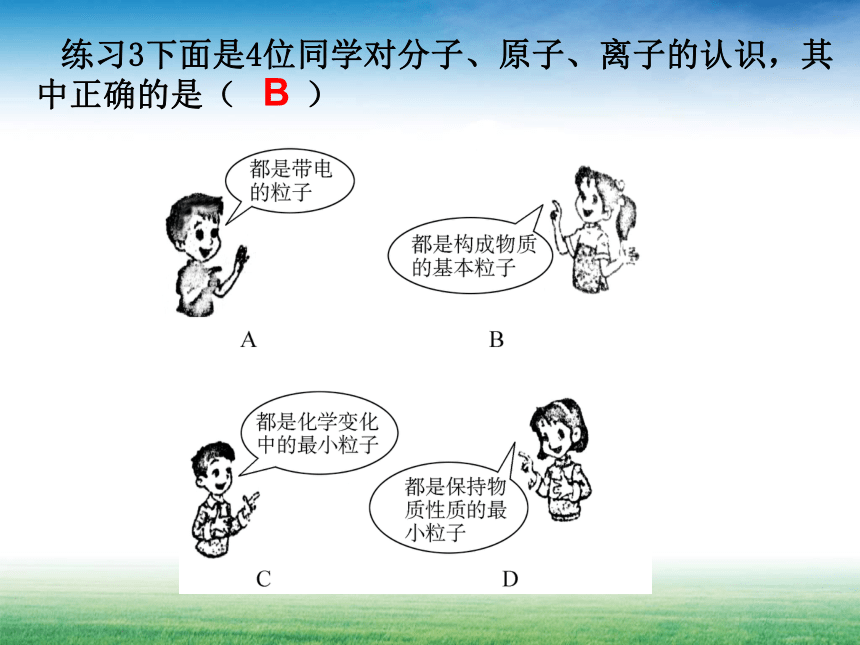
练习3下面是4位同学对分子、原子、离子的认识,其中正确的是( )
B
选项 宏观事实 微观解释
A 塑料带很难被拉断 分子之间有引力
B 水结冰后不再流动 分子停止了运动
C 切洋葱时眼睛被熏得直流泪 分子在不停运动
D 水很难被压缩 分子之间有斥力
练习4 (2018·绍兴)下列对宏观事实的微观解释错误的是( )
B
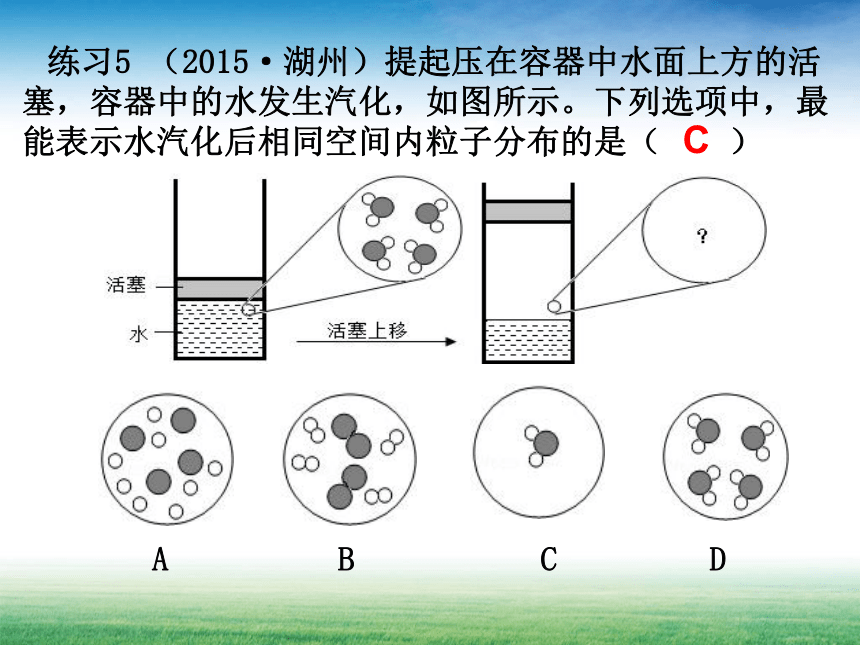
练习5 (2015·湖州)提起压在容器中水面上方的活塞,容器中的水发生汽化,如图所示。下列选项中,最能表示水汽化后相同空间内粒子分布的是( )
A B C D
C
考点二 原子的结构
考纲要求
1. 说出原子由原子核和电子构成(a)
2. 说出原子核由质子和中子构成(a)
3. 知道人类对原子结构的探索过程(a)
4. 体验建立模型的思想方法(a)
知识回顾
1. 原子的结构
相对原子质量≈ + 。
质子数=核电荷数=核外电子数
2. 原子核所带的电荷和核外电子所带的电荷数目
,但电性 ,整个原子不显电性。原子核在整个原子中所占的体积很小,但原子的质量主要集中在 。
质子数
中子数
相等
相反
原子核
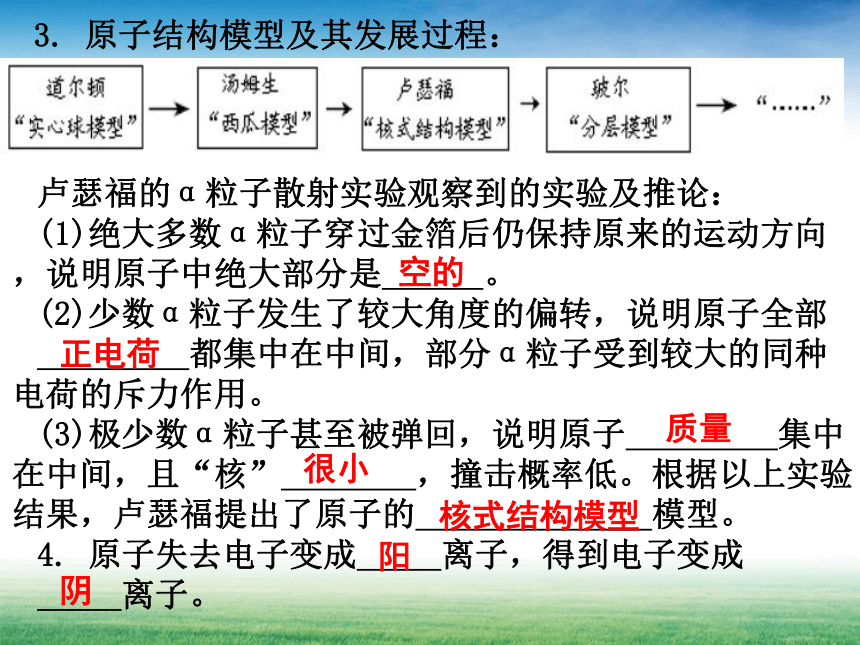
3. 原子结构模型及其发展过程:
卢瑟福的α粒子散射实验观察到的实验及推论:
(1)绝大多数α粒子穿过金箔后仍保持原来的运动方向,说明原子中绝大部分是 。
(2)少数α粒子发生了较大角度的偏转,说明原子全部
都集中在中间,部分α粒子受到较大的同种电荷的斥力作用。
(3)极少数α粒子甚至被弹回,说明原子 集中在中间,且“核” ,撞击概率低。根据以上实验结果,卢瑟福提出了原子的 模型。
4. 原子失去电子变成 离子,得到电子变成
离子。
空的
正电荷
质量
很小
核式结构模型
阳
阴
提醒要点:原子的质量主要集中在原子核上,原子核中质子数不一定等于中子数,普通氢原子的原子核内无中子。
应用示例
练习1(2017·威海)学习完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是( )
A.原子由居于中心的原子核和核外电子构成
B.核外电子在离核远近不同的区域中运动
C.原子核的质量和电子的质量相差不大
D.原子核的体积与整个原子的体积相比要小很多
C
练习2(2017·内蒙古)2015年10月,中国科研团队首次证实了天然铀单质的存在。用于核电工业的一种铀原子中含有92个质子和143个中子。有关该原子的说法不正确的是( )
A.属于金属元素
B.原子序数为92
C.核外电子数为92
D.相对原子质量为143
D
练习3(2015·温州)氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( )
A.A B.B C.C D.D
A
练习4(2018·杭州)南京理工大学胡炳成团队用新方法制得了NaN5·3H2O。该化合物中含有N5-等微粒,已知N为7号元素,则下列有关说法正确的是( )
A.N5-是一种单质
B. 1个N5-带一个单位的正电荷
C. 1个N5-共含有35个质子
D. 1个N5-共含有35个电子
C
练习5 科学理论的建立都要有一定的证据。在研究原子结构的历史进程中,卢瑟福揭开了原子世界一个又一个的奥秘。
(1)1911年,卢瑟福等人进行了α粒子散射实验,将一些带两个单位正电荷、高速运动的α粒子轰击金箔,发现多数α粒子穿过金箔后仍保持原来的运动方向,但也有少数α粒子发生了较大角度的偏转,而极少数α粒子发生反弹。据此分析可以得到有关原子结构的说法,正确的是 (填序号)。
AC
A.大多数α粒子能穿透金箔而不改变原来的运动方向,说明了金原子中原子核的体积很小
B.少部分α粒子改变原来的方向,说明原子核带负电
C.极少数的α粒子被反弹了回来,说明了原子核的质量很大
(2)1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子中被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是 。
质子
考点三 组成物质的元素
考纲要求
1. 指认具体物质的元素组成(a)
2. 列举重要化肥的有效元素(N、P、K)(a)
3. 认识常见元素的符号(b)
4. 说明元素符号所表示的含义(b)
5. 列举金属、非金属元素在元素周期表中的分布(a)
知识回顾
元素 原子 离子 分子
概念范畴 宏观 微观
表述 只表示种类不计个数 既可表示种类又可表示个数
在化学反应中 元素的种类不变 原子种类和数目不变
1. 元素是具有相同 (即 )的同一类原子的总称,元素的种类
由 决定。元素是宏观的概念,它与构成物质的粒子区别如下:
核电荷数
质子数
质子数
2. 元素符号
(1)元素符号所表示的意义:
一种 ;
该元素一个 ;
表示一种 (由原子直接构成的物质)。
元素
原子
物质
位置 含义 例子
前面的数字 微粒个数 2H表示两个氢原子
2H2表示两个氢分子
2H+ 表示两个氢离子
右下角的数字 一个粒子中
含有的原子个数 N2中的“2”表示每个氮分子中含有两个氮原子
右上角的数字 一个离子
所带的电荷数 Ca2+中的“2”表示一个钙离子带两个单位的正电荷
上面的数字
+2
元素的化合价
CuO中的“2”表示氧化铜中铜元素的化合价显正二价。
(2)元素符号周围数字的含义:
3. 由一种元素组成的纯净物叫 ,由不同种元素组成的纯净物叫 。
4. 元素的存在形式:元素以单质形式存在的称为该元素的 ;元素以化合物形式存在的称为该元素的 。
5. 植物生长过程中需要量较多的是含 、 、
元素的无机盐。
单质
化合物
游离态
化合态
N
P
K
6. 元素周期表的结构
(1)结构:每个横行叫 ,共7个横行,即7个周期;每个纵行叫 ,共18个纵行,16个族(8、9、10三个纵行合成为1个族);
(2)信息:
A是 、 B是 、
C是 、 D是 ;
原子序数= = =
周期
族
原子序数
元素符号
元素名称
相对原子质量
质子数
核外电子数
核电荷数
(3)规律:横行:电子层数 ,最外层电子数从左到右依次 ;
纵行:最外层 相同(即化学性质相似);从上到下电子层数 。
相同
增多
电子数
递增
族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2
3
4
5
6
7
7.金属元素和非金属元素在元素周期表的相对位置
应用示例
练习1(2016·绥化)下列化学用语书写正确的是( )
A.三个钾原子:3K+
B.两个二氧化氮分子:2N02
C.镁离子:Mg+2
D.地壳中含量最多的金属元素:AL
B
练习2(2016·海南)下列化学用语解释正确的是( )
A.H2—2个氢原子
B.2N—2个氮元素
C.O—1个氧分子
D.Fe(+3)—+3价铁元素
D
练习3(2018·绍兴)国际上有铟等7种元素的相对原子质量采用了我国科学家张青莲测的数据。由图可知铟元素( )
A.是非金属元素
B.质子数为49
C.相对原子质量是114.8克
D.与其他元素根本区别是中子数不同
B
练习4 小敏对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”
(1)小敏认为的“铁”,是指 (选填“铁元素”或“铁单质”)。
(2)通过Fe2O3+3CO=====(高温)2Fe+3CO2可以把铁矿石中的铁元素转变成铁单质,此反应利用
了CO的_______性。
铁单质
还原
练习5 金鱼在凉开水中不能存活,是因为凉开水中没有氧 ;高钙奶粉中的
“钙”指的是钙 ;在SO2、C02、O2三种物质分子中都含有相同的氧 。
A.元素 B.分子
C.原子 D.离子
B
A
C
考点四 元素的化合价
考纲要求
1. 知道一些常见元素的化合价(b)
2. 运用化合价表述出简单的化学式(b)
3. 根据化学式推断元素的化合价(b)
知识回顾
1. 不同原子构成分子时,各种原子的个数用“化合价”来表示。
2. 常见的化合物中氧显 价,氢显 价,金属元素常显 价,非金属元素跟氧化合时常显 价,跟氢化合时常显 价。
3. 单质中元素的化合价为 ;在化合物里,元素正负化合价的 为零。
提醒要点:在化学式上标元素化合价时应标在元素符号的正上方,符号在前,数字在后。
-2
+1
正
正
负
0
代数和
应用示例
练习1(2017·江西)我省参与制造的C919大飞机采用的复合材料中使用了高温陶瓷
材料氮化硅(Si3N4),其中硅元索的化合价为+4价,则氮元素的化合价为( )
A.-3 B.+2
C.+3 D.+4
A
练习2 超导材料为具有零电阻及反磁性的物质。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox。如果在研磨烧结过程中各元素的化合价无变化,那么x的值为( )
A. 12 B. 13 C. 15 D. 26
B
练习3(2018·温州)我国用新技术提纯了稀有金属铼(Re)为航空航天发动机核心部件的制造提供了重要原料。
(1)铼原子的相对原子质量为186,原子核内有75个质子,则其核外电子数为_________。
(2)高铼酸钠(NaReO4)是铼的重要来源之一。高铼酸钠中铼元素的化合价为_______。
75
+7
练习4 类推的思维方法在化学学习中应用广泛。类推法就是根据两个对象之间在某些方面相同或相似的特点,推出其它方面也可能相同或相似结论的方法。请用此方法解决下列问题:
(1)+6、+4是硫元素常见的化合价,相应的钠盐有Na2SO4和Na2SO3;以此类推,+5、+3是氮元素常见的化合价,相应的钠盐有NaNO3和 (填化学式)。
(2)氢的氧化物有:水(H2O)与过氧化氢(H2O2);钠的氧化物有:氧化钠(Na2O)与过氧化钠
(Na2O2),以此类推过氧化钡的化学式为 。
(3)根据教材中一个类似的反应,类推出如下反应:SO3+2NaOH=Na2SO4+H2O,则这个类似反
应是____ _ _(填化学方程式)。
NaNO2
Ba(O2)2
CO2+2NaOH=Na2CO3+H2O
专题13 构成物质的微粒 元素
考点一 构成物质的三种微粒
说出物质是由分子、原子或离子构成(a)
考纲要求
知识回顾
构成物质的三种微粒有: 、 和
。分子是保持物质 的一种微粒;原子是 中的最小微粒;离子是 的原子或原子团,带正电的为阳离子,带负电的为阴离子。
(1)有的物质是由 构成的,如一些化合物(H2O、CO2等)、一些气态单质(O2、H2等)。
(2)有些物质是由 直接构成的,如金属单质(Fe、Al等)、一些非金属单质(金刚石等)、稀有气体(He、Ar等)。
(3)有些物质是由 构成的,如大多数碱和盐(NaOH、CuSO4等)。
分子
原子
离子
化学性质
化学变化
带电
分子
原子
离子
应用示例
练习1 (2017·南京)下列物质由分子构成的是( )
A.氩气 B.硫酸铜
C.C60 D.金刚石
C
练习2(2017·邵阳)下图中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A
练习3下面是4位同学对分子、原子、离子的认识,其中正确的是( )
B
选项 宏观事实 微观解释
A 塑料带很难被拉断 分子之间有引力
B 水结冰后不再流动 分子停止了运动
C 切洋葱时眼睛被熏得直流泪 分子在不停运动
D 水很难被压缩 分子之间有斥力
练习4 (2018·绍兴)下列对宏观事实的微观解释错误的是( )
B
练习5 (2015·湖州)提起压在容器中水面上方的活塞,容器中的水发生汽化,如图所示。下列选项中,最能表示水汽化后相同空间内粒子分布的是( )
A B C D
C
考点二 原子的结构
考纲要求
1. 说出原子由原子核和电子构成(a)
2. 说出原子核由质子和中子构成(a)
3. 知道人类对原子结构的探索过程(a)
4. 体验建立模型的思想方法(a)
知识回顾
1. 原子的结构
相对原子质量≈ + 。
质子数=核电荷数=核外电子数
2. 原子核所带的电荷和核外电子所带的电荷数目
,但电性 ,整个原子不显电性。原子核在整个原子中所占的体积很小,但原子的质量主要集中在 。
质子数
中子数
相等
相反
原子核
3. 原子结构模型及其发展过程:
卢瑟福的α粒子散射实验观察到的实验及推论:
(1)绝大多数α粒子穿过金箔后仍保持原来的运动方向,说明原子中绝大部分是 。
(2)少数α粒子发生了较大角度的偏转,说明原子全部
都集中在中间,部分α粒子受到较大的同种电荷的斥力作用。
(3)极少数α粒子甚至被弹回,说明原子 集中在中间,且“核” ,撞击概率低。根据以上实验结果,卢瑟福提出了原子的 模型。
4. 原子失去电子变成 离子,得到电子变成
离子。
空的
正电荷
质量
很小
核式结构模型
阳
阴
提醒要点:原子的质量主要集中在原子核上,原子核中质子数不一定等于中子数,普通氢原子的原子核内无中子。
应用示例
练习1(2017·威海)学习完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是( )
A.原子由居于中心的原子核和核外电子构成
B.核外电子在离核远近不同的区域中运动
C.原子核的质量和电子的质量相差不大
D.原子核的体积与整个原子的体积相比要小很多
C
练习2(2017·内蒙古)2015年10月,中国科研团队首次证实了天然铀单质的存在。用于核电工业的一种铀原子中含有92个质子和143个中子。有关该原子的说法不正确的是( )
A.属于金属元素
B.原子序数为92
C.核外电子数为92
D.相对原子质量为143
D
练习3(2015·温州)氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( )
A.A B.B C.C D.D
A
练习4(2018·杭州)南京理工大学胡炳成团队用新方法制得了NaN5·3H2O。该化合物中含有N5-等微粒,已知N为7号元素,则下列有关说法正确的是( )
A.N5-是一种单质
B. 1个N5-带一个单位的正电荷
C. 1个N5-共含有35个质子
D. 1个N5-共含有35个电子
C
练习5 科学理论的建立都要有一定的证据。在研究原子结构的历史进程中,卢瑟福揭开了原子世界一个又一个的奥秘。
(1)1911年,卢瑟福等人进行了α粒子散射实验,将一些带两个单位正电荷、高速运动的α粒子轰击金箔,发现多数α粒子穿过金箔后仍保持原来的运动方向,但也有少数α粒子发生了较大角度的偏转,而极少数α粒子发生反弹。据此分析可以得到有关原子结构的说法,正确的是 (填序号)。
AC
A.大多数α粒子能穿透金箔而不改变原来的运动方向,说明了金原子中原子核的体积很小
B.少部分α粒子改变原来的方向,说明原子核带负电
C.极少数的α粒子被反弹了回来,说明了原子核的质量很大
(2)1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子中被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是 。
质子
考点三 组成物质的元素
考纲要求
1. 指认具体物质的元素组成(a)
2. 列举重要化肥的有效元素(N、P、K)(a)
3. 认识常见元素的符号(b)
4. 说明元素符号所表示的含义(b)
5. 列举金属、非金属元素在元素周期表中的分布(a)
知识回顾
元素 原子 离子 分子
概念范畴 宏观 微观
表述 只表示种类不计个数 既可表示种类又可表示个数
在化学反应中 元素的种类不变 原子种类和数目不变
1. 元素是具有相同 (即 )的同一类原子的总称,元素的种类
由 决定。元素是宏观的概念,它与构成物质的粒子区别如下:
核电荷数
质子数
质子数
2. 元素符号
(1)元素符号所表示的意义:
一种 ;
该元素一个 ;
表示一种 (由原子直接构成的物质)。
元素
原子
物质
位置 含义 例子
前面的数字 微粒个数 2H表示两个氢原子
2H2表示两个氢分子
2H+ 表示两个氢离子
右下角的数字 一个粒子中
含有的原子个数 N2中的“2”表示每个氮分子中含有两个氮原子
右上角的数字 一个离子
所带的电荷数 Ca2+中的“2”表示一个钙离子带两个单位的正电荷
上面的数字
+2
元素的化合价
CuO中的“2”表示氧化铜中铜元素的化合价显正二价。
(2)元素符号周围数字的含义:
3. 由一种元素组成的纯净物叫 ,由不同种元素组成的纯净物叫 。
4. 元素的存在形式:元素以单质形式存在的称为该元素的 ;元素以化合物形式存在的称为该元素的 。
5. 植物生长过程中需要量较多的是含 、 、
元素的无机盐。
单质
化合物
游离态
化合态
N
P
K
6. 元素周期表的结构
(1)结构:每个横行叫 ,共7个横行,即7个周期;每个纵行叫 ,共18个纵行,16个族(8、9、10三个纵行合成为1个族);
(2)信息:
A是 、 B是 、
C是 、 D是 ;
原子序数= = =
周期
族
原子序数
元素符号
元素名称
相对原子质量
质子数
核外电子数
核电荷数
(3)规律:横行:电子层数 ,最外层电子数从左到右依次 ;
纵行:最外层 相同(即化学性质相似);从上到下电子层数 。
相同
增多
电子数
递增
族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2
3
4
5
6
7
7.金属元素和非金属元素在元素周期表的相对位置
应用示例
练习1(2016·绥化)下列化学用语书写正确的是( )
A.三个钾原子:3K+
B.两个二氧化氮分子:2N02
C.镁离子:Mg+2
D.地壳中含量最多的金属元素:AL
B
练习2(2016·海南)下列化学用语解释正确的是( )
A.H2—2个氢原子
B.2N—2个氮元素
C.O—1个氧分子
D.Fe(+3)—+3价铁元素
D
练习3(2018·绍兴)国际上有铟等7种元素的相对原子质量采用了我国科学家张青莲测的数据。由图可知铟元素( )
A.是非金属元素
B.质子数为49
C.相对原子质量是114.8克
D.与其他元素根本区别是中子数不同
B
练习4 小敏对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”
(1)小敏认为的“铁”,是指 (选填“铁元素”或“铁单质”)。
(2)通过Fe2O3+3CO=====(高温)2Fe+3CO2可以把铁矿石中的铁元素转变成铁单质,此反应利用
了CO的_______性。
铁单质
还原
练习5 金鱼在凉开水中不能存活,是因为凉开水中没有氧 ;高钙奶粉中的
“钙”指的是钙 ;在SO2、C02、O2三种物质分子中都含有相同的氧 。
A.元素 B.分子
C.原子 D.离子
B
A
C
考点四 元素的化合价
考纲要求
1. 知道一些常见元素的化合价(b)
2. 运用化合价表述出简单的化学式(b)
3. 根据化学式推断元素的化合价(b)
知识回顾
1. 不同原子构成分子时,各种原子的个数用“化合价”来表示。
2. 常见的化合物中氧显 价,氢显 价,金属元素常显 价,非金属元素跟氧化合时常显 价,跟氢化合时常显 价。
3. 单质中元素的化合价为 ;在化合物里,元素正负化合价的 为零。
提醒要点:在化学式上标元素化合价时应标在元素符号的正上方,符号在前,数字在后。
-2
+1
正
正
负
0
代数和
应用示例
练习1(2017·江西)我省参与制造的C919大飞机采用的复合材料中使用了高温陶瓷
材料氮化硅(Si3N4),其中硅元索的化合价为+4价,则氮元素的化合价为( )
A.-3 B.+2
C.+3 D.+4
A
练习2 超导材料为具有零电阻及反磁性的物质。以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox。如果在研磨烧结过程中各元素的化合价无变化,那么x的值为( )
A. 12 B. 13 C. 15 D. 26
B
练习3(2018·温州)我国用新技术提纯了稀有金属铼(Re)为航空航天发动机核心部件的制造提供了重要原料。
(1)铼原子的相对原子质量为186,原子核内有75个质子,则其核外电子数为_________。
(2)高铼酸钠(NaReO4)是铼的重要来源之一。高铼酸钠中铼元素的化合价为_______。
75
+7
练习4 类推的思维方法在化学学习中应用广泛。类推法就是根据两个对象之间在某些方面相同或相似的特点,推出其它方面也可能相同或相似结论的方法。请用此方法解决下列问题:
(1)+6、+4是硫元素常见的化合价,相应的钠盐有Na2SO4和Na2SO3;以此类推,+5、+3是氮元素常见的化合价,相应的钠盐有NaNO3和 (填化学式)。
(2)氢的氧化物有:水(H2O)与过氧化氢(H2O2);钠的氧化物有:氧化钠(Na2O)与过氧化钠
(Na2O2),以此类推过氧化钡的化学式为 。
(3)根据教材中一个类似的反应,类推出如下反应:SO3+2NaOH=Na2SO4+H2O,则这个类似反
应是____ _ _(填化学方程式)。
NaNO2
Ba(O2)2
CO2+2NaOH=Na2CO3+H2O
同课章节目录
