高中化学苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的电解池(14张ppt)
文档属性
| 名称 | 高中化学苏教版必修二专题2 化学反应与能量转化第三单元 化学能与电能的电解池(14张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-16 09:36:28 | ||
图片预览



文档简介
电解池
实例 被电解物质 电解产物 化学方程式
镁的制取 熔融氯化镁 氯气,金属镁
铝的制取 熔融氧化铝
氧气,金属铝
钠的制取 熔融氯化钠
氯气,金属钠
氯化铜溶液的电解 氯化铜溶液
MgCl2 Mg+Cl2
通电
2NaCl 2Na+Cl2
通电
2Al203 4Al+302
通电
?
?
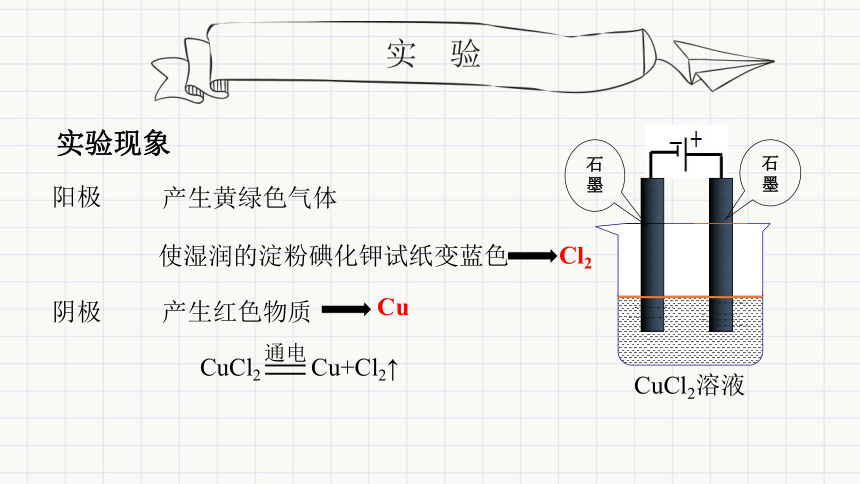
实 验
石墨
石墨
CuCl2溶液
实验现象
阴极
阳极
产生红色物质
产生黄绿色气体
使湿润的淀粉碘化钾试纸变蓝色
CuCl2 Cu+Cl2↑
通电
Cu
Cl2
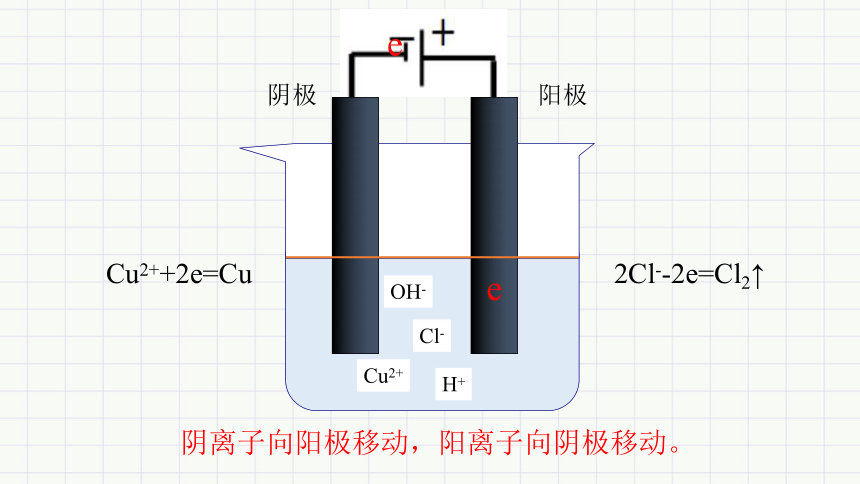
阴极
阳极
e
Cl-
OH-
e
Cu2++2e=Cu
2Cl--2e=Cl2↑
Cu2+
H+
阴离子向阳极移动,阳离子向阴极移动。
电解池阴阳离子放电顺序
阳极:阴离子失电子能力大小
①若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子 ;
②若阳极是惰性(Pt、Au、石墨),则放电顺序如下:
S2->I->Br->Cl- >OH->含氧酸根离子
阴极:阳离子得电子能力大小
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>
Fe2+>Zn2+> H+(H2O)>Al3+>Mg2+>Na+>Ca+>K+
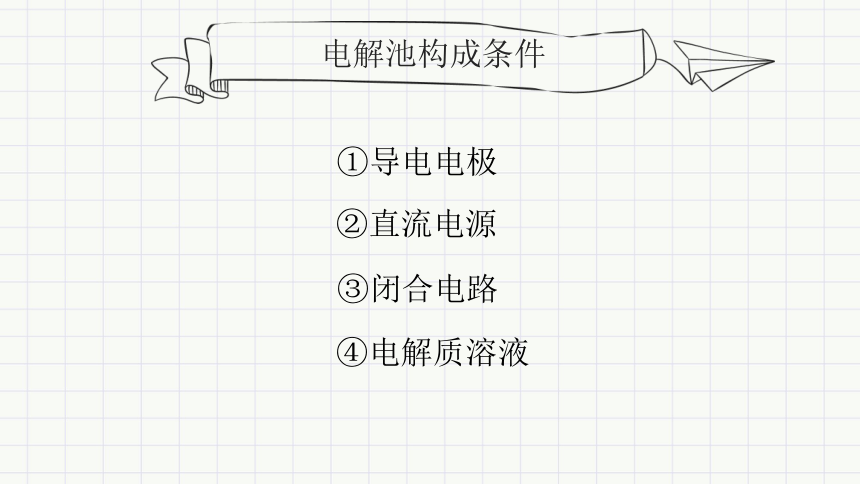
电解池构成条件
②直流电源
③闭合电路
④电解质溶液
①导电电极
Na+
oooooooooooooooooooo
ooooooooooooooooooooooo
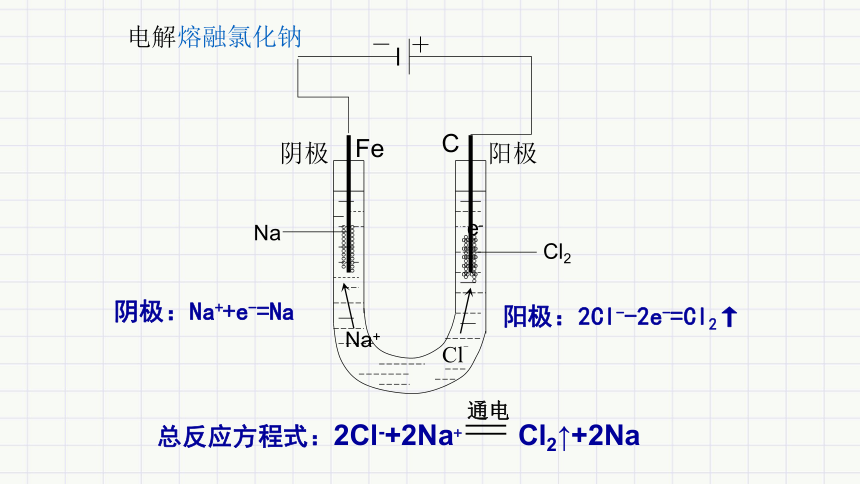
电解熔融氯化钠
- +
阴极
Na
Fe
阳极
Cl2
C
ooooooooooooooooooooooo
e-
阳极:2Cl--2e-=Cl2↑
阴极:Na++e-=Na
总反应方程式:2Cl-+2Na+ Cl2↑+2Na
通电
Na+
oooooooooooooooooooo
ooooooooooooooooooooooo
电解饱和食盐水
H+
- +
阴极
H2
Fe
阳极
Cl2
C
ooooooooooooooooooooooo
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑
总反应方程式:2Cl-+2H2O Cl2↑+H2↑+2OH-
通电
H2O
OH-
结论:参与电解的微粒不同,其电解反应和产物也不相同
电解池 原电池
判断依据
能量转换
电极
离子的迁移方向
发生氧化反应的电极
发生还原反应的电极
相同点
(从原理分析)
电能转化为化学能
化学能转化为电能
阳极、阴极
正极、负极
阴离子向阳极迁移
阳离子向阴极迁移
阴离子向负极迁移
阳离子向正极迁移
阳极(接电源正极)
负极
阴极(接电源负极)
正极
有外加直流电源
无外加直流电源
都是氧化还原反应
A
练 习
A
粗铜
纯铜
- +
纯铜作阴极,粗铜作阳极;
Ag Au
阳极
阴极
硫酸铜溶液
阳极泥
铜的电解精炼
e
铁上镀铜
Cu
Fe
CuSO4溶液
电镀:
电镀材料的选择:
阴极——镀件
阳极——镀层金属
电镀液——含有镀层金属离子的溶液
实例 被电解物质 电解产物 化学方程式
镁的制取 熔融氯化镁 氯气,金属镁
铝的制取 熔融氧化铝
氧气,金属铝
钠的制取 熔融氯化钠
氯气,金属钠
氯化铜溶液的电解 氯化铜溶液
MgCl2 Mg+Cl2
通电
2NaCl 2Na+Cl2
通电
2Al203 4Al+302
通电
?
?
实 验
石墨
石墨
CuCl2溶液
实验现象
阴极
阳极
产生红色物质
产生黄绿色气体
使湿润的淀粉碘化钾试纸变蓝色
CuCl2 Cu+Cl2↑
通电
Cu
Cl2
阴极
阳极
e
Cl-
OH-
e
Cu2++2e=Cu
2Cl--2e=Cl2↑
Cu2+
H+
阴离子向阳极移动,阳离子向阴极移动。
电解池阴阳离子放电顺序
阳极:阴离子失电子能力大小
①若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子 ;
②若阳极是惰性(Pt、Au、石墨),则放电顺序如下:
S2->I->Br->Cl- >OH->含氧酸根离子
阴极:阳离子得电子能力大小
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>
Fe2+>Zn2+> H+(H2O)>Al3+>Mg2+>Na+>Ca+>K+
电解池构成条件
②直流电源
③闭合电路
④电解质溶液
①导电电极
Na+
oooooooooooooooooooo
ooooooooooooooooooooooo
电解熔融氯化钠
- +
阴极
Na
Fe
阳极
Cl2
C
ooooooooooooooooooooooo
e-
阳极:2Cl--2e-=Cl2↑
阴极:Na++e-=Na
总反应方程式:2Cl-+2Na+ Cl2↑+2Na
通电
Na+
oooooooooooooooooooo
ooooooooooooooooooooooo
电解饱和食盐水
H+
- +
阴极
H2
Fe
阳极
Cl2
C
ooooooooooooooooooooooo
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑
总反应方程式:2Cl-+2H2O Cl2↑+H2↑+2OH-
通电
H2O
OH-
结论:参与电解的微粒不同,其电解反应和产物也不相同
电解池 原电池
判断依据
能量转换
电极
离子的迁移方向
发生氧化反应的电极
发生还原反应的电极
相同点
(从原理分析)
电能转化为化学能
化学能转化为电能
阳极、阴极
正极、负极
阴离子向阳极迁移
阳离子向阴极迁移
阴离子向负极迁移
阳离子向正极迁移
阳极(接电源正极)
负极
阴极(接电源负极)
正极
有外加直流电源
无外加直流电源
都是氧化还原反应
A
练 习
A
粗铜
纯铜
- +
纯铜作阴极,粗铜作阳极;
Ag Au
阳极
阴极
硫酸铜溶液
阳极泥
铜的电解精炼
e
铁上镀铜
Cu
Fe
CuSO4溶液
电镀:
电镀材料的选择:
阴极——镀件
阳极——镀层金属
电镀液——含有镀层金属离子的溶液
