高中化学苏教版必修二专题3 第二单元 原电池(24张ppt)
文档属性
| 名称 | 高中化学苏教版必修二专题3 第二单元 原电池(24张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-16 00:00:00 | ||
图片预览







文档简介
化学能转化为电能
啦啦原电池啦啦
00
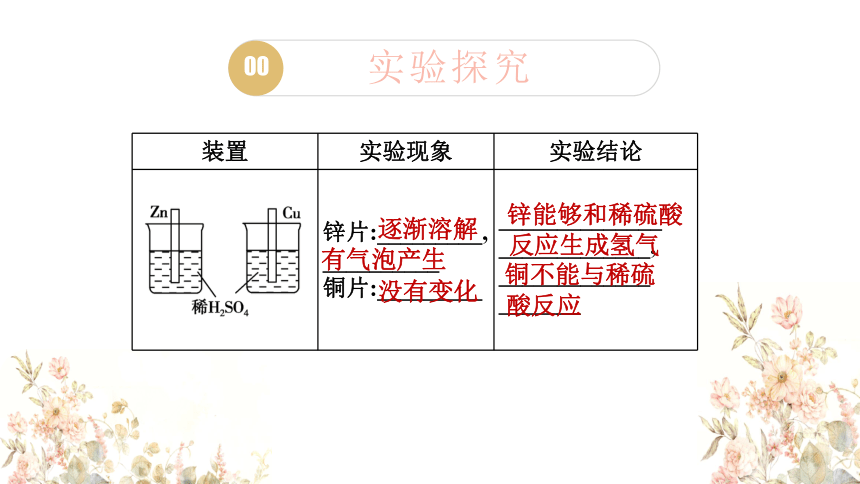
实验探究
装置 实验现象 实验结论
锌片:_________,
__________
铜片:_________ ______________
_____________,
_____________
_______
逐渐溶解
有气泡产生
没有变化
锌能够和稀硫酸
反应生成氢气
铜不能与稀硫
酸反应
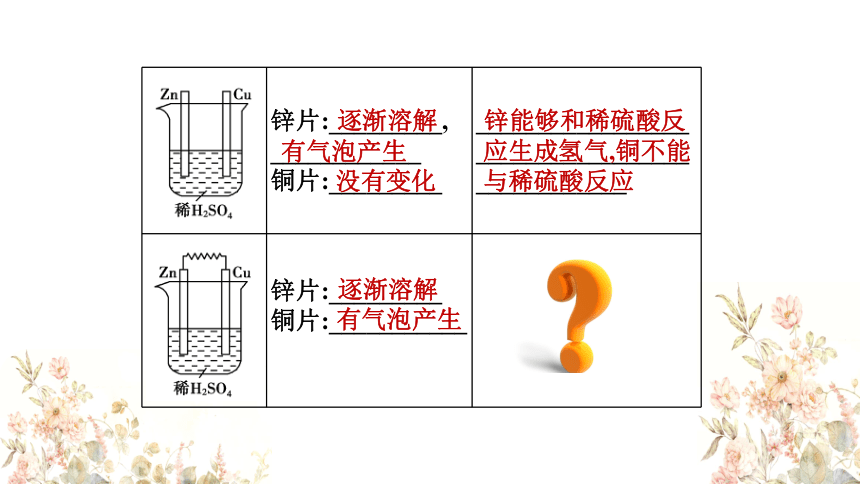
锌片:_________,
____________
铜片:_________ _________________
_________________
____________
锌片:_________
铜片:___________
逐渐溶解
有气泡产生
没有变化
锌能够和稀硫酸反
应生成氢气,铜不能
与稀硫酸反应
逐渐溶解
有气泡产生
01
基本概念
2H++2e=H2↑
Zn-2e=Zn2+
失电子,氧化反应
得电子,还原反应
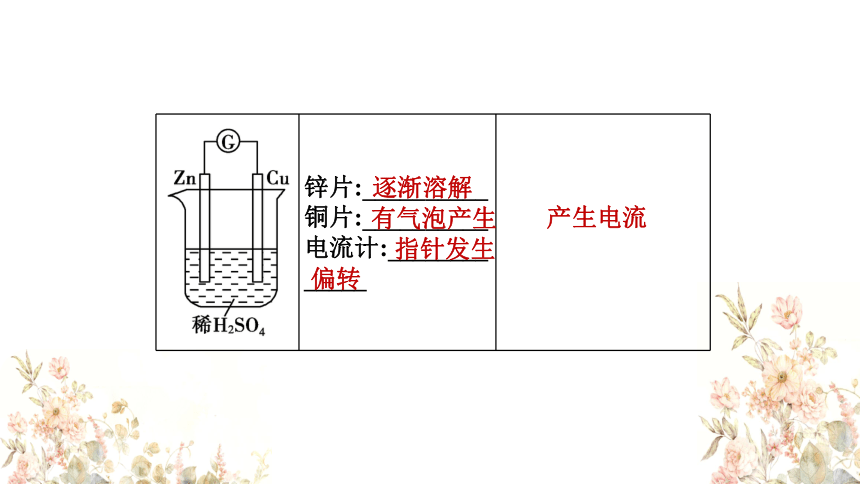
锌片:__________
铜片:__________
电流计:________
_____
逐渐溶解
有气泡产生
指针发生
偏转
产生电流
01
基本概念
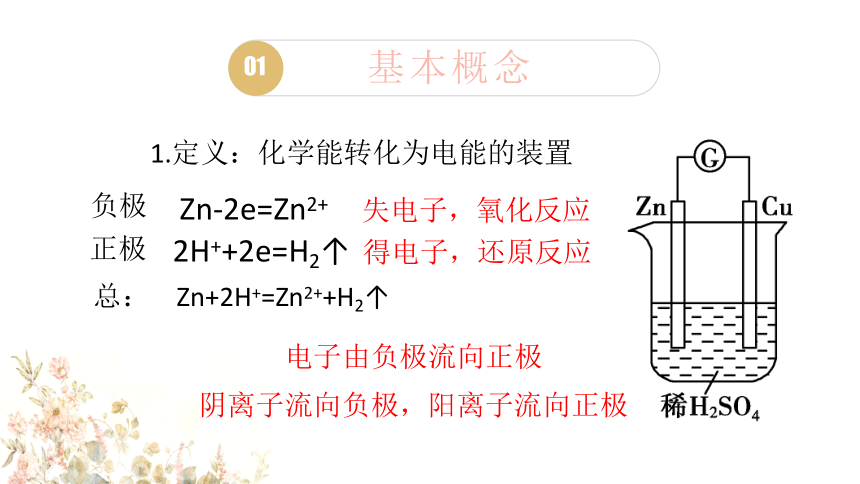
1.定义:化学能转化为电能的装置
2H++2e=H2↑
Zn-2e=Zn2+
总: Zn+2H+=Zn2++H2↑
阴离子流向负极,阳离子流向正极
电子由负极流向正极
失电子,氧化反应
得电子,还原反应
负极
正极
02
形成条件
①活泼性不同的电极
②能进行自发的氧化还原反应
③形成闭合回路
④电解质溶液
03
应用
①比较活泼性
原电池中,一般活泼性较强的金属为负极,活泼性较弱的金属为正极。
②加快氧化还原反应速率
③钢铁的电化学腐蚀
04
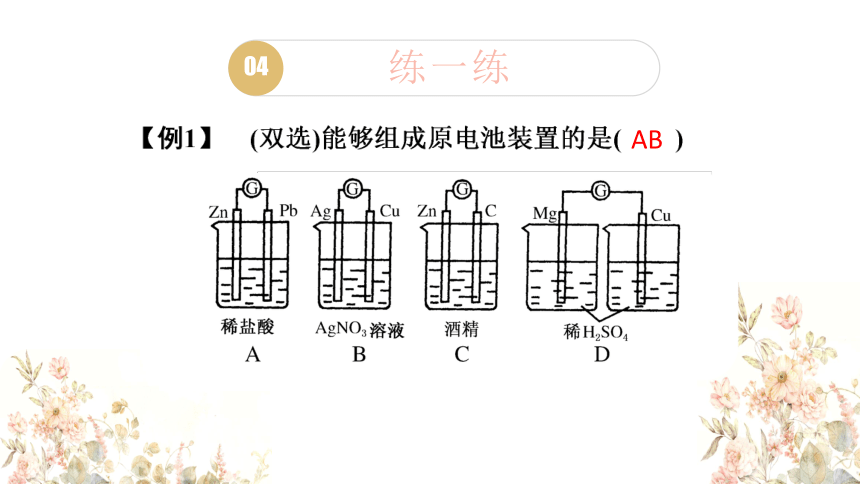
练一练
AB
04
练一练
A
04
练一练
D
04
练一练
D
04
练一练
A
04
练一练
乙醇
Cu
Cu
C
02
形成条件
①活泼性不同的电极
②能进行自发的氧化还原反应
③形成闭合回路
④电解质溶液
03
应用
①比较活泼性
原电池中,一般活泼性较强的金属为负极,活泼性较弱的金属为正极。
②加快氧化还原反应速率
③设计原电池
④钢铁的电化学腐蚀
利用 Cu+2FeCl3=CuCl2+2FeCl2 的氧化还原反应设计原电池
负极
Cu-2e-=Cu2+
正极
2Fe3++2e-=2Fe2+
钢铁的电化学腐蚀
1.电化学腐蚀
金属跟____________接触,发生原电池反应,比较
活泼的金属失去电子而被氧化的腐蚀。
2.钢铁的腐蚀
(1)条件
①电极:铁和少量___形成两个电极。
②电解质溶液:水中溶有少量__________及____等气体。
(2)电极反应(以吸氧腐蚀为例)
①负极反应式(Fe):________________。
②正极反应式(C):________________________。
电解质溶液
H+和OH-
氧气
碳
Fe-2e-===Fe2+
2H2O+O2+4e-===4OH-
04
练一练
A
总反应:Zn+ 2MnO2+2NH4+ ==== Zn2++ 2MnO(OH)+2NH3
01
回 顾
2H++2e=H2↑
Zn-2e=Zn2+
失电子,氧化反应
得电子,还原反应
普通锌锰电池
碱性电池
镍镉电池
小型高性能燃料电池
锂离子电池
镍氢电池
干电池
负极(锌筒)Zn-2e- ====Zn2+
正极(石墨)2MnO2+2NH4+ +2e- ====2MnO(OH)+2NH3
总反应:Zn+ 2MnO2+2NH4+ ==== Zn2++ 2MnO(OH)+2NH3
二、化学电源
1.化学电源的分类
(1)_____电池:用过之后不能复原,如锌锰干电池。
(2)_____电池:充电之后能够继续使用,如铅蓄电池。
2.常见的化学电源
(1)锌锰干电池。锌筒为负极,石墨为正极,
Zn +2NH4Cl +2MnO2===Zn(NH3)2Cl2+2MnO(OH)。
二次
①正极材料为______,负极材料为___,电解质为_______。
一次
(2)铅蓄电池。
PbO2
Pb
稀硫酸
资 料:
银锌原电池是用不锈钢制成的小圆盒,形似纽扣,故称纽扣电池。盒内一端填充氧化银和石墨组成的活性材料,另一端填充锌汞合金组成的活性材料。电极反应如下:
总反应:Zn+Ag2O+H20====Zn(OH)2+2Ag
锌是 极,发生 反应;
氧化银是 极,发生 反应。
电解质溶液:
电极方程式: .
负
氧化
正
还原
锌:Zn + 2OH- - 2e-== Zn(OH)2
氧化银:Ag2O + H2O + 2e- ==== 2Ag +2OH-
氢氧化钾
铅蓄电池
1.电极材料及原料
2.电解质溶液
PbO2 Pb
H2SO4溶液
Pb-2e-+SO4 2 -====PbSO4
Pb+PbO2 +2H2SO4 ====2PbSO4 + 2H2O
PbO2+4H++SO42 -+ 2e- ====PbSO4+2H2O
总反应:
3.优点
4.应用领域
电压稳定,使用方便、安全、可靠,可以循环使用
广泛用于国防、科研、交通、生产和生活
负极:
正极:
5.反应式:
负极 正极
1.电极材料及原料
2.电解质溶液
3.优点
4.应用领域
锂电池
正极:金属氧化物 负极:锂
使用寿命长,质量轻、电压高、工作效率高、体积小
有机溶剂
电脑、照相机、手表、心脏起搏器
索尼数码相机锂电池
新型燃料电池
1.氢氧燃料电池
燃料电池是继水力、火力、核能发电之后的第四类发电—化学能发电
负极: 2H2 +4OH--4e-====4H2O
正极: O2+2H2O+4e-====4OH-
2H2 + O2 ==== 2H2O
燃料电池的反应方程式:
当电解质为氢氧化钾溶液时
当电解质为硫酸溶液时
负极: 2H2 -4e- === 4H+
正极: O2+4H++4e-====2H2O
燃料电池
把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”
常见的燃料电池还有甲烷燃料电池、铝—空气燃料电池、熔融盐燃料电池等
优点:效率高、无污染,装置可持续使用
多孔性金属电极,具有催化性能
甲醇-空气 燃料电池 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
负极
正极
2.磷酸型燃料电池
以磷酸为电解质,利用廉价的碳材料为骨架。除了以氢气为燃料外,还可使用甲醇、天然气、城市煤气等低廉燃料,是目前最成熟的燃料电池。
目前世界上大容量的燃料电池发电厂,都使用磷酸型燃料电池。如东京电能公司经营的11MW美日合作磷酸型燃料电池发电厂。
3.海水电池
1991年,我国首创以铝-空气-海水为能源的新型电池,用作航海标志灯。该电池以取之不尽的海水为电解质,靠空气中的氧气使铝不断氧化而产生电流。
这种海水电池的能量比“干电池”高20~50倍。
电极反应式为:
负极:
正极:
电池总反应:
4Al-12e- ====4Al3+
3O2+ 6H2O +12e- ==== 12OH -
4Al+3O2+ 6H2O ==== 4Al(OH)3
啦啦原电池啦啦
00
实验探究
装置 实验现象 实验结论
锌片:_________,
__________
铜片:_________ ______________
_____________,
_____________
_______
逐渐溶解
有气泡产生
没有变化
锌能够和稀硫酸
反应生成氢气
铜不能与稀硫
酸反应
锌片:_________,
____________
铜片:_________ _________________
_________________
____________
锌片:_________
铜片:___________
逐渐溶解
有气泡产生
没有变化
锌能够和稀硫酸反
应生成氢气,铜不能
与稀硫酸反应
逐渐溶解
有气泡产生
01
基本概念
2H++2e=H2↑
Zn-2e=Zn2+
失电子,氧化反应
得电子,还原反应
锌片:__________
铜片:__________
电流计:________
_____
逐渐溶解
有气泡产生
指针发生
偏转
产生电流
01
基本概念
1.定义:化学能转化为电能的装置
2H++2e=H2↑
Zn-2e=Zn2+
总: Zn+2H+=Zn2++H2↑
阴离子流向负极,阳离子流向正极
电子由负极流向正极
失电子,氧化反应
得电子,还原反应
负极
正极
02
形成条件
①活泼性不同的电极
②能进行自发的氧化还原反应
③形成闭合回路
④电解质溶液
03
应用
①比较活泼性
原电池中,一般活泼性较强的金属为负极,活泼性较弱的金属为正极。
②加快氧化还原反应速率
③钢铁的电化学腐蚀
04
练一练
AB
04
练一练
A
04
练一练
D
04
练一练
D
04
练一练
A
04
练一练
乙醇
Cu
Cu
C
02
形成条件
①活泼性不同的电极
②能进行自发的氧化还原反应
③形成闭合回路
④电解质溶液
03
应用
①比较活泼性
原电池中,一般活泼性较强的金属为负极,活泼性较弱的金属为正极。
②加快氧化还原反应速率
③设计原电池
④钢铁的电化学腐蚀
利用 Cu+2FeCl3=CuCl2+2FeCl2 的氧化还原反应设计原电池
负极
Cu-2e-=Cu2+
正极
2Fe3++2e-=2Fe2+
钢铁的电化学腐蚀
1.电化学腐蚀
金属跟____________接触,发生原电池反应,比较
活泼的金属失去电子而被氧化的腐蚀。
2.钢铁的腐蚀
(1)条件
①电极:铁和少量___形成两个电极。
②电解质溶液:水中溶有少量__________及____等气体。
(2)电极反应(以吸氧腐蚀为例)
①负极反应式(Fe):________________。
②正极反应式(C):________________________。
电解质溶液
H+和OH-
氧气
碳
Fe-2e-===Fe2+
2H2O+O2+4e-===4OH-
04
练一练
A
总反应:Zn+ 2MnO2+2NH4+ ==== Zn2++ 2MnO(OH)+2NH3
01
回 顾
2H++2e=H2↑
Zn-2e=Zn2+
失电子,氧化反应
得电子,还原反应
普通锌锰电池
碱性电池
镍镉电池
小型高性能燃料电池
锂离子电池
镍氢电池
干电池
负极(锌筒)Zn-2e- ====Zn2+
正极(石墨)2MnO2+2NH4+ +2e- ====2MnO(OH)+2NH3
总反应:Zn+ 2MnO2+2NH4+ ==== Zn2++ 2MnO(OH)+2NH3
二、化学电源
1.化学电源的分类
(1)_____电池:用过之后不能复原,如锌锰干电池。
(2)_____电池:充电之后能够继续使用,如铅蓄电池。
2.常见的化学电源
(1)锌锰干电池。锌筒为负极,石墨为正极,
Zn +2NH4Cl +2MnO2===Zn(NH3)2Cl2+2MnO(OH)。
二次
①正极材料为______,负极材料为___,电解质为_______。
一次
(2)铅蓄电池。
PbO2
Pb
稀硫酸
资 料:
银锌原电池是用不锈钢制成的小圆盒,形似纽扣,故称纽扣电池。盒内一端填充氧化银和石墨组成的活性材料,另一端填充锌汞合金组成的活性材料。电极反应如下:
总反应:Zn+Ag2O+H20====Zn(OH)2+2Ag
锌是 极,发生 反应;
氧化银是 极,发生 反应。
电解质溶液:
电极方程式: .
负
氧化
正
还原
锌:Zn + 2OH- - 2e-== Zn(OH)2
氧化银:Ag2O + H2O + 2e- ==== 2Ag +2OH-
氢氧化钾
铅蓄电池
1.电极材料及原料
2.电解质溶液
PbO2 Pb
H2SO4溶液
Pb-2e-+SO4 2 -====PbSO4
Pb+PbO2 +2H2SO4 ====2PbSO4 + 2H2O
PbO2+4H++SO42 -+ 2e- ====PbSO4+2H2O
总反应:
3.优点
4.应用领域
电压稳定,使用方便、安全、可靠,可以循环使用
广泛用于国防、科研、交通、生产和生活
负极:
正极:
5.反应式:
负极 正极
1.电极材料及原料
2.电解质溶液
3.优点
4.应用领域
锂电池
正极:金属氧化物 负极:锂
使用寿命长,质量轻、电压高、工作效率高、体积小
有机溶剂
电脑、照相机、手表、心脏起搏器
索尼数码相机锂电池
新型燃料电池
1.氢氧燃料电池
燃料电池是继水力、火力、核能发电之后的第四类发电—化学能发电
负极: 2H2 +4OH--4e-====4H2O
正极: O2+2H2O+4e-====4OH-
2H2 + O2 ==== 2H2O
燃料电池的反应方程式:
当电解质为氢氧化钾溶液时
当电解质为硫酸溶液时
负极: 2H2 -4e- === 4H+
正极: O2+4H++4e-====2H2O
燃料电池
把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”
常见的燃料电池还有甲烷燃料电池、铝—空气燃料电池、熔融盐燃料电池等
优点:效率高、无污染,装置可持续使用
多孔性金属电极,具有催化性能
甲醇-空气 燃料电池 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
负极
正极
2.磷酸型燃料电池
以磷酸为电解质,利用廉价的碳材料为骨架。除了以氢气为燃料外,还可使用甲醇、天然气、城市煤气等低廉燃料,是目前最成熟的燃料电池。
目前世界上大容量的燃料电池发电厂,都使用磷酸型燃料电池。如东京电能公司经营的11MW美日合作磷酸型燃料电池发电厂。
3.海水电池
1991年,我国首创以铝-空气-海水为能源的新型电池,用作航海标志灯。该电池以取之不尽的海水为电解质,靠空气中的氧气使铝不断氧化而产生电流。
这种海水电池的能量比“干电池”高20~50倍。
电极反应式为:
负极:
正极:
电池总反应:
4Al-12e- ====4Al3+
3O2+ 6H2O +12e- ==== 12OH -
4Al+3O2+ 6H2O ==== 4Al(OH)3
