人教版 高中生物选修一专题5 课题3 血红蛋白的提取与分离 课件(32PPT)
文档属性
| 名称 | 人教版 高中生物选修一专题5 课题3 血红蛋白的提取与分离 课件(32PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2019-04-19 00:00:00 | ||
图片预览









文档简介
课题 3
血红蛋白的提取和分离
蛋白质是生命活动不可缺少的物质。随着人类基因组计划的进展以及多种生物基因组测序工作的完成,人类跨入了后基因组和蛋白质组时代。对蛋白质的研究与应用,首先需要获得纯度较高的蛋白质。因此,从复杂的细胞混合物中提取、分离高纯度的蛋白质是生物科学研究中经常要做的工作。 血红蛋白是人和其他脊椎动物红细胞的主要组成成分负责血液中O2和CO2的运偷。在本课题中,我们将以血红蛋白为实验材抖,学习蛋白质提取和分离的一些基本才技术
课题背景
根据蛋白质各种特性的差异,
如分子的形状和大小、所带电荷的性质和多少、溶解度和吸附的性质和对其他分子的亲和力等等,可以用来分离不同蛋白质。
基础知识
1、凝胶色谱法:分配色谱法
根据蛋白质相对分子质量的大小,利用具有多孔结构的凝胶的分子筛作用,来进行分离蛋白质的方法。
2、凝胶
①性质:一些微小的多孔球体,球内含许多贯穿的通道;
②化学本质:多糖类化合物:
③实例:葡聚糖、琼脂糖:
5、具体过程
基础知识 (一) 凝胶色谱法
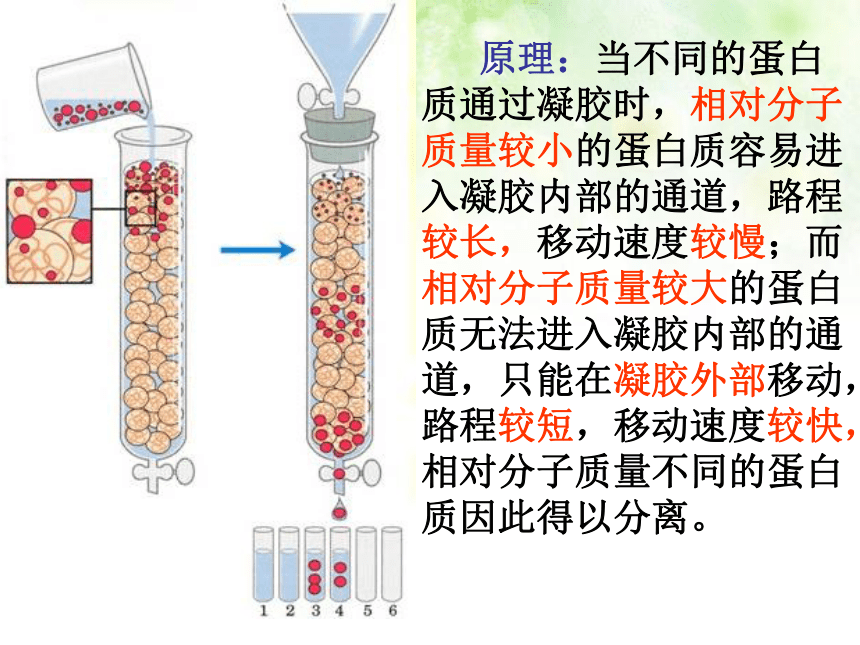
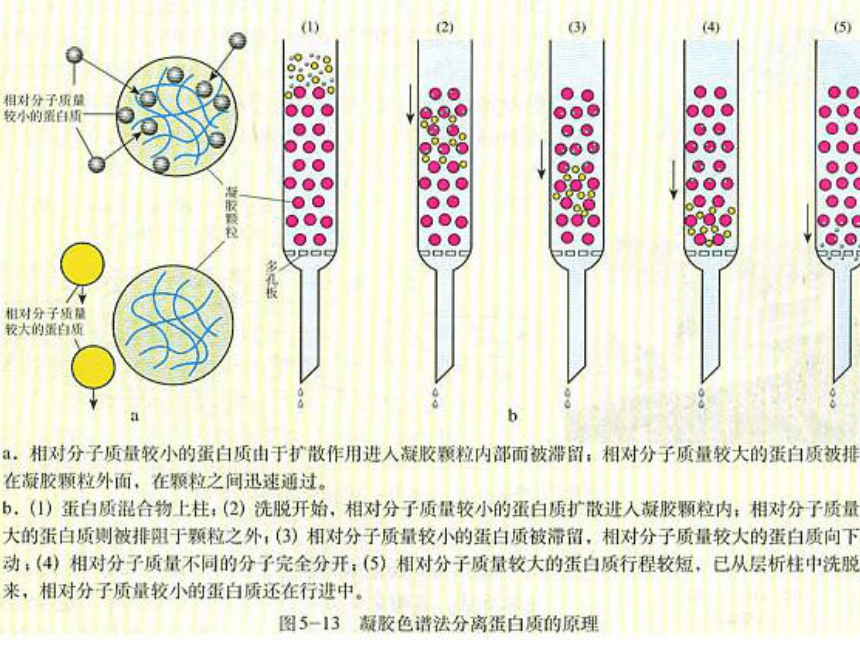
原理:当不同的蛋白质通过凝胶时,相对分子质量较小的蛋白质容易进入凝胶内部的通道,路程较长,移动速度较慢;而相对分子质量较大的蛋白质无法进入凝胶内部的通道,只能在凝胶外部移动,路程较短,移动速度较快,相对分子质量不同的蛋白质因此得以分离。
1、缓冲溶液概念、作用
在一定的范围内,能抵制外界酸或碱对溶液PH的影响,维持其PH值基本不变,具有这样缓冲作用的溶液叫做缓冲溶液。
2、缓冲溶液配制
通常由1-2种缓冲剂溶解于水中配制而成。调节缓冲剂的使用比例就可以制得在不同PH范围内使用的缓冲液。
基础知识 (二)缓冲溶液
①弱酸和弱酸盐组合
H2CO3/NaHCO3
CH3COOH/CH3COONa
3、缓冲溶液的组分分类
②弱碱和弱碱盐
③多元弱酸的酸式盐和其他所对应的次级盐
NH4OH /NH4CI
NaH2PO4 /Na2HPO4
KH2PO4 /K2HPO4
该课题使用的是磷酸缓冲液,目的是利用缓冲液模拟细胞内的PH环境,保证血红蛋白的正常结构和功能,便于观察(红色)和科学研究(活性)。
2、原理:许多重要的生物大分子,( )等都具有( ) 在( )下,这些基团会带上( ) 。在电场的作用下,这些带电分子会向着与其( )移动。电泳利用了待分离样品中各种分子( )以及分子本身( )、( )的不同使带电分子产生不同的( ),从而实现样品中各种分子的分离。
多肽、核酸
可解离的基团
正电或负电
所带电荷相反的电极
带电性质的差异
大小
形状
迁移速度
一定的PH
基础知识 (三)电泳
1、概念
带电粒子在电场作用下发生迁移的过程。
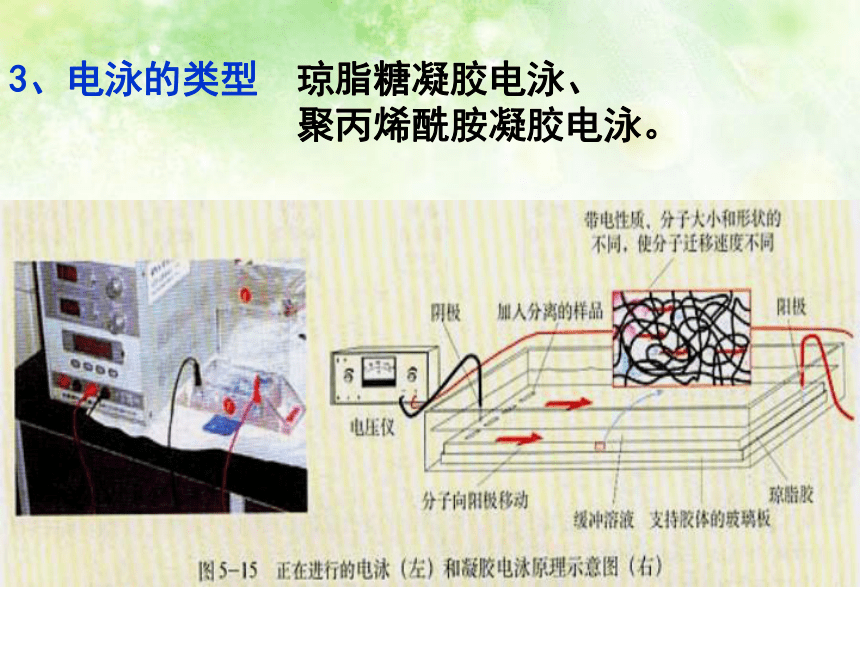
琼脂糖凝胶电泳、
聚丙烯酰胺凝胶电泳。
3、电泳的类型
SDS—聚丙烯酰胺凝胶电泳
测定蛋白质分子量。
①应用
②聚丙烯酰胺凝胶
蛋白质在聚丙烯酰胺凝胶中的迁移率取决于它所带静电荷的多少以及分子的大小等因素。
③原理
4、实例
④ SDS作用
为了消除静电荷对迁移率的影响可以在凝胶中加入SDS。
SDS能使蛋白质发生完全变性。由几条肽链组成的蛋白质复合体在SDS的作用下会解聚成单条肽链,因此测定的结果只是单条肽链的分子量。SDS能与各种蛋白质形成蛋白质—SDS复合物,SDS所带负电荷的量大大超过了蛋白质分子原有电荷量。因而掩盖了不同种电荷间的电荷差别,使电泳迁移率完全取决于分子的大小。
⑤ SDS作用机理
讨论:如何测定蛋白质的分子量?
使用SDS—聚丙烯酰胺凝胶电泳测定蛋白质的分子量时,可选用一组已知分子量的标准蛋白同时进行电泳,根据已知分子量的标准蛋白的电泳区带位置,用电泳迁移率和分子量的对数作标准曲线,可以测定未知蛋白质的分子量。(市场上有高分子量、次高分子量及低分子量的标准蛋白试剂出售)
实验操作
(一)样品处理
样品处理——粗分离——纯化——纯度鉴定
问:蛋白质提取和分离步骤?
①血液组成
血液由血浆和各种血细胞组成,其中红细胞最多。在红细胞的组成中,约90%是血红蛋白。血红蛋白由四个肽链组成(如图),包括两个α-肽链和两个β-肽链。其中每条肽链环绕一个亚铁血红素基团,此基团可携带一分子氧或一分子二氧化碳。血红蛋白因含有血红素而呈现红色。
②选材
本课题可选用猪、牛、羊或其他脊椎动物的血液来分离血红蛋白。预先加入柠檬酸钠,防止血液凝固。
目的:去除杂蛋白,以利于后续步骤的分离纯化。采集的血样
分离红细胞:分离时采用低速短时间离心,如500 r/min离心2min,然后用胶头吸管吸出上层透明的黄色血浆,将下层暗红色的红细胞液倒入烧杯
洗涤:加入五倍体积的生理盐水(质量分数为0.9%的NaCl溶液),缓慢搅拌10min,低速短时间离心,如此重复洗涤三次,直至上清液中没有黄色,表明红细胞已洗涤干净。
1.红细胞的洗涤
2.血红蛋白的释放
将洗涤好的红细胞倒入烧杯中,加蒸馏水到原血液的体积,再加40%体积的甲苯,置于磁力搅拌器上充分搅拌10 min。在蒸馏水和甲苯的作用下,红细胞破裂,释放出血红蛋白。
蒸馏水作用:使细胞吸水胀破
甲苯的作用:溶解细胞膜,加速细胞破裂,释放血红蛋白。
3.分离血红蛋白溶液
离心分层:2000r/min 10min
第三层为血红蛋白溶液
过滤:除去脂溶性深沉层,取滤液(血红蛋白水溶液)
分液漏斗:静置片刻,取下层
红色透明液体
取1mL的血红蛋白溶液装入透析袋中,将透析袋放入盛有300mL的物质的量浓度为20mmol/L的磷酸缓冲液中(pH为7.0),透析12h。
4.透析
透析目的是:除去样品中分子量较小的杂质。
说明:透析袋是一种半透膜,能使小分子自由进出,而大分 子不能通过。
实验操作 (二)凝胶色谱操作
1.凝胶色谱柱的制作
2.凝胶色谱柱的装填
固定色谱柱
配凝胶悬液
装填色谱柱
计算所需凝胶量
蒸馏水溶胀
凝胶装填时尽量紧密,以降低凝胶颗粒之间的空隙; 装填凝胶柱时不得气泡存在。(因为气泡会扰乱洗脱液中蛋白质的洗脱次序,降低分离效果。)
垂直固定在支架上
装填完毕后,立即用缓冲液洗脱瓶,在50cm高的操作压下,用300mL的20mmol/L的磷酸缓冲液(pH为7.0)充分洗涤平衡12h。
洗涤平衡
1、液面不要低于凝胶表面,否则可能有气泡混入,影响液体在柱内的流动与最终生物大分子物质的分离效果;
2、不能发生洗脱液流干,露出凝胶颗粒的现象。
3.样品的加入和洗脱
①调节缓冲液面
加样前,打开色谱柱下端的流出口,使柱内凝胶面上的缓冲液缓慢下降到与凝胶面平齐,关闭出口。
②滴加透析样品
吸管吸1mL样品加到色谱柱的顶端,滴加样品时,吸管管口贴着管壁环绕移动加样,同时注意不要破坏凝胶面。
实验操作 (二)凝胶色谱操作
③样品渗入凝胶床
加样后,打开下端出口,使样品渗入凝胶床内。等样品完全进入凝胶层后,关闭下端出口。
④洗脱
小心加入物质的量浓度为20 mmol/L的磷酸缓冲液(pH为7.0)到适当高度,连接缓冲液洗脱瓶,打开下端出口,进行洗脱。
实验操作 (二)凝胶色谱操作
⑤收集:
待红色的蛋白质接近色谱柱底端时,用试管收集流出液,每5ml一试管,连续收集。(在分离过程中,如果红色区带均匀一致的移动,说明色谱柱制作成功)。
答:让血红蛋白处在稳定的pH范围内,维持结构和功能。
讨论: 1、在血红蛋白的整个过程中不断用磷酸缓冲液处理的目的是什么?
实验操作 (二)凝胶色谱操作
讨论: 2、与其他真核细胞相比,红细胞有什么特点?这一特点对你进行蛋白质得分离有什么意义?
答:血红蛋白是有色蛋白,因此在凝胶色谱分离时可以通过观察颜色来判断什么时候应该收集洗脱液。这使血红蛋白的分离过程非常直观,大大简化了实验操作。
血红蛋白提取和分离的程序可分为四大步,包括:样品处理、粗分离、纯化和纯度鉴定。首先通过洗涤红细胞、血红蛋白的释放、离心等操作收集到血红蛋白溶液,即样品的处理;再经过透析去除分子量较小的杂质,即样品的粗分离;然后通过凝胶色谱法将相对分子质量较大杂质蛋白除去,即样品的纯化;最后经聚丙烯酰胺凝胶电泳进行纯度鉴定。
讨论: 3、你能描述血红蛋白分离的完整过程吗?
实验操作 (二)凝胶色谱操作
血红蛋白的提取和分离
蛋白质是生命活动不可缺少的物质。随着人类基因组计划的进展以及多种生物基因组测序工作的完成,人类跨入了后基因组和蛋白质组时代。对蛋白质的研究与应用,首先需要获得纯度较高的蛋白质。因此,从复杂的细胞混合物中提取、分离高纯度的蛋白质是生物科学研究中经常要做的工作。 血红蛋白是人和其他脊椎动物红细胞的主要组成成分负责血液中O2和CO2的运偷。在本课题中,我们将以血红蛋白为实验材抖,学习蛋白质提取和分离的一些基本才技术
课题背景
根据蛋白质各种特性的差异,
如分子的形状和大小、所带电荷的性质和多少、溶解度和吸附的性质和对其他分子的亲和力等等,可以用来分离不同蛋白质。
基础知识
1、凝胶色谱法:分配色谱法
根据蛋白质相对分子质量的大小,利用具有多孔结构的凝胶的分子筛作用,来进行分离蛋白质的方法。
2、凝胶
①性质:一些微小的多孔球体,球内含许多贯穿的通道;
②化学本质:多糖类化合物:
③实例:葡聚糖、琼脂糖:
5、具体过程
基础知识 (一) 凝胶色谱法
原理:当不同的蛋白质通过凝胶时,相对分子质量较小的蛋白质容易进入凝胶内部的通道,路程较长,移动速度较慢;而相对分子质量较大的蛋白质无法进入凝胶内部的通道,只能在凝胶外部移动,路程较短,移动速度较快,相对分子质量不同的蛋白质因此得以分离。
1、缓冲溶液概念、作用
在一定的范围内,能抵制外界酸或碱对溶液PH的影响,维持其PH值基本不变,具有这样缓冲作用的溶液叫做缓冲溶液。
2、缓冲溶液配制
通常由1-2种缓冲剂溶解于水中配制而成。调节缓冲剂的使用比例就可以制得在不同PH范围内使用的缓冲液。
基础知识 (二)缓冲溶液
①弱酸和弱酸盐组合
H2CO3/NaHCO3
CH3COOH/CH3COONa
3、缓冲溶液的组分分类
②弱碱和弱碱盐
③多元弱酸的酸式盐和其他所对应的次级盐
NH4OH /NH4CI
NaH2PO4 /Na2HPO4
KH2PO4 /K2HPO4
该课题使用的是磷酸缓冲液,目的是利用缓冲液模拟细胞内的PH环境,保证血红蛋白的正常结构和功能,便于观察(红色)和科学研究(活性)。
2、原理:许多重要的生物大分子,( )等都具有( ) 在( )下,这些基团会带上( ) 。在电场的作用下,这些带电分子会向着与其( )移动。电泳利用了待分离样品中各种分子( )以及分子本身( )、( )的不同使带电分子产生不同的( ),从而实现样品中各种分子的分离。
多肽、核酸
可解离的基团
正电或负电
所带电荷相反的电极
带电性质的差异
大小
形状
迁移速度
一定的PH
基础知识 (三)电泳
1、概念
带电粒子在电场作用下发生迁移的过程。
琼脂糖凝胶电泳、
聚丙烯酰胺凝胶电泳。
3、电泳的类型
SDS—聚丙烯酰胺凝胶电泳
测定蛋白质分子量。
①应用
②聚丙烯酰胺凝胶
蛋白质在聚丙烯酰胺凝胶中的迁移率取决于它所带静电荷的多少以及分子的大小等因素。
③原理
4、实例
④ SDS作用
为了消除静电荷对迁移率的影响可以在凝胶中加入SDS。
SDS能使蛋白质发生完全变性。由几条肽链组成的蛋白质复合体在SDS的作用下会解聚成单条肽链,因此测定的结果只是单条肽链的分子量。SDS能与各种蛋白质形成蛋白质—SDS复合物,SDS所带负电荷的量大大超过了蛋白质分子原有电荷量。因而掩盖了不同种电荷间的电荷差别,使电泳迁移率完全取决于分子的大小。
⑤ SDS作用机理
讨论:如何测定蛋白质的分子量?
使用SDS—聚丙烯酰胺凝胶电泳测定蛋白质的分子量时,可选用一组已知分子量的标准蛋白同时进行电泳,根据已知分子量的标准蛋白的电泳区带位置,用电泳迁移率和分子量的对数作标准曲线,可以测定未知蛋白质的分子量。(市场上有高分子量、次高分子量及低分子量的标准蛋白试剂出售)
实验操作
(一)样品处理
样品处理——粗分离——纯化——纯度鉴定
问:蛋白质提取和分离步骤?
①血液组成
血液由血浆和各种血细胞组成,其中红细胞最多。在红细胞的组成中,约90%是血红蛋白。血红蛋白由四个肽链组成(如图),包括两个α-肽链和两个β-肽链。其中每条肽链环绕一个亚铁血红素基团,此基团可携带一分子氧或一分子二氧化碳。血红蛋白因含有血红素而呈现红色。
②选材
本课题可选用猪、牛、羊或其他脊椎动物的血液来分离血红蛋白。预先加入柠檬酸钠,防止血液凝固。
目的:去除杂蛋白,以利于后续步骤的分离纯化。采集的血样
分离红细胞:分离时采用低速短时间离心,如500 r/min离心2min,然后用胶头吸管吸出上层透明的黄色血浆,将下层暗红色的红细胞液倒入烧杯
洗涤:加入五倍体积的生理盐水(质量分数为0.9%的NaCl溶液),缓慢搅拌10min,低速短时间离心,如此重复洗涤三次,直至上清液中没有黄色,表明红细胞已洗涤干净。
1.红细胞的洗涤
2.血红蛋白的释放
将洗涤好的红细胞倒入烧杯中,加蒸馏水到原血液的体积,再加40%体积的甲苯,置于磁力搅拌器上充分搅拌10 min。在蒸馏水和甲苯的作用下,红细胞破裂,释放出血红蛋白。
蒸馏水作用:使细胞吸水胀破
甲苯的作用:溶解细胞膜,加速细胞破裂,释放血红蛋白。
3.分离血红蛋白溶液
离心分层:2000r/min 10min
第三层为血红蛋白溶液
过滤:除去脂溶性深沉层,取滤液(血红蛋白水溶液)
分液漏斗:静置片刻,取下层
红色透明液体
取1mL的血红蛋白溶液装入透析袋中,将透析袋放入盛有300mL的物质的量浓度为20mmol/L的磷酸缓冲液中(pH为7.0),透析12h。
4.透析
透析目的是:除去样品中分子量较小的杂质。
说明:透析袋是一种半透膜,能使小分子自由进出,而大分 子不能通过。
实验操作 (二)凝胶色谱操作
1.凝胶色谱柱的制作
2.凝胶色谱柱的装填
固定色谱柱
配凝胶悬液
装填色谱柱
计算所需凝胶量
蒸馏水溶胀
凝胶装填时尽量紧密,以降低凝胶颗粒之间的空隙; 装填凝胶柱时不得气泡存在。(因为气泡会扰乱洗脱液中蛋白质的洗脱次序,降低分离效果。)
垂直固定在支架上
装填完毕后,立即用缓冲液洗脱瓶,在50cm高的操作压下,用300mL的20mmol/L的磷酸缓冲液(pH为7.0)充分洗涤平衡12h。
洗涤平衡
1、液面不要低于凝胶表面,否则可能有气泡混入,影响液体在柱内的流动与最终生物大分子物质的分离效果;
2、不能发生洗脱液流干,露出凝胶颗粒的现象。
3.样品的加入和洗脱
①调节缓冲液面
加样前,打开色谱柱下端的流出口,使柱内凝胶面上的缓冲液缓慢下降到与凝胶面平齐,关闭出口。
②滴加透析样品
吸管吸1mL样品加到色谱柱的顶端,滴加样品时,吸管管口贴着管壁环绕移动加样,同时注意不要破坏凝胶面。
实验操作 (二)凝胶色谱操作
③样品渗入凝胶床
加样后,打开下端出口,使样品渗入凝胶床内。等样品完全进入凝胶层后,关闭下端出口。
④洗脱
小心加入物质的量浓度为20 mmol/L的磷酸缓冲液(pH为7.0)到适当高度,连接缓冲液洗脱瓶,打开下端出口,进行洗脱。
实验操作 (二)凝胶色谱操作
⑤收集:
待红色的蛋白质接近色谱柱底端时,用试管收集流出液,每5ml一试管,连续收集。(在分离过程中,如果红色区带均匀一致的移动,说明色谱柱制作成功)。
答:让血红蛋白处在稳定的pH范围内,维持结构和功能。
讨论: 1、在血红蛋白的整个过程中不断用磷酸缓冲液处理的目的是什么?
实验操作 (二)凝胶色谱操作
讨论: 2、与其他真核细胞相比,红细胞有什么特点?这一特点对你进行蛋白质得分离有什么意义?
答:血红蛋白是有色蛋白,因此在凝胶色谱分离时可以通过观察颜色来判断什么时候应该收集洗脱液。这使血红蛋白的分离过程非常直观,大大简化了实验操作。
血红蛋白提取和分离的程序可分为四大步,包括:样品处理、粗分离、纯化和纯度鉴定。首先通过洗涤红细胞、血红蛋白的释放、离心等操作收集到血红蛋白溶液,即样品的处理;再经过透析去除分子量较小的杂质,即样品的粗分离;然后通过凝胶色谱法将相对分子质量较大杂质蛋白除去,即样品的纯化;最后经聚丙烯酰胺凝胶电泳进行纯度鉴定。
讨论: 3、你能描述血红蛋白分离的完整过程吗?
实验操作 (二)凝胶色谱操作
同课章节目录
- 专题1 传统发酵技术的应用
- 课题1 果酒和果醋的制作
- 课题2 腐乳的制作
- 课题3 制作泡菜并检测亚硝酸盐含量
- 专题2 微生物的培养与应用
- 课题1 微生物的实验室培养
- 课题2 土壤中分解尿素的细菌的分离与计数
- 课题3 分解纤维素的微生物的分离
- 专题3 植物的组织培养技术
- 课题1 菊花的组织培养
- 课题2 月季的花药培养
- 专题4 酶的研究与应用
- 课题1 果胶酶在果汁生产中的作用
- 课题2 探讨加酶洗衣粉的洗涤效果
- 课题3 酵母细胞的固定化
- 专题5 DNA和蛋白质技术
- 课题1 DNA的粗提取与鉴定
- 课题2 多聚酶链式反应扩增DNA片段
- 课题3 血红蛋白的提取和分离
- 专题6 植物有效成分的提取
- 课题1 植物芳香油的提取
- 课题2 胡萝卜素的提取
