华师大版科学七年级下册期中复习(1水-2空气)(课件 27张PPT)
文档属性
| 名称 | 华师大版科学七年级下册期中复习(1水-2空气)(课件 27张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-04-20 10:27:02 | ||
图片预览





文档简介
期中复习(一二章)
华师大科学七年级下册
第一章 水
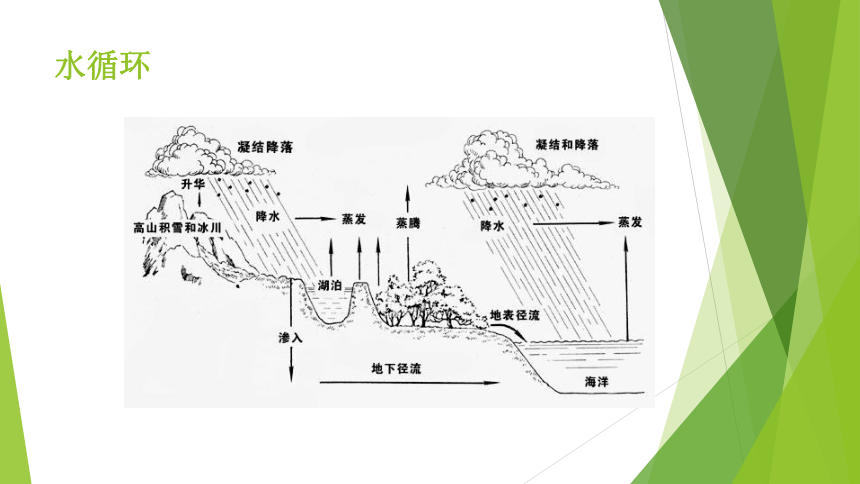
水循环
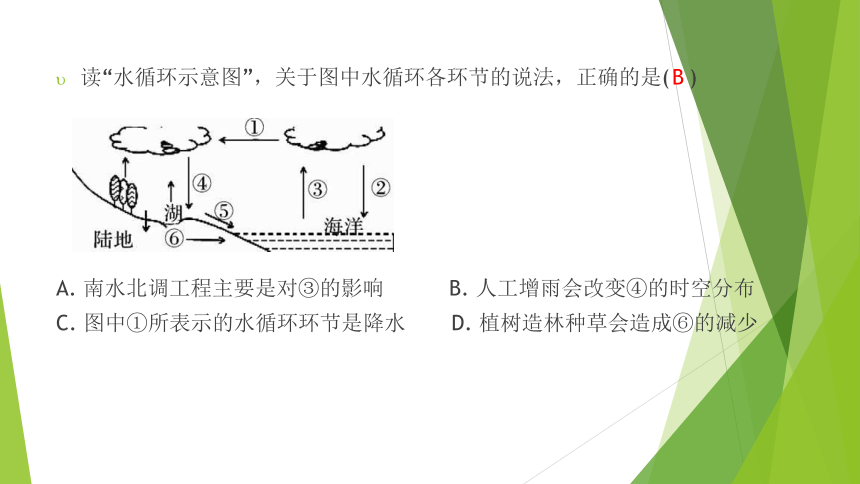
读“水循环示意图”,关于图中水循环各环节的说法,正确的是(?? )
A. 南水北调工程主要是对③的影响 B. 人工增雨会改变④的时空分布
C. 图中①所表示的水循环环节是降水 D. 植树造林种草会造成⑥的减少
B
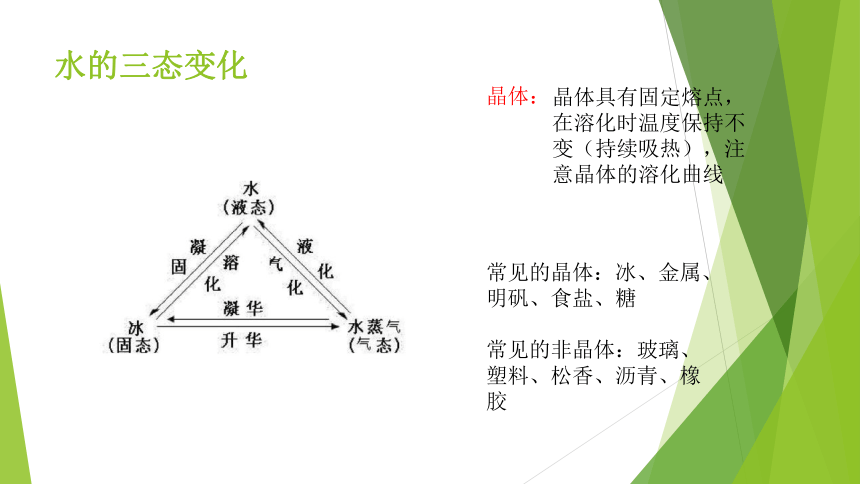
水的三态变化
晶体:
常见的晶体:冰、金属、明矾、食盐、糖
常见的非晶体:玻璃、塑料、松香、沥青、橡胶
晶体具有固定熔点,在溶化时温度保持不变(持续吸热),注意晶体的溶化曲线
在海上想要获得淡水,可采用如图所示的“充气式太阳能蒸馏器”。它是通过太阳照射充气物内的海水,产生大量水蒸气,水蒸气在透明罩内壁形成水珠,收集即可。在此过程中发生的物态变化是( )
雨的形成是与自然界中水循环相关的复杂过程.地球上的水升腾到高空变成水滴,成为云的主要组成部分.当满足一定条件时,云中的水滴先后要经历转变为水蒸气、小冰晶等过程,才能形成雨落向地面.那么,从云中的水滴到降雨的过程中,水先后经历的物态变化是( )
A.液化、汽化、凝固 B.升华、凝华、熔化
C.汽化、凝华、熔化 D.液化、凝固、熔化
A.先汽化,后液化 B.先沸腾,后凝固
C.先液化,后汽化 D.先蒸发,后沸腾
A
C
水是常用的溶剂
溶液:由一种或一种以上的物质分散到另一种液态物质里,形成均一、稳定的液体(化合物)。
溶剂和溶质的区分:
气体、固体溶于液体,则气体或固体是溶质,液体是溶剂
液体溶于液体,含量多的液体是溶剂,少的则是溶质
有水存在,无论水有多少,水是溶剂
饱和溶液与不饱和溶液
饱和溶液:
不饱和溶液:
相互转换:
饱和 不饱和:
不饱和 饱和
饱和溶液的浓度和不饱和溶液的浓度关系:
在一定温度和压强下,溶剂中所溶解的溶质已达最大量(溶解度)的溶液
在一定温度家,一定量的溶剂中还能再溶解某种溶质的溶液
增加溶剂、升高温度(氢氧化钙降低温度)
增加溶质、蒸发溶剂、降低温度(氢氧化钙升高温度)
饱和溶液不一定是浓溶液(如氢氧化钙)、不饱和溶液也不一定是稀溶液
故饱和溶液的浓度不一定比不饱和溶液的浓度大。
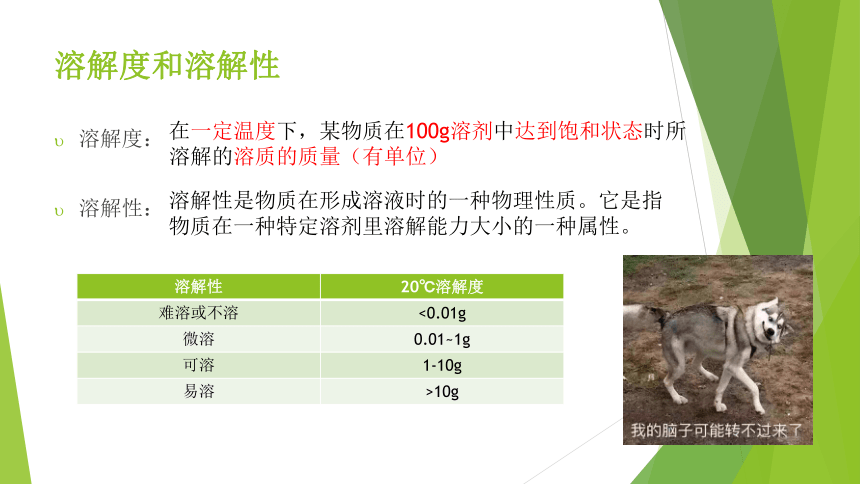
溶解度和溶解性
溶解度:
溶解性:
在一定温度下,某物质在100g溶剂中达到饱和状态时所溶解的溶质的质量(有单位)
溶解性是物质在形成溶液时的一种物理性质。它是指物质在一种特定溶剂里溶解能力大小的一种属性。
溶解性 20℃溶解度
难溶或不溶 <0.01g
微溶 0.01~1g
可溶 1-10g
易溶 >10g
溶解度曲线
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A. 甲的溶解度大于乙的溶解度
B. 两种物质的溶解度都随温度升高而增大
C. t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D. t2℃时,甲的饱和溶液溶质质量分数为50%
如图是A、B、C三种固体物质的溶解度曲线图,请回答:
(1)A、B、C三种物质的溶解度受温度影响最大的是________ ;
(2)t1℃时A的溶解度________(填“>”、“<”或“=”)C的溶解度;
(3)在t2℃时,将15gC物质加入到50g水中,充分搅拌后,所得溶液中溶
质的质量分数为________ .
B
A
<
20%
浊液
悬浊液:固体小颗粒悬浮在液体里的混合物
乳浊液:小液滴悬浮在液体里的混合物
悬浊液和乳浊液都属于浊液
Tip:洗涤剂清洗油污是乳化现象
汽油清洗油污是利用了油污可溶于汽油,所以是溶解现象
配制溶液
溶质质量分数= m质/ m液
变式::m质=m液×溶质质量分数, : m液=m质/溶质质量分数
例:将10克氯化钠溶解于40克水中,将得到溶质质量分数为多少的溶液?
要配制30%60克硝酸钾溶液,需要硝酸钾多少克? 水多少克?
溶质质量分数= m质/m液=100%=20%
答:将得到质量分数为20%的溶液
m质=m液×溶质质量分数=60g 30%=18g
m剂=m液-m质=60g-18g=42g
答需要硝酸钾18g,水42g
水的组成
正极产生气体:
负极产生气体
体积比:
得到结论:
氧气的检验:
氢气的检验:
电解水实验:
氧气
氢气
1:2
水是由氢(氢元素)、氧(氧元素)组成的。
用带火星的木条,复燃则是氧气
能燃烧,但染色火焰,生成水
文字表达式:
水 氧气 + 氢气
通电
第二章 空气
空气的存在
空气有质量
大气压存在的证明:
实验一:覆杯实验
实验二:马德堡半球实验(同时证明大气压存在和大气压很大)
空气的成分
红磷燃烧实验:
文字表达式(实验原理):
注意细节:
红磷 + 氧气 五氧化二磷
点燃
1、气密性检查
2、瓶中加少量水
3、红磷过量
4、红磷点燃后立即伸入集气瓶,并塞紧瓶塞
5、冷却至室温后再打开止水夹
实验现象:
红磷燃烧,生成大量白烟,冷却至室温后打开止水夹,烧杯中的水沿导管进入集气瓶,体积约为瓶内空气体积的
氧气
工业制氧:分离液态空气法(利用液氮和液氧的沸点不同)
物理性质:
1、颜色:
2、气味:
3、密度:
4、水溶性:
无色
无味
密度略大于空气(可用向上排空气法收集)
不易溶于水(可用排水法收集)
氧气
化学性质
氧气的检验:能使带火星的木条复燃(利用其具有助燃性)
碳在氧气中燃烧:
文字表达式:
现象:在空气中:红光
在氧气中:白光
放出热量,生成一种能使澄清石灰水变浑浊的气体(检验二氧化碳)
碳 + 氧气 二氧化碳
点燃
硫在氧气中燃烧
文字表达式:
现象:
实验前在瓶底放少量水:
硫 + 氧气 二氧化硫
空气中:微弱的淡蓝色火焰
氧气中:明亮的蓝紫色火焰
放出热量,生成刺激性气味气体(二氧化硫)
点燃
吸收二氧化硫(一种空气污染物,酸雨的主要成因),
防止空气污染
铁在氧气中燃烧
文字表达式:
现象:
铁丝为什么绕成螺线状?为什么要等火柴快燃尽时再插入集气瓶?
集气瓶底部放少量的水或细砂,为什么?
铁 + 氧气 四氧化三铁
点燃
空气中:不燃烧
氧气中:剧烈燃烧,火星四射,
放出热量,生成黑色固体
增大与氧气的接触面积。防止火柴燃烧过多消耗氧气,不利于铁丝的燃烧。
防止高温熔化物溅落使瓶底炸裂
燃烧 缓慢氧化
反应速度
是否会发光
是否会发热
是否与氧气发生反应
剧烈
会发光
会发热
缓慢
不会发光
会发热(很快散失掉)
燃烧与缓慢氧化是物质与氧气反应的最常见方式。
是
是
氧化反应
燃烧与灭火
燃烧的条件:
1、要有可燃物
2、要有助燃物(一般是氧气)
3、温度要达到着火点
白磷
白磷
热水
红磷
白磷
热水
氧气
燃烧与灭火
灭火的原理和方法:
1.要有可燃物。
2.要有氧气(或空气)。
3.温度要达到可燃物的
着火点。
1.清除可燃物
2.隔绝氧气(或空气)。
3.降温到可燃物的
着火点以下。
燃烧的条件
灭火的原理
灭火原理
下列火情的灭火原理是什么?
1)有水源的地方用水浇灭。
2)用鼓风机的强风吹灭。
3)用树枝拍打将火打灭。
4)用飞机投放干粉将火熄灭。
5)在火场边缘将树木砍光。
降低燃烧物的温度
降低燃烧物的温度
隔绝空气
隔绝空气
清除可燃物
一般不能降低可燃物的着火点
二氧化碳
物理性质:
1、颜色:
2、气味:
3、密度:
4、水溶性:
用途:
无色
无味
密度比空气大(向上排空气法)
能溶于水(不能用排水法)
制作碳酸饮料、制作灭火器、
干冰人工降雨和舞台烟雾、气体肥料
二氧化碳
化学性质:
1、不可燃也不助燃
2、能使澄清石灰水便浑浊
文字表达式:
氢氧化钙 + 二氧化碳 水 + 碳酸钙
3、水溶液呈酸性
文字表达式:
水 + 二氧化碳 碳酸
华师大科学七年级下册
第一章 水
水循环
读“水循环示意图”,关于图中水循环各环节的说法,正确的是(?? )
A. 南水北调工程主要是对③的影响 B. 人工增雨会改变④的时空分布
C. 图中①所表示的水循环环节是降水 D. 植树造林种草会造成⑥的减少
B
水的三态变化
晶体:
常见的晶体:冰、金属、明矾、食盐、糖
常见的非晶体:玻璃、塑料、松香、沥青、橡胶
晶体具有固定熔点,在溶化时温度保持不变(持续吸热),注意晶体的溶化曲线
在海上想要获得淡水,可采用如图所示的“充气式太阳能蒸馏器”。它是通过太阳照射充气物内的海水,产生大量水蒸气,水蒸气在透明罩内壁形成水珠,收集即可。在此过程中发生的物态变化是( )
雨的形成是与自然界中水循环相关的复杂过程.地球上的水升腾到高空变成水滴,成为云的主要组成部分.当满足一定条件时,云中的水滴先后要经历转变为水蒸气、小冰晶等过程,才能形成雨落向地面.那么,从云中的水滴到降雨的过程中,水先后经历的物态变化是( )
A.液化、汽化、凝固 B.升华、凝华、熔化
C.汽化、凝华、熔化 D.液化、凝固、熔化
A.先汽化,后液化 B.先沸腾,后凝固
C.先液化,后汽化 D.先蒸发,后沸腾
A
C
水是常用的溶剂
溶液:由一种或一种以上的物质分散到另一种液态物质里,形成均一、稳定的液体(化合物)。
溶剂和溶质的区分:
气体、固体溶于液体,则气体或固体是溶质,液体是溶剂
液体溶于液体,含量多的液体是溶剂,少的则是溶质
有水存在,无论水有多少,水是溶剂
饱和溶液与不饱和溶液
饱和溶液:
不饱和溶液:
相互转换:
饱和 不饱和:
不饱和 饱和
饱和溶液的浓度和不饱和溶液的浓度关系:
在一定温度和压强下,溶剂中所溶解的溶质已达最大量(溶解度)的溶液
在一定温度家,一定量的溶剂中还能再溶解某种溶质的溶液
增加溶剂、升高温度(氢氧化钙降低温度)
增加溶质、蒸发溶剂、降低温度(氢氧化钙升高温度)
饱和溶液不一定是浓溶液(如氢氧化钙)、不饱和溶液也不一定是稀溶液
故饱和溶液的浓度不一定比不饱和溶液的浓度大。
溶解度和溶解性
溶解度:
溶解性:
在一定温度下,某物质在100g溶剂中达到饱和状态时所溶解的溶质的质量(有单位)
溶解性是物质在形成溶液时的一种物理性质。它是指物质在一种特定溶剂里溶解能力大小的一种属性。
溶解性 20℃溶解度
难溶或不溶 <0.01g
微溶 0.01~1g
可溶 1-10g
易溶 >10g
溶解度曲线
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
A. 甲的溶解度大于乙的溶解度
B. 两种物质的溶解度都随温度升高而增大
C. t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D. t2℃时,甲的饱和溶液溶质质量分数为50%
如图是A、B、C三种固体物质的溶解度曲线图,请回答:
(1)A、B、C三种物质的溶解度受温度影响最大的是________ ;
(2)t1℃时A的溶解度________(填“>”、“<”或“=”)C的溶解度;
(3)在t2℃时,将15gC物质加入到50g水中,充分搅拌后,所得溶液中溶
质的质量分数为________ .
B
A
<
20%
浊液
悬浊液:固体小颗粒悬浮在液体里的混合物
乳浊液:小液滴悬浮在液体里的混合物
悬浊液和乳浊液都属于浊液
Tip:洗涤剂清洗油污是乳化现象
汽油清洗油污是利用了油污可溶于汽油,所以是溶解现象
配制溶液
溶质质量分数= m质/ m液
变式::m质=m液×溶质质量分数, : m液=m质/溶质质量分数
例:将10克氯化钠溶解于40克水中,将得到溶质质量分数为多少的溶液?
要配制30%60克硝酸钾溶液,需要硝酸钾多少克? 水多少克?
溶质质量分数= m质/m液=100%=20%
答:将得到质量分数为20%的溶液
m质=m液×溶质质量分数=60g 30%=18g
m剂=m液-m质=60g-18g=42g
答需要硝酸钾18g,水42g
水的组成
正极产生气体:
负极产生气体
体积比:
得到结论:
氧气的检验:
氢气的检验:
电解水实验:
氧气
氢气
1:2
水是由氢(氢元素)、氧(氧元素)组成的。
用带火星的木条,复燃则是氧气
能燃烧,但染色火焰,生成水
文字表达式:
水 氧气 + 氢气
通电
第二章 空气
空气的存在
空气有质量
大气压存在的证明:
实验一:覆杯实验
实验二:马德堡半球实验(同时证明大气压存在和大气压很大)
空气的成分
红磷燃烧实验:
文字表达式(实验原理):
注意细节:
红磷 + 氧气 五氧化二磷
点燃
1、气密性检查
2、瓶中加少量水
3、红磷过量
4、红磷点燃后立即伸入集气瓶,并塞紧瓶塞
5、冷却至室温后再打开止水夹
实验现象:
红磷燃烧,生成大量白烟,冷却至室温后打开止水夹,烧杯中的水沿导管进入集气瓶,体积约为瓶内空气体积的
氧气
工业制氧:分离液态空气法(利用液氮和液氧的沸点不同)
物理性质:
1、颜色:
2、气味:
3、密度:
4、水溶性:
无色
无味
密度略大于空气(可用向上排空气法收集)
不易溶于水(可用排水法收集)
氧气
化学性质
氧气的检验:能使带火星的木条复燃(利用其具有助燃性)
碳在氧气中燃烧:
文字表达式:
现象:在空气中:红光
在氧气中:白光
放出热量,生成一种能使澄清石灰水变浑浊的气体(检验二氧化碳)
碳 + 氧气 二氧化碳
点燃
硫在氧气中燃烧
文字表达式:
现象:
实验前在瓶底放少量水:
硫 + 氧气 二氧化硫
空气中:微弱的淡蓝色火焰
氧气中:明亮的蓝紫色火焰
放出热量,生成刺激性气味气体(二氧化硫)
点燃
吸收二氧化硫(一种空气污染物,酸雨的主要成因),
防止空气污染
铁在氧气中燃烧
文字表达式:
现象:
铁丝为什么绕成螺线状?为什么要等火柴快燃尽时再插入集气瓶?
集气瓶底部放少量的水或细砂,为什么?
铁 + 氧气 四氧化三铁
点燃
空气中:不燃烧
氧气中:剧烈燃烧,火星四射,
放出热量,生成黑色固体
增大与氧气的接触面积。防止火柴燃烧过多消耗氧气,不利于铁丝的燃烧。
防止高温熔化物溅落使瓶底炸裂
燃烧 缓慢氧化
反应速度
是否会发光
是否会发热
是否与氧气发生反应
剧烈
会发光
会发热
缓慢
不会发光
会发热(很快散失掉)
燃烧与缓慢氧化是物质与氧气反应的最常见方式。
是
是
氧化反应
燃烧与灭火
燃烧的条件:
1、要有可燃物
2、要有助燃物(一般是氧气)
3、温度要达到着火点
白磷
白磷
热水
红磷
白磷
热水
氧气
燃烧与灭火
灭火的原理和方法:
1.要有可燃物。
2.要有氧气(或空气)。
3.温度要达到可燃物的
着火点。
1.清除可燃物
2.隔绝氧气(或空气)。
3.降温到可燃物的
着火点以下。
燃烧的条件
灭火的原理
灭火原理
下列火情的灭火原理是什么?
1)有水源的地方用水浇灭。
2)用鼓风机的强风吹灭。
3)用树枝拍打将火打灭。
4)用飞机投放干粉将火熄灭。
5)在火场边缘将树木砍光。
降低燃烧物的温度
降低燃烧物的温度
隔绝空气
隔绝空气
清除可燃物
一般不能降低可燃物的着火点
二氧化碳
物理性质:
1、颜色:
2、气味:
3、密度:
4、水溶性:
用途:
无色
无味
密度比空气大(向上排空气法)
能溶于水(不能用排水法)
制作碳酸饮料、制作灭火器、
干冰人工降雨和舞台烟雾、气体肥料
二氧化碳
化学性质:
1、不可燃也不助燃
2、能使澄清石灰水便浑浊
文字表达式:
氢氧化钙 + 二氧化碳 水 + 碳酸钙
3、水溶液呈酸性
文字表达式:
水 + 二氧化碳 碳酸
同课章节目录
