高中化学苏教版必修一专题1第二单元 物质的量(29张ppt)
文档属性
| 名称 | 高中化学苏教版必修一专题1第二单元 物质的量(29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-24 14:40:03 | ||
图片预览






文档简介
化学
必修1
第一课时
第一章第二节 化学计量在实验中的应用
一根头发的直径是多少???
一滴水的体积是多少???
一粒米的质量是多少???
有时候,我们总是将体积和质量较小的物体的数量进行扩大,以便于我们计量。
一盒别针
一袋大米
一桶色拉油
回忆
物质由____、____、____微观粒子构成。
例如:水由______构成;
铁由______构成;
氯化钠由_______________构成;
分子
原子
离子
水分子
铁原子
钠离子和氯离子
【思考】
如何将可称量 与肉眼看不见、难以称量的
联系起来呢?
C + O2 CO2
点燃
回顾
12 g C 32 g O2
宏观
一个碳原子 一个氧分子
微观
12 g C中含多少个碳原子?
宏观
物质
微观
粒子
可称量物质
肉眼看不见,难以称量
?
物质的量
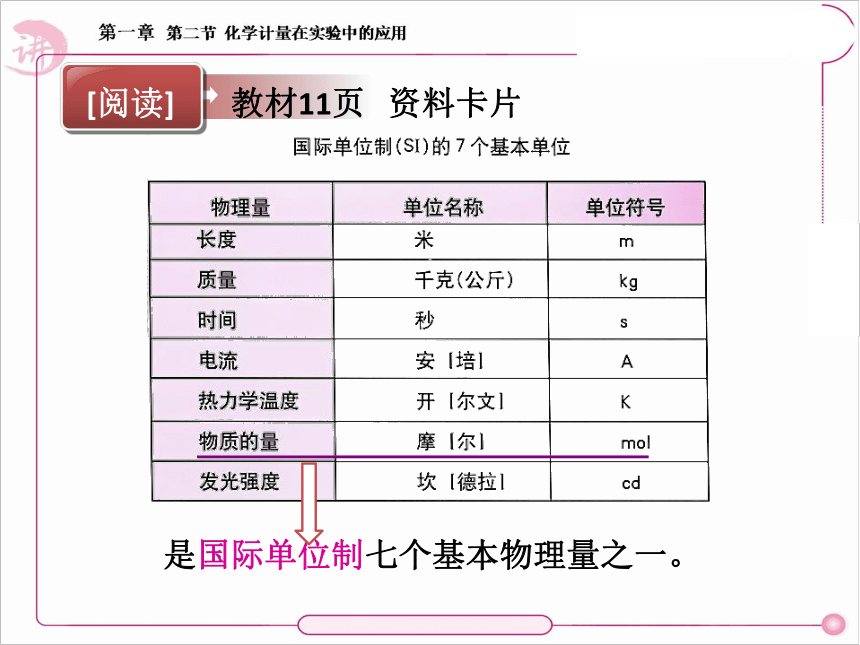
是国际单位制七个基本物理量之一。
[阅读]
教材11页 资料卡片
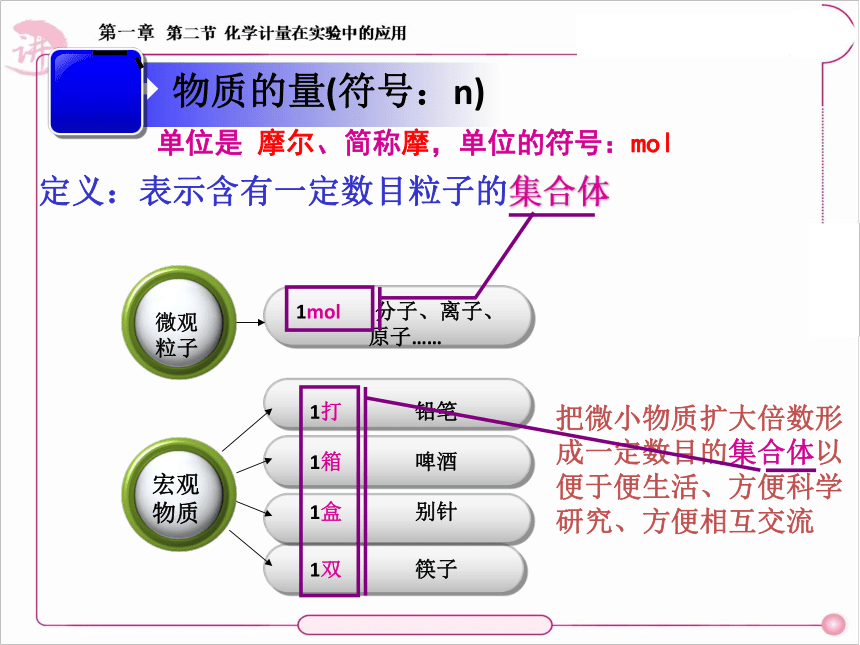
定义:表示含有一定数目粒子的集合体
物质的量(符号:n)
一、
单位是 摩尔、简称摩,单位的符号:mol
1打 铅笔
1双 筷子
1箱 啤酒
1盒 别针
宏观
物质
微观
粒子
1mol 分子、离子、
原子……
把微小物质扩大倍数形成一定数目的集合体以便于便生活、方便科学研究、方便相互交流
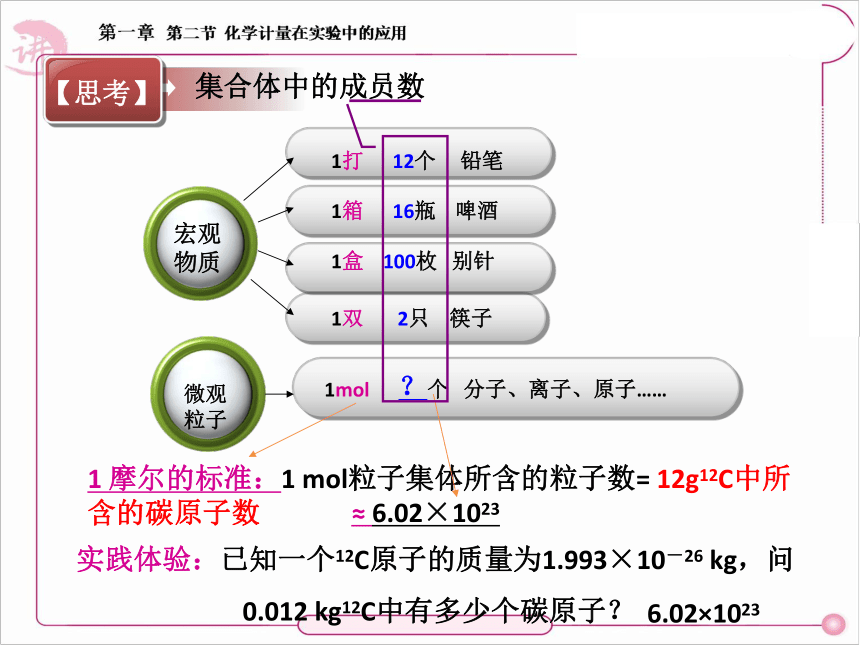
1 摩尔的标准:1 mol粒子集体所含的粒子数= 12g12C中所含的碳原子数
1打 12个 铅笔
1双 2只 筷子
1箱 16瓶 啤酒
1盒 100枚 别针
宏观
物质
微观
粒子
1mol ?个 分子、离子、原子……
实践体验:已知一个12C原子的质量为1.993×10-26 kg,问
0.012 kg12C中有多少个碳原子?
≈ 6.02×1023
【思考】
集合体中的成员数
6.02×1023
假设每粒小麦的质量是0.02g.那么1mol麦粒的质量是多少呢?
0.02×6.02×1023=1.204×1022g=1.204×1016 (吨)
物质的量只适用于微观粒子!!!
注意
3、用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
1、“物质的量”是一个物理量的全称,是一个专有名词;物 质的量不能当成物质的数量或质量来理解。
2、摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
4、 物质的量的数值可以是整数,也可以是小数。
[注意]
关于物质的量的几点说明
(1)摩尔是七个物理量之一。
(2)物质的量就是物质的质量。
(3) 1摩尔美女。
(4)1mol氢
错误。物质的量 是七个基本物理量之一
错误。物质的量和质量都是基本物理量,二者不能混淆!
错误。物质的量只适用于微观粒子,不能用来说明
宏观物质
错误。没有指出是分子、原子或离子
【讨论】
下面叙述是否正确?
同学们,还记得刚才的视频中是谁确定的1mol的标准的吗?
阿伏加德罗
因此,我们也将1mol任何粒子的粒子数称之为阿伏加德罗常数。
二、
阿伏加德罗常数:符号: NA 单位: mol-1
阿伏加德罗常数 6.02×1023
?
=
≈
联系: π=3.14???
1mol任何粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数(NA)单位:mol-1
6.02×1023
约为
约为
约为
1mol任何粒子的粒子数
=
12g12C中所含碳原子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
(1)1mol水含有 个水分子
(2)1mol水含有 个氧原子
(3)1mol水含有 个氢原子
(4)1mol水含有 个电子
1×NA
物质的量(n)×
粒子数(N)=
阿伏加德罗常数(NA)
三、
物质的量、阿伏加德罗常数与粒子数间的关系。
1×NA
2×NA
10×NA
两个变式(1)N=n?NA
(2) N
NA=
n
n=
N
NA
微粒数目
阿伏加德罗常数
物质的量
一个比例关系
n1︰n2=N1︰N2
知识链接
(5)1mol H2SO4中约含有 个硫酸分子,
个氧原子。
(7)含3.01×1023个Na+的 Na2SO4中约含 SO42- mol
(6)3molNa2CO3·10H2O含有 NA氢原子、
含有 个钠离子和 个碳酸根离子
6.02×1023
4x6.02×1023
60
6NA
0.25
3NA
思考
1mol物质的质量到底有多大?
提示:1mol12C的质量是多少?
12g
12C的相对原子质量是多少?
12
二者在数值上相等
1mol不同物质所含的粒子数______,不同粒子的质量______, 1mol不同物质的质量______。
相同
不相同
不相同
1molH2O
约含有6.02×1023个水分子,
质量是18g
1molAl
约含有6.02×1023 个铝原子,
质量是27g
思考
1mol物质的质量到底有多大?
粒子符号 物质的式量 每个粒子的质量(g/个) 1摩物质含有的粒子数(个) 1摩物质质量(g)
C 12 1.993X10-23
Fe 56 9.032X10-23
H2SO4 98 1.628X10-22
H2O 18 2.990X10-23
Na+ 23 3.821X10-23
OH- 17 2.824X10-23
NA
NA
NA
NA
NA
NA
12
56
98
18
23
17
实践体验
(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
结论
1mol任何微粒的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
讨论
分析以上计算结果可得出什么规律?
摩尔质量
四、
摩尔质量
概念:
单位物质的量的物质所具有的质量叫做摩尔质量
符号:M 常用单位:g/mol 、kg/mol
理解:
A、 1mol物质
B、数值上等于物质的相对原子(分子)质量
分子
原子
离子
H2SO4的摩尔质量为 、
1molH2SO4的质量是: 、
课堂练习
98g/mol
98g
1molH2SO4的相对分子质量质量是: 、
98
相对原子质量
相对分子质量
1mol物质的质量
摩尔质量
单位
数值
相
同
1
g
g·mol-1
三者之间的区别与联系
3molH2O的质量_____
2molH2O的质量_____
1molH2O的质量_____
18g
36g
54g
nmolH2O的质量____
18ng
n
M
m
=
课堂练习
H2O的摩尔质量为18g·mol-1
n
=
m
M
物质的量
(单位:mol)
物质的质量
(单位:g)
摩尔质量
(单位:g/mol)
五、
物质的质量、物质的量、摩尔质量之间的关系
学与问P13
(1) 24.5gH2SO4的物质的量是多少?
(2) 1.50molNa2CO3的质量是多少?
nH2SO4= =
mH2SO4
MH2SO4
24.5g
98g.mol-1
=0.25mol
mNa2CO3= =1.5molX106g.mol-1
=159g
nNa2CO3 MNa2CO3
第一章 第二节 化学计量在实验中的应用
物质的量
(n)
质量
(m)
粒子数
(N)
M×
÷M
×NA
NA÷
六、
质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系
一、物质的量(n):表示含有一定数目粒子的集合体
是国际单位制七个基本物理量之一
单位: 摩尔、简称摩(mol)
二、阿伏加德罗常数(NA):1 mol 任何粒子的粒子数。
单位: mol-1,数值:约为6.02×1023
科学上规定为: 0.012 Kg 12C 中所含的碳原子数
三、摩尔质量(M):单位物质的量的物质所具有的质量叫做摩尔质量
课堂小结
、
数值上等于物质的相对原子(分子)质量
常用单位:g/mol
