鲁教版(五四制)八年级全 第五单元 定量研究化学反应 复习(共27张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级全 第五单元 定量研究化学反应 复习(共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-24 00:00:00 | ||
图片预览








文档简介
课件27张PPT。第五单元
定量研究化学反应复习课知识点一: 质量守恒定律题型分析:1、依据质量守恒定律求算物质质量。2、依据质量守恒定律推断元素组成。3、依据质量守恒定律推断化学式。 1、内容:_____化学反应的各物质的质量总和等于反应后______ 的各物质的质量总和,这个规律叫做质量守恒定律。
注意:(1)适用范围是所有的_______,对________不适用。
(2)是__________守恒而不是体积守恒。
(3)杂质和剩余物质都没有参加反应,不属于“参加反应的各物质”不能计算在内。
(4) 生成的各物质的质量总和包括固、液、气三种状态的物质的质量,不能因为生成了气体而误认为该反应不符合质量守恒定律。
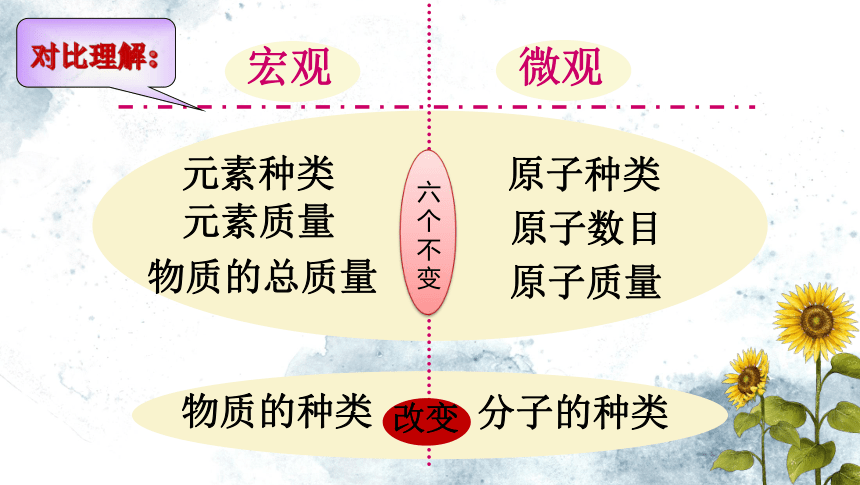
知识点一:质量守恒定律参加生成化学变化物理变化质量物质的种类分子的种类对比理解:1、在化学反应A+B→C中,8gA和足量的B完全反应后,得到11gC,那么,参加反应的B的质量是( )
A.8g B. 5g C.3g D. 2gC2、化学反应中可能改变的是( )
A.物质的种类 B. 分子的种类
C.分子数目 D.原子种类C3、氯气是一种有毒的气体,实验室制取氯气时,可以用氢氧化钠溶液来吸收尾气,其反应原理为Cl2 + 2NaOH = X + NaClO + H2O, 则X 的化学式为 ( )
A. NaCl B. H2 C. HCl D. HClOA4、在化学反应2XY2+Y2=2Z中Z的化学式( )
A、X2Y3 B、XY3 C、X2Y6 D、 X2Y4B5、植物进行光合作用可简单表示为 : H2O + CO2 → 淀粉 + O2 , 由此判断:淀粉中一定含有________元素 ,可能含有________元素。 C Ho
6、以下是某化学反应的微观示意图( 、 分别表示不同元素的原子),下列对图示反应的理解中,
正确的是( )
A.反应物和生成物中共含有三种元素
B.参加反应的物质分子个数之比为1:1
C.反应物和生成物中只有一种单质
D.该反应属于化合反应D7:把ABCD四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质质量如下表 10.6g催化剂分解反应知识点二: 化学方程式的书写题型分析:1、化学方程式纠错2、根据题意描述书写化学方程式。1、点燃与燃烧:点燃是反应条件,燃烧是实验现象。
2、加热与高温:加热是指在酒精灯能达到的温度下才能发生反应的条件,在化学方程式中要用“△”表示;高温是指在800 ℃以上才能发生反应的条件,在化学方程式中要用“高温”表示。注意:方程式书写常见错误
1.臆造不存在的反应。
2.写错物质的化学式。
3.反应条件出错。
4.未配平,未写等号。
5.漏标或多标或标错“↑”或“↓”符号。1、根据已学知识判断下列反应方程式是否正确。如有错误,请指出错误之处。
(1)3Fe + 2O2 Fe3O4
(2)Mg + O2 MgO2
(3)CH4 + 2O2↑ CO2 + 2H2O
(4)H2O H2 + O2↑
(5)H2O2 H2↑+ O2↑点燃点燃通电加热MnO2未配平D3、用纳米级某种氧化物做催化剂,使汽车尾气中的CO和NO反应,转化成两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体。请根据所给信息,写出相应的化学方程式。4、写出下列化学方程式(3)一些豆科植物能将空气中的氮气转化为被植物吸收的含氮的化合物,其反应可看作是氮气、碳和水在根瘤菌作用下生成氨气(NH3)、二氧化碳。 (2)“神舟六号”升空体现了我国航天技术的飞速发展,其中火箭的可燃物化学式是肼(N2H4),试写出它与氧气反应生氮气和水的化学方程式。(1)乙炔的化学式为C2H2,乙炔在空气中燃烧生成二氧化碳和水。5、下列化学方程式书写错误的是( )
A. 铁丝在氧气中燃烧:4Fe+3O2 2Fe2O3 B. 实验室用氯酸钾制氧气:2KClO3 2KCl+3O2↑ C. 铁与硫酸铜反应:Fe+CuSO4 ═ FeSO4+Cu D. 天然气燃烧:CH4+2O2 2H2O+CO2A知识点三: 化学反应中的计算题型分析:1、依据给定物质的质量求未知质量。2、求未知物质的相对分子质量。3、综合应用题。化学方程要配平;化学式下求式量,
式前系数应相乘,
已知未知要对应,
质量单位要分明;
列出比例解方程;
写出答案方完成。已知未知设想清;1.设未知量2.写出化学方程式3.写出有关物质的式量,
已知量和未知量4.列比例式,求解5.简明的写出答案计算步骤及注意事项:1. 在反应2A+B=2C中,1.6g的A完全反应生成2gC,又已知B的相对分子质量为32,则C的相对分子质量是( )
A、28 B、64 C、80 D、44C解析: 32 2M
0.4g 2g根据质量守恒可知mB=2g-1.6g=0.4g32/2M=0.4g/2gM=802、工业上利用高温煅烧石灰石(其主要成分为CaCO3)的方法生产生石灰(CaO),同时得到产物二氧化碳,则高温煅烧100t含有10%杂质的石灰石(杂质不能分解),可得到生石灰多少吨?Ca:40 C:12 O:16 解:CaCO3质量为:100t×90%=90t
设生石灰质量为x
CaCO3 CaO + CO2↑
100 56
90t x
100 = 56
90t x
X= 90t x56 X=50.4t
100
答:可得生石灰50.4t 。3. 实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算分解的过氧化氢的质量.2.5解:设过氧化氢质量为x
2H2O2 2H2O + O2↑
68 32
x 1.6g
68 X
=
32 1.6g
X = 1.6g x68
32
X=3.4g
答:分解的过氧化氢
质量为3.4g 。
MnO2 感 谢 收 看
定量研究化学反应复习课知识点一: 质量守恒定律题型分析:1、依据质量守恒定律求算物质质量。2、依据质量守恒定律推断元素组成。3、依据质量守恒定律推断化学式。 1、内容:_____化学反应的各物质的质量总和等于反应后______ 的各物质的质量总和,这个规律叫做质量守恒定律。
注意:(1)适用范围是所有的_______,对________不适用。
(2)是__________守恒而不是体积守恒。
(3)杂质和剩余物质都没有参加反应,不属于“参加反应的各物质”不能计算在内。
(4) 生成的各物质的质量总和包括固、液、气三种状态的物质的质量,不能因为生成了气体而误认为该反应不符合质量守恒定律。
知识点一:质量守恒定律参加生成化学变化物理变化质量物质的种类分子的种类对比理解:1、在化学反应A+B→C中,8gA和足量的B完全反应后,得到11gC,那么,参加反应的B的质量是( )
A.8g B. 5g C.3g D. 2gC2、化学反应中可能改变的是( )
A.物质的种类 B. 分子的种类
C.分子数目 D.原子种类C3、氯气是一种有毒的气体,实验室制取氯气时,可以用氢氧化钠溶液来吸收尾气,其反应原理为Cl2 + 2NaOH = X + NaClO + H2O, 则X 的化学式为 ( )
A. NaCl B. H2 C. HCl D. HClOA4、在化学反应2XY2+Y2=2Z中Z的化学式( )
A、X2Y3 B、XY3 C、X2Y6 D、 X2Y4B5、植物进行光合作用可简单表示为 : H2O + CO2 → 淀粉 + O2 , 由此判断:淀粉中一定含有________元素 ,可能含有________元素。 C Ho
6、以下是某化学反应的微观示意图( 、 分别表示不同元素的原子),下列对图示反应的理解中,
正确的是( )
A.反应物和生成物中共含有三种元素
B.参加反应的物质分子个数之比为1:1
C.反应物和生成物中只有一种单质
D.该反应属于化合反应D7:把ABCD四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质质量如下表 10.6g催化剂分解反应知识点二: 化学方程式的书写题型分析:1、化学方程式纠错2、根据题意描述书写化学方程式。1、点燃与燃烧:点燃是反应条件,燃烧是实验现象。
2、加热与高温:加热是指在酒精灯能达到的温度下才能发生反应的条件,在化学方程式中要用“△”表示;高温是指在800 ℃以上才能发生反应的条件,在化学方程式中要用“高温”表示。注意:方程式书写常见错误
1.臆造不存在的反应。
2.写错物质的化学式。
3.反应条件出错。
4.未配平,未写等号。
5.漏标或多标或标错“↑”或“↓”符号。1、根据已学知识判断下列反应方程式是否正确。如有错误,请指出错误之处。
(1)3Fe + 2O2 Fe3O4
(2)Mg + O2 MgO2
(3)CH4 + 2O2↑ CO2 + 2H2O
(4)H2O H2 + O2↑
(5)H2O2 H2↑+ O2↑点燃点燃通电加热MnO2未配平D3、用纳米级某种氧化物做催化剂,使汽车尾气中的CO和NO反应,转化成两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体。请根据所给信息,写出相应的化学方程式。4、写出下列化学方程式(3)一些豆科植物能将空气中的氮气转化为被植物吸收的含氮的化合物,其反应可看作是氮气、碳和水在根瘤菌作用下生成氨气(NH3)、二氧化碳。 (2)“神舟六号”升空体现了我国航天技术的飞速发展,其中火箭的可燃物化学式是肼(N2H4),试写出它与氧气反应生氮气和水的化学方程式。(1)乙炔的化学式为C2H2,乙炔在空气中燃烧生成二氧化碳和水。5、下列化学方程式书写错误的是( )
A. 铁丝在氧气中燃烧:4Fe+3O2 2Fe2O3 B. 实验室用氯酸钾制氧气:2KClO3 2KCl+3O2↑ C. 铁与硫酸铜反应:Fe+CuSO4 ═ FeSO4+Cu D. 天然气燃烧:CH4+2O2 2H2O+CO2A知识点三: 化学反应中的计算题型分析:1、依据给定物质的质量求未知质量。2、求未知物质的相对分子质量。3、综合应用题。化学方程要配平;化学式下求式量,
式前系数应相乘,
已知未知要对应,
质量单位要分明;
列出比例解方程;
写出答案方完成。已知未知设想清;1.设未知量2.写出化学方程式3.写出有关物质的式量,
已知量和未知量4.列比例式,求解5.简明的写出答案计算步骤及注意事项:1. 在反应2A+B=2C中,1.6g的A完全反应生成2gC,又已知B的相对分子质量为32,则C的相对分子质量是( )
A、28 B、64 C、80 D、44C解析: 32 2M
0.4g 2g根据质量守恒可知mB=2g-1.6g=0.4g32/2M=0.4g/2gM=802、工业上利用高温煅烧石灰石(其主要成分为CaCO3)的方法生产生石灰(CaO),同时得到产物二氧化碳,则高温煅烧100t含有10%杂质的石灰石(杂质不能分解),可得到生石灰多少吨?Ca:40 C:12 O:16 解:CaCO3质量为:100t×90%=90t
设生石灰质量为x
CaCO3 CaO + CO2↑
100 56
90t x
100 = 56
90t x
X= 90t x56 X=50.4t
100
答:可得生石灰50.4t 。3. 实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算分解的过氧化氢的质量.2.5解:设过氧化氢质量为x
2H2O2 2H2O + O2↑
68 32
x 1.6g
68 X
=
32 1.6g
X = 1.6g x68
32
X=3.4g
答:分解的过氧化氢
质量为3.4g 。
MnO2 感 谢 收 看
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
