新人教版九年级下册《第9章+溶液》2019年单元测试卷(天津市宝坻区大白街中学)(解析版)
文档属性
| 名称 | 新人教版九年级下册《第9章+溶液》2019年单元测试卷(天津市宝坻区大白街中学)(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 193.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-24 15:01:28 | ||
图片预览



文档简介
新人教版九年级下册《第9章 溶液》2019年单元测试卷(天津市宝坻区大白街中学)
一、选择题(每小题只有一个正确答案.)
1.(3分)日常生活中的下列物质不属于溶液的是( )
A. B.
C. D.
2.(3分)20℃时,将不同质量的氯化钠固体分别放入100 g水中,充分溶解后过滤,所得溶液质量与加入氯化钠质量的对应关系如下表.其中所得溶液一定属于饱和溶液的是( )
A
B
C
D
加入食盐质量/g
10
20
30
40
所得溶液质量/g
110
120
130
136
A.A B.B C.C D.D
3.(3分)各种洗涤剂广泛进入人们的生活,下列所用洗涤剂不具有乳化功能的是( )
A.用汽油除去衣服上的油污
B.用餐具洗洁精清洗餐具上的油污
C.用肥皂液洗衣
D.用沐浴露洗澡
4.(3分)在农业生产上,有时用溶质质量分数为10%~20%的食盐水来选种.配置20g溶质质量分数为16%的食盐水,所需加水( )
A.2.0g B.3.2g C.16.8g D.32g
5.(3分)配制溶质质量分数一定的食盐溶液,正确的操作顺序是( )
A.计算、称量、溶解、倒入试剂瓶、贴上标签
B.溶解、计算、称量、倒入试剂瓶、贴上标签
C.称量、溶解、计算、倒入试剂瓶、贴上标签
D.称量、计算、溶解、倒入试剂瓶、贴上标签
6.(3分)“死海”是著名的咸水湖.根据如图分析,下列说法不合理的是( )
A.“死海”海水的密度比一般水的密度大
B.“死海”海水中不能再溶解其他物质
C.“死海”海水中氯化钠溶解可能达到饱和
D.“死海”海水中氯化钠的质量分数最大
7.(3分)2008年3月22日是第十六个“世界水日”的主题是“涉及卫生”.下列涉水的变化中没有化学变化的是( )
A.海水晒盐 B.太阳能光解水制氢气
C.饮用水生产 D.肥皂水区分硬水和软水
8.(3分)化学中常常出现“1+1≠2”的有趣现象,但也有例外.下列符合“1+1=2”的事实是( )
A.20℃,1 L水与1 L酒精混合后的体积等于2 L
B.20℃,1 g镁与1 g稀硫酸充分反应后所得的溶液质量为2 g
C.20℃,1 g硫粉在1 g氧气中完全燃烧后生成2 g二氧化硫
D.20℃,1 g硝酸钾饱和溶液中加入1 g硝酸钾固体能得到2 g硝酸钾溶液
9.(3分)下列关于溶液的说法正确的是( )
A.溶液一定是无色、透明的混合物
B.溶液加水稀释前后,溶质的质量一定不变
C.溶剂量不变时,加入的溶质越多,溶液质量一定越大
D.物质溶于水形成溶液时,溶液温度一定不变
10.(3分)通常情况下,欲将一杯不饱和的蔗糖溶液变成饱和溶液,最适宜的方法是( )
A.加蔗糖 B.加水 C.升温 D.增大压强
11.(3分)如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
12.(3分)下列加速溶解的措施中,能改变固体溶解度的是( )
A.把固体研细 B.加热 C.搅拌 D.振荡
13.(3分)小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出.有关此现象的说明,下列说法正确的是( )
A.因压力减小使气体的溶解度变小
B.因压力减小使气体的溶解度变大
C.因压力增大使气体的溶解度变小
D.因压力增大使气体的溶解度变大
14.(3分)如图所示,在盛冷水烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是( )
A.氯化钠 B.氢氧化钠 C.硝酸铵 D.硝酸钾
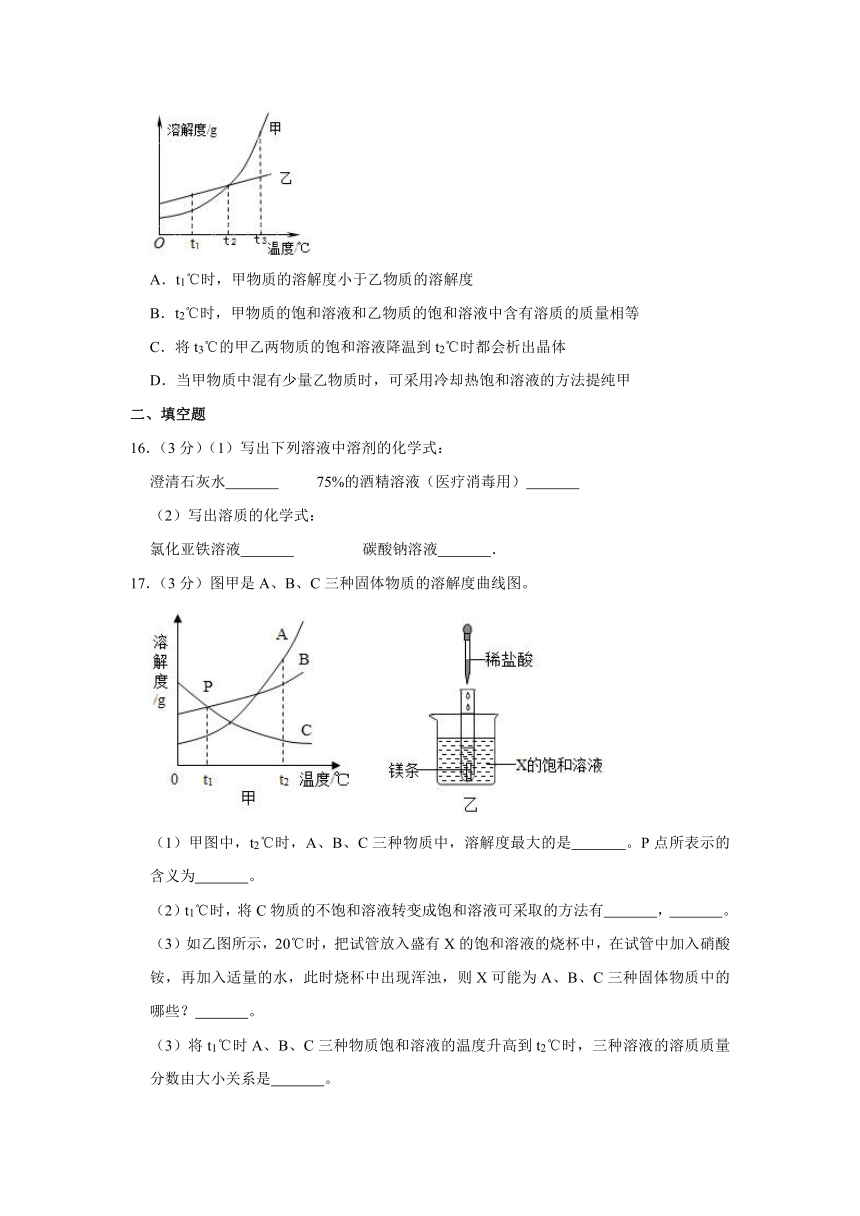
15.(3分)根据如图所示的溶解度曲线,判断下列说法中不正确的是( )
A.t1℃时,甲物质的溶解度小于乙物质的溶解度
B.t2℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量相等
C.将t3℃的甲乙两物质的饱和溶液降温到t2℃时都会析出晶体
D.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲
二、填空题
16.(3分)(1)写出下列溶液中溶剂的化学式:
澄清石灰水 75%的酒精溶液(医疗消毒用)
(2)写出溶质的化学式:
氯化亚铁溶液 碳酸钠溶液 .
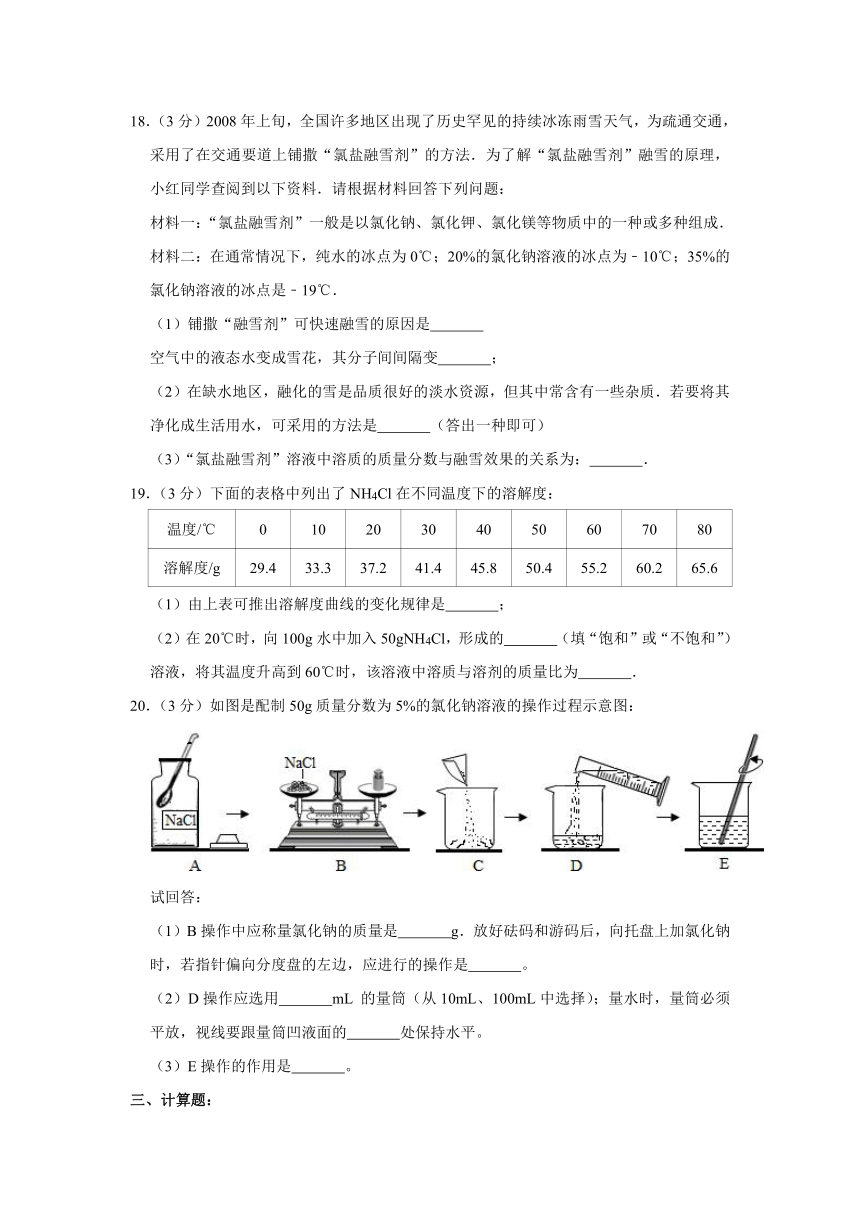
17.(3分)图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 。P点所表示的含义为 。
(2)t1℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法有 , 。
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入硝酸铵,再加入适量的水,此时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪些? 。
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大小关系是 。
18.(3分)2008年上旬,全国许多地区出现了历史罕见的持续冰冻雨雪天气,为疏通交通,采用了在交通要道上铺撒“氯盐融雪剂”的方法.为了解“氯盐融雪剂”融雪的原理,小红同学查阅到以下资料.请根据材料回答下列问题:
材料一:“氯盐融雪剂”一般是以氯化钠、氯化钾、氯化镁等物质中的一种或多种组成.
材料二:在通常情况下,纯水的冰点为0℃;20%的氯化钠溶液的冰点为﹣10℃;35%的氯化钠溶液的冰点是﹣19℃.
(1)铺撒“融雪剂”可快速融雪的原因是
空气中的液态水变成雪花,其分子间间隔变 ;
(2)在缺水地区,融化的雪是品质很好的淡水资源,但其中常含有一些杂质.若要将其净化成生活用水,可采用的方法是 (答出一种即可)
(3)“氯盐融雪剂”溶液中溶质的质量分数与融雪效果的关系为: .
19.(3分)下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃
0
10
20
30
40
50
60
70
80
溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
(1)由上表可推出溶解度曲线的变化规律是 ;
(2)在20℃时,向100g水中加入50gNH4Cl,形成的 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 .
20.(3分)如图是配制50g质量分数为5%的氯化钠溶液的操作过程示意图:
试回答:
(1)B操作中应称量氯化钠的质量是 g.放好砝码和游码后,向托盘上加氯化钠时,若指针偏向分度盘的左边,应进行的操作是 。
(2)D操作应选用 mL 的量筒(从10mL、100mL中选择);量水时,量筒必须平放,视线要跟量筒凹液面的 处保持水平。
(3)E操作的作用是 。
三、计算题:
21.钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书的一部分,取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其它成分与稀盐酸不反应),烧杯内物质的质量为11.34g。请你计算:
(1)每片钙尔奇中含碳酸钙的质量。
(2)使用这种补钙剂,每人每天摄入钙元素的质量。
(3)所用稀盐酸中溶质的质量分数。
新人教版九年级下册《第9章 溶液》2019年单元测试卷(天津市宝坻区大白街中学)
参考答案与试题解析
一、选择题(每小题只有一个正确答案.)
1.【解答】解:溶液是物质溶于水形成的均一、稳定的混合物。
葡萄酒、雪碧、矿泉水都是含有多种成分的均一、稳定的混合物,故A、B、D都是溶液。
C、牛奶不溶于水,与水混合得到的是乳浊液。
综上,故选:C。
2.【解答】解:根据溶液质量等于溶质质量与溶剂质量之和,ABC组加起来都相等,D组不相等,并且溶液的总质量大于前面三个溶液的质量,说明D中还有未溶解的氯化钠,所以一定属于饱和溶液。
故选:D。
3.【解答】解:A、汽油是良好的有机溶剂,可以溶解油污,用汽油除去衣服上的油污,利用的是溶解原理,所以错误。
B、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,所以正确。
C、肥皂是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,所以正确。
D、沐浴露是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,所以正确。
故选:A。
4.【解答】解:溶质质量=溶液质量×溶质的质量分数,配制20g溶质质量分数为16%的食盐水,需食盐的质量=20g×16%=3.2g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=20g﹣3.2g=16.8g。
故选:C。
5.【解答】解:配制一定溶质质量分数的氯化钠溶液,需要前期做的工作是先依据要求计算出溶质与溶剂的量,而后进行根据计算所得的量进行实际称量,再把相关的溶质放入到溶剂中溶解,配置好的溶液装瓶存放。
故选:A。
6.【解答】解:“死海”海水溶解的氯化钠多,所以密度就大;
即使“死海”的海水是饱和溶液,也是氯化钠的饱和溶液,所以还能溶解其他物质;故选B。
7.【解答】解:A、海水晒盐过程中只是状态发生改变,没有新物质生成,属于物理变化。
B、太阳能光解水制氢气过程中有新物质氢气生成,属于化学变化。
C、饮用水生产过程中有新物质生成,属于化学变化。
D、肥皂水区分硬水和软水过程中有新物质生成,属于化学变化。
故选:A。
8.【解答】解:A、20℃,由于分子之间存在间隙,1L水与1L酒精混合后所得混合液体的体积小于2L;故A不正确;
B、20℃,镁与稀硫酸反应生成硫酸镁和氢气,根据反应的化学方程式中两物质的质量关系24:98可知,1g稀硫酸不能完全消耗1g镁且放出气体氢气,利用质量守恒定律,可判断1g镁与1g稀硫酸充分反应后所得的溶液质量小于2g;故B不正确;
C、20℃,硫粉在氧气中燃烧生成二氧化硫,根据反应的化学方程式,硫粉与氧气恰好完全反应时的质量比为32:32=1:1,则1g硫粉在1g氧气中恰好完全反应生成2g二氧化硫,故C正确;
D、向20℃的1g饱和硝酸钾溶液中加入硝酸钾1g,硝酸钾的饱和溶液溶液不能继续溶解硝酸钾,溶液的质量不变仍为1g;故D不正确;
故选:C。
9.【解答】解:A、溶液不一定是无色的,如硫酸铜溶液为蓝色,故A错误。
B、在溶液稀释时,只改变溶剂,溶质没有变化,故B正确。
C、溶剂不变,溶解能力是一定的,加入的溶质不一定能溶解,则溶液质量可能不变或变大,故C错误。
D、物质溶于水,有的放热,有的吸热,温度变化不同,故D错误。
故选:B。
10.【解答】解:A、往不饱和的蔗糖溶液中加蔗糖,即增加溶质蔗糖的量,可使不饱和蔗糖溶液变成饱和溶液;故A正确;
B、往不饱和的蔗糖溶液中加水,溶剂的量增加只能使不饱和溶液变得更加不饱和;故B不正确;
C、给不饱和的蔗糖溶液升高温度,溶解度增大,只能使不饱和溶液变得更加不饱和;故C不正确;
D、固体温度的溶解度受压强影响不大,故D不正确;
故选:A。
11.【解答】解:A、从甲的溶解度曲线不难看出,甲的溶解度随温度的升高而增大,且受温度的影响很大,故A正确;
B、在t1℃时,这两种物质的溶解度相等,故B正确;
C、由于在t2℃时,N点在甲的溶解度曲线的下方,因此代表的是甲的不饱和溶液,故C正确;
D、由于在t1℃时,乙的溶解度是25克,即在100克水中最多溶解25克乙,故D错误;
故选:D。
12.【解答】解:由于固体在某种溶剂中的溶解度只受温度这一个外在因素的影响,因此若想改变固体的溶解度,就只能改变温度;把固体研细、搅拌、振荡都不能改变固体溶解度。
故选:B。
13.【解答】解:小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出,是因为汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,故有气体自汽水中冲出。
故选:A。
14.【解答】解:由于硝酸钾的溶解度随温度升高而升高,故使其溶解应升温,而氢氧化钙的溶解度随温度升高而减小,故使其析出需要也要升温,因此要达到效果需要加入溶于水放热的物质,在提供的物质中只有氢氧化钠溶于水放热,故B是正确选项。
故选:B。
15.【解答】解:A、据图可以看出,t1℃时,甲物质的溶解度小于乙物质的溶解度,正确;
B、t2℃时,等质量的甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量相等,错误;
C、甲和乙的溶解度都随温度的升高而增大,故将t3℃的甲乙两物质的饱和溶液降温到t2℃时都会析出晶体,正确;
D、甲的溶解度随温度的升高变化明显,故当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲,正确;
故选:B。
二、填空题
16.【解答】解:(1)澄清石灰水是将氢氧化钙溶于水中,溶质是氢氧化钙,溶剂是水;75%的酒精溶液是酒精溶于水,所以溶质是酒精,溶剂是水;
(2)氯化亚铁溶液是氯化亚铁溶于水,溶质是氯化亚铁,溶剂是水;碳酸钠溶液是碳酸钠溶于水,溶质是碳酸钠,溶剂是水.
故答案为:(1)H2O;H2O;(2)FeCl2;Na2CO3;
17.【解答】解:(1)通过分析溶解度曲线可知,甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是A,P点所表示的含义为:t1℃时,B、C物质的溶解度相等;
(2)C物质的溶解度随温度的升高而减小,所以t1℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法有增加溶质、升高温度;
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入硝酸铵,再加入适量的水,此时烧杯中出现浑浊,说明该物质的溶解度随温度的降低而减小,则X可能C;
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,C物质会析出晶体,但是t2℃时的溶解度仍比t1℃时的溶解度大,所以三种溶液的溶质质量分数由大小关系是:B>C>A。
故答案为:(1)A,t1℃时,B、C物质的溶解度相等;
(2)增加溶质、升高温度;
(3)C;
(4)B>C>A。
18.【解答】解:(1)“氯盐融雪剂”一般是以氯化钠、氯化钾、氯化镁等物质中的一种或多种组成,主要是利用了氯化钠、氯化钾、氯化镁等物质溶解后溶液的凝固点降低,从而加快雪的溶解,可用作消除积雪的融雪剂.
空气中的液态水变成雪花,液体变为气体,其分子间间隔变大.
(2)在缺水地区,融化的雪是品质很好的淡水资源,但其中常含有一些杂质.若要将其净化成生活用水,可采用过滤、沉淀、吸附、煮沸等净化方法.
(3)20%的氯化钠溶液的冰点为﹣10℃;35%的氯化钠溶液的冰点是﹣19℃,35%的氯化钠溶液的冰点要低于20%的氯化钠溶液的冰点,“氯盐融雪剂”溶液中溶质的质量分数增大时,溶液的冰点越低,融雪效果会越好.
故答案为:(1)氯化钠、氯化钾、氯化镁等物质物质溶解后溶液的凝固点降低;大;
(2)过滤、沉淀、吸附、煮沸等;沉淀等;
(3)溶质的质量分数越大,融雪的效果越好.
19.【解答】解:(1)从表中的数据可以看出,温度逐渐的升高,溶解度的数值也在逐渐的增大,故答案为:随温度的升高该物质的溶解度逐渐增大;
(2)20℃时,氯化铵的溶解度是37.2g,100g水中加入50gNH4Cl,固体物质有剩余,故答案为:饱和,
60℃时,氯化铵溶解度为55.2g,氯化铵固体全部溶解,溶质质量为:50g,溶剂质量为100g,故答案为:1:2.
20.【解答】解:(1)B操作为称取固体氯化钠的质量,根据公式可计算需要氯化钠的质量为50g×5%=2.5g,称量时氯化钠放在左盘,指针偏向分度盘的左边说明氯化钠加多了,应适量减少药品的量,所以本题答案为:2.5,减少适量药品至天平平衡;
(2)经计算所需水的体积为47.5mL,所以应该选择100mL量筒来量取,使用量筒读数时,要平视液体凹液面的最低处,所以本题答案为:100,最低;
(3)E操作为溶解,使用玻璃棒的作用可以加快食盐的溶解,所以本题答案为:加速氯化钠溶解。
三、计算题:
21.【解答】解:(1)设每片钙尔奇中CaCO3的质量为x,10g盐酸中HCl的质量为y。
完全反应后产生的二氧化碳的质量为:2g+10g﹣11.34g=0.66g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 0.66g
∴
解之得:x=1.5g,y=1.095g。
(2)碳酸钙中钙元素的质量分数为:×100%=40%
每天摄入的钙尔奇中钙元素的质量为:1.5g×2×40%=1.2g。
(3)所用盐酸中HCl的质量分数为:×100%=10.95%。
答:每片钙尔奇中含碳酸钙的质量为1.5g,使用这种补钙剂,每人每天摄入钙元素的质量为1.2g,所用稀盐酸中溶质的质量分数为10.95%。
一、选择题(每小题只有一个正确答案.)
1.(3分)日常生活中的下列物质不属于溶液的是( )
A. B.
C. D.
2.(3分)20℃时,将不同质量的氯化钠固体分别放入100 g水中,充分溶解后过滤,所得溶液质量与加入氯化钠质量的对应关系如下表.其中所得溶液一定属于饱和溶液的是( )
A
B
C
D
加入食盐质量/g
10
20
30
40
所得溶液质量/g
110
120
130
136
A.A B.B C.C D.D
3.(3分)各种洗涤剂广泛进入人们的生活,下列所用洗涤剂不具有乳化功能的是( )
A.用汽油除去衣服上的油污
B.用餐具洗洁精清洗餐具上的油污
C.用肥皂液洗衣
D.用沐浴露洗澡
4.(3分)在农业生产上,有时用溶质质量分数为10%~20%的食盐水来选种.配置20g溶质质量分数为16%的食盐水,所需加水( )
A.2.0g B.3.2g C.16.8g D.32g
5.(3分)配制溶质质量分数一定的食盐溶液,正确的操作顺序是( )
A.计算、称量、溶解、倒入试剂瓶、贴上标签
B.溶解、计算、称量、倒入试剂瓶、贴上标签
C.称量、溶解、计算、倒入试剂瓶、贴上标签
D.称量、计算、溶解、倒入试剂瓶、贴上标签
6.(3分)“死海”是著名的咸水湖.根据如图分析,下列说法不合理的是( )
A.“死海”海水的密度比一般水的密度大
B.“死海”海水中不能再溶解其他物质
C.“死海”海水中氯化钠溶解可能达到饱和
D.“死海”海水中氯化钠的质量分数最大
7.(3分)2008年3月22日是第十六个“世界水日”的主题是“涉及卫生”.下列涉水的变化中没有化学变化的是( )
A.海水晒盐 B.太阳能光解水制氢气
C.饮用水生产 D.肥皂水区分硬水和软水
8.(3分)化学中常常出现“1+1≠2”的有趣现象,但也有例外.下列符合“1+1=2”的事实是( )
A.20℃,1 L水与1 L酒精混合后的体积等于2 L
B.20℃,1 g镁与1 g稀硫酸充分反应后所得的溶液质量为2 g
C.20℃,1 g硫粉在1 g氧气中完全燃烧后生成2 g二氧化硫
D.20℃,1 g硝酸钾饱和溶液中加入1 g硝酸钾固体能得到2 g硝酸钾溶液
9.(3分)下列关于溶液的说法正确的是( )
A.溶液一定是无色、透明的混合物
B.溶液加水稀释前后,溶质的质量一定不变
C.溶剂量不变时,加入的溶质越多,溶液质量一定越大
D.物质溶于水形成溶液时,溶液温度一定不变
10.(3分)通常情况下,欲将一杯不饱和的蔗糖溶液变成饱和溶液,最适宜的方法是( )
A.加蔗糖 B.加水 C.升温 D.增大压强
11.(3分)如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
12.(3分)下列加速溶解的措施中,能改变固体溶解度的是( )
A.把固体研细 B.加热 C.搅拌 D.振荡
13.(3分)小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出.有关此现象的说明,下列说法正确的是( )
A.因压力减小使气体的溶解度变小
B.因压力减小使气体的溶解度变大
C.因压力增大使气体的溶解度变小
D.因压力增大使气体的溶解度变大
14.(3分)如图所示,在盛冷水烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是( )
A.氯化钠 B.氢氧化钠 C.硝酸铵 D.硝酸钾
15.(3分)根据如图所示的溶解度曲线,判断下列说法中不正确的是( )
A.t1℃时,甲物质的溶解度小于乙物质的溶解度
B.t2℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量相等
C.将t3℃的甲乙两物质的饱和溶液降温到t2℃时都会析出晶体
D.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲
二、填空题
16.(3分)(1)写出下列溶液中溶剂的化学式:
澄清石灰水 75%的酒精溶液(医疗消毒用)
(2)写出溶质的化学式:
氯化亚铁溶液 碳酸钠溶液 .
17.(3分)图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 。P点所表示的含义为 。
(2)t1℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法有 , 。
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入硝酸铵,再加入适量的水,此时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪些? 。
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大小关系是 。
18.(3分)2008年上旬,全国许多地区出现了历史罕见的持续冰冻雨雪天气,为疏通交通,采用了在交通要道上铺撒“氯盐融雪剂”的方法.为了解“氯盐融雪剂”融雪的原理,小红同学查阅到以下资料.请根据材料回答下列问题:
材料一:“氯盐融雪剂”一般是以氯化钠、氯化钾、氯化镁等物质中的一种或多种组成.
材料二:在通常情况下,纯水的冰点为0℃;20%的氯化钠溶液的冰点为﹣10℃;35%的氯化钠溶液的冰点是﹣19℃.
(1)铺撒“融雪剂”可快速融雪的原因是
空气中的液态水变成雪花,其分子间间隔变 ;
(2)在缺水地区,融化的雪是品质很好的淡水资源,但其中常含有一些杂质.若要将其净化成生活用水,可采用的方法是 (答出一种即可)
(3)“氯盐融雪剂”溶液中溶质的质量分数与融雪效果的关系为: .
19.(3分)下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃
0
10
20
30
40
50
60
70
80
溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
(1)由上表可推出溶解度曲线的变化规律是 ;
(2)在20℃时,向100g水中加入50gNH4Cl,形成的 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 .
20.(3分)如图是配制50g质量分数为5%的氯化钠溶液的操作过程示意图:
试回答:
(1)B操作中应称量氯化钠的质量是 g.放好砝码和游码后,向托盘上加氯化钠时,若指针偏向分度盘的左边,应进行的操作是 。
(2)D操作应选用 mL 的量筒(从10mL、100mL中选择);量水时,量筒必须平放,视线要跟量筒凹液面的 处保持水平。
(3)E操作的作用是 。
三、计算题:
21.钙是维持人体正常功能所必需的元素,如图所示为某种补钙剂“钙尔奇”说明书的一部分,取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其它成分与稀盐酸不反应),烧杯内物质的质量为11.34g。请你计算:
(1)每片钙尔奇中含碳酸钙的质量。
(2)使用这种补钙剂,每人每天摄入钙元素的质量。
(3)所用稀盐酸中溶质的质量分数。
新人教版九年级下册《第9章 溶液》2019年单元测试卷(天津市宝坻区大白街中学)
参考答案与试题解析
一、选择题(每小题只有一个正确答案.)
1.【解答】解:溶液是物质溶于水形成的均一、稳定的混合物。
葡萄酒、雪碧、矿泉水都是含有多种成分的均一、稳定的混合物,故A、B、D都是溶液。
C、牛奶不溶于水,与水混合得到的是乳浊液。
综上,故选:C。
2.【解答】解:根据溶液质量等于溶质质量与溶剂质量之和,ABC组加起来都相等,D组不相等,并且溶液的总质量大于前面三个溶液的质量,说明D中还有未溶解的氯化钠,所以一定属于饱和溶液。
故选:D。
3.【解答】解:A、汽油是良好的有机溶剂,可以溶解油污,用汽油除去衣服上的油污,利用的是溶解原理,所以错误。
B、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,所以正确。
C、肥皂是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,所以正确。
D、沐浴露是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,所以正确。
故选:A。
4.【解答】解:溶质质量=溶液质量×溶质的质量分数,配制20g溶质质量分数为16%的食盐水,需食盐的质量=20g×16%=3.2g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=20g﹣3.2g=16.8g。
故选:C。
5.【解答】解:配制一定溶质质量分数的氯化钠溶液,需要前期做的工作是先依据要求计算出溶质与溶剂的量,而后进行根据计算所得的量进行实际称量,再把相关的溶质放入到溶剂中溶解,配置好的溶液装瓶存放。
故选:A。
6.【解答】解:“死海”海水溶解的氯化钠多,所以密度就大;
即使“死海”的海水是饱和溶液,也是氯化钠的饱和溶液,所以还能溶解其他物质;故选B。
7.【解答】解:A、海水晒盐过程中只是状态发生改变,没有新物质生成,属于物理变化。
B、太阳能光解水制氢气过程中有新物质氢气生成,属于化学变化。
C、饮用水生产过程中有新物质生成,属于化学变化。
D、肥皂水区分硬水和软水过程中有新物质生成,属于化学变化。
故选:A。
8.【解答】解:A、20℃,由于分子之间存在间隙,1L水与1L酒精混合后所得混合液体的体积小于2L;故A不正确;
B、20℃,镁与稀硫酸反应生成硫酸镁和氢气,根据反应的化学方程式中两物质的质量关系24:98可知,1g稀硫酸不能完全消耗1g镁且放出气体氢气,利用质量守恒定律,可判断1g镁与1g稀硫酸充分反应后所得的溶液质量小于2g;故B不正确;
C、20℃,硫粉在氧气中燃烧生成二氧化硫,根据反应的化学方程式,硫粉与氧气恰好完全反应时的质量比为32:32=1:1,则1g硫粉在1g氧气中恰好完全反应生成2g二氧化硫,故C正确;
D、向20℃的1g饱和硝酸钾溶液中加入硝酸钾1g,硝酸钾的饱和溶液溶液不能继续溶解硝酸钾,溶液的质量不变仍为1g;故D不正确;
故选:C。
9.【解答】解:A、溶液不一定是无色的,如硫酸铜溶液为蓝色,故A错误。
B、在溶液稀释时,只改变溶剂,溶质没有变化,故B正确。
C、溶剂不变,溶解能力是一定的,加入的溶质不一定能溶解,则溶液质量可能不变或变大,故C错误。
D、物质溶于水,有的放热,有的吸热,温度变化不同,故D错误。
故选:B。
10.【解答】解:A、往不饱和的蔗糖溶液中加蔗糖,即增加溶质蔗糖的量,可使不饱和蔗糖溶液变成饱和溶液;故A正确;
B、往不饱和的蔗糖溶液中加水,溶剂的量增加只能使不饱和溶液变得更加不饱和;故B不正确;
C、给不饱和的蔗糖溶液升高温度,溶解度增大,只能使不饱和溶液变得更加不饱和;故C不正确;
D、固体温度的溶解度受压强影响不大,故D不正确;
故选:A。
11.【解答】解:A、从甲的溶解度曲线不难看出,甲的溶解度随温度的升高而增大,且受温度的影响很大,故A正确;
B、在t1℃时,这两种物质的溶解度相等,故B正确;
C、由于在t2℃时,N点在甲的溶解度曲线的下方,因此代表的是甲的不饱和溶液,故C正确;
D、由于在t1℃时,乙的溶解度是25克,即在100克水中最多溶解25克乙,故D错误;
故选:D。
12.【解答】解:由于固体在某种溶剂中的溶解度只受温度这一个外在因素的影响,因此若想改变固体的溶解度,就只能改变温度;把固体研细、搅拌、振荡都不能改变固体溶解度。
故选:B。
13.【解答】解:小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出,是因为汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,故有气体自汽水中冲出。
故选:A。
14.【解答】解:由于硝酸钾的溶解度随温度升高而升高,故使其溶解应升温,而氢氧化钙的溶解度随温度升高而减小,故使其析出需要也要升温,因此要达到效果需要加入溶于水放热的物质,在提供的物质中只有氢氧化钠溶于水放热,故B是正确选项。
故选:B。
15.【解答】解:A、据图可以看出,t1℃时,甲物质的溶解度小于乙物质的溶解度,正确;
B、t2℃时,等质量的甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量相等,错误;
C、甲和乙的溶解度都随温度的升高而增大,故将t3℃的甲乙两物质的饱和溶液降温到t2℃时都会析出晶体,正确;
D、甲的溶解度随温度的升高变化明显,故当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲,正确;
故选:B。
二、填空题
16.【解答】解:(1)澄清石灰水是将氢氧化钙溶于水中,溶质是氢氧化钙,溶剂是水;75%的酒精溶液是酒精溶于水,所以溶质是酒精,溶剂是水;
(2)氯化亚铁溶液是氯化亚铁溶于水,溶质是氯化亚铁,溶剂是水;碳酸钠溶液是碳酸钠溶于水,溶质是碳酸钠,溶剂是水.
故答案为:(1)H2O;H2O;(2)FeCl2;Na2CO3;
17.【解答】解:(1)通过分析溶解度曲线可知,甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是A,P点所表示的含义为:t1℃时,B、C物质的溶解度相等;
(2)C物质的溶解度随温度的升高而减小,所以t1℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法有增加溶质、升高温度;
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入硝酸铵,再加入适量的水,此时烧杯中出现浑浊,说明该物质的溶解度随温度的降低而减小,则X可能C;
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,C物质会析出晶体,但是t2℃时的溶解度仍比t1℃时的溶解度大,所以三种溶液的溶质质量分数由大小关系是:B>C>A。
故答案为:(1)A,t1℃时,B、C物质的溶解度相等;
(2)增加溶质、升高温度;
(3)C;
(4)B>C>A。
18.【解答】解:(1)“氯盐融雪剂”一般是以氯化钠、氯化钾、氯化镁等物质中的一种或多种组成,主要是利用了氯化钠、氯化钾、氯化镁等物质溶解后溶液的凝固点降低,从而加快雪的溶解,可用作消除积雪的融雪剂.
空气中的液态水变成雪花,液体变为气体,其分子间间隔变大.
(2)在缺水地区,融化的雪是品质很好的淡水资源,但其中常含有一些杂质.若要将其净化成生活用水,可采用过滤、沉淀、吸附、煮沸等净化方法.
(3)20%的氯化钠溶液的冰点为﹣10℃;35%的氯化钠溶液的冰点是﹣19℃,35%的氯化钠溶液的冰点要低于20%的氯化钠溶液的冰点,“氯盐融雪剂”溶液中溶质的质量分数增大时,溶液的冰点越低,融雪效果会越好.
故答案为:(1)氯化钠、氯化钾、氯化镁等物质物质溶解后溶液的凝固点降低;大;
(2)过滤、沉淀、吸附、煮沸等;沉淀等;
(3)溶质的质量分数越大,融雪的效果越好.
19.【解答】解:(1)从表中的数据可以看出,温度逐渐的升高,溶解度的数值也在逐渐的增大,故答案为:随温度的升高该物质的溶解度逐渐增大;
(2)20℃时,氯化铵的溶解度是37.2g,100g水中加入50gNH4Cl,固体物质有剩余,故答案为:饱和,
60℃时,氯化铵溶解度为55.2g,氯化铵固体全部溶解,溶质质量为:50g,溶剂质量为100g,故答案为:1:2.
20.【解答】解:(1)B操作为称取固体氯化钠的质量,根据公式可计算需要氯化钠的质量为50g×5%=2.5g,称量时氯化钠放在左盘,指针偏向分度盘的左边说明氯化钠加多了,应适量减少药品的量,所以本题答案为:2.5,减少适量药品至天平平衡;
(2)经计算所需水的体积为47.5mL,所以应该选择100mL量筒来量取,使用量筒读数时,要平视液体凹液面的最低处,所以本题答案为:100,最低;
(3)E操作为溶解,使用玻璃棒的作用可以加快食盐的溶解,所以本题答案为:加速氯化钠溶解。
三、计算题:
21.【解答】解:(1)设每片钙尔奇中CaCO3的质量为x,10g盐酸中HCl的质量为y。
完全反应后产生的二氧化碳的质量为:2g+10g﹣11.34g=0.66g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 0.66g
∴
解之得:x=1.5g,y=1.095g。
(2)碳酸钙中钙元素的质量分数为:×100%=40%
每天摄入的钙尔奇中钙元素的质量为:1.5g×2×40%=1.2g。
(3)所用盐酸中HCl的质量分数为:×100%=10.95%。
答:每片钙尔奇中含碳酸钙的质量为1.5g,使用这种补钙剂,每人每天摄入钙元素的质量为1.2g,所用稀盐酸中溶质的质量分数为10.95%。
同课章节目录
