苏教版高中化学选修四3.3盐类的水解(共50张PPT)
文档属性
| 名称 | 苏教版高中化学选修四3.3盐类的水解(共50张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 293.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-27 00:00:00 | ||
图片预览








文档简介
课件50张PPT。
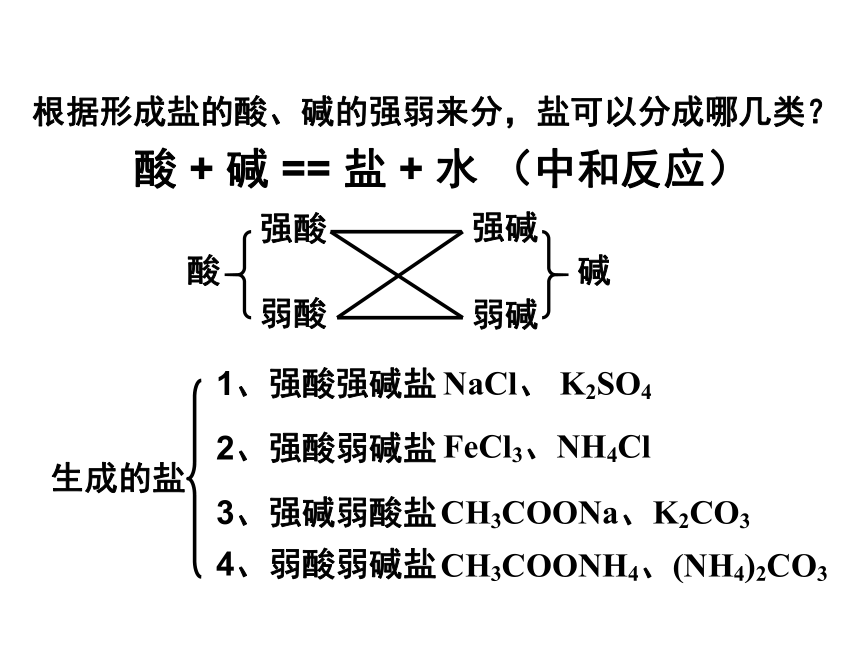
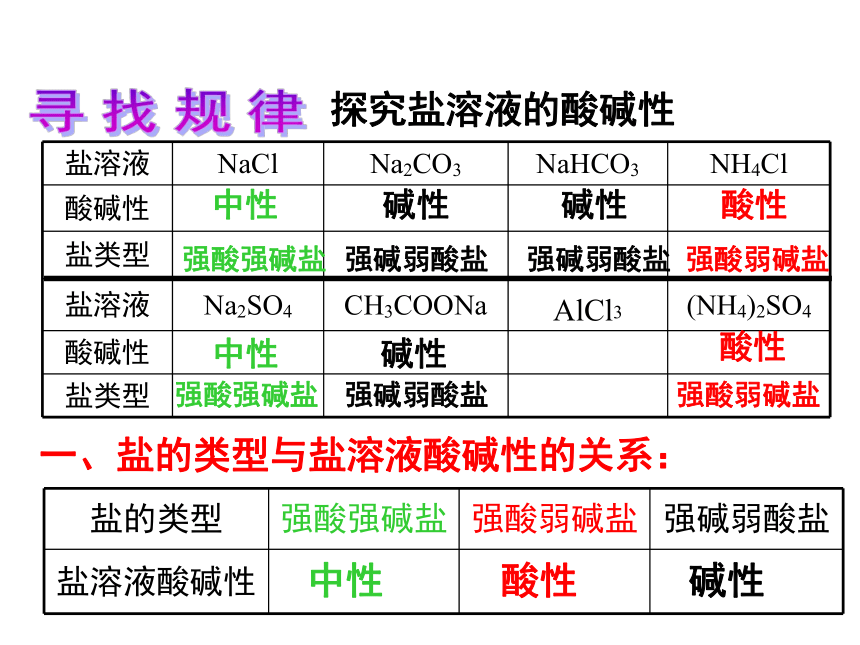
第三单元 盐类的水解第一课时根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?酸 + 碱 == 盐 + 水 (中和反应)酸强酸弱酸弱碱强碱碱生成的盐1、强酸强碱盐2、强酸弱碱盐3、强碱弱酸盐4、弱酸弱碱盐NaCl、 K2SO4FeCl3、NH4ClCH3COONH4、(NH4)2CO3CH3COONa、K2CO3Na2CO3俗称什么?分别往Na2CO3和NaHCO3的溶液中滴加酚酞,可观察到什么现象??寻找规律探究盐溶液的酸碱性中性碱性碱性酸性中性碱性酸性强酸强碱盐强碱弱酸盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐强酸弱碱盐一、盐的类型与盐溶液酸碱性的关系:中性酸性碱性探究原因盐溶液呈现不同酸碱性的原因H2O H+ + OH–纯水中:当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
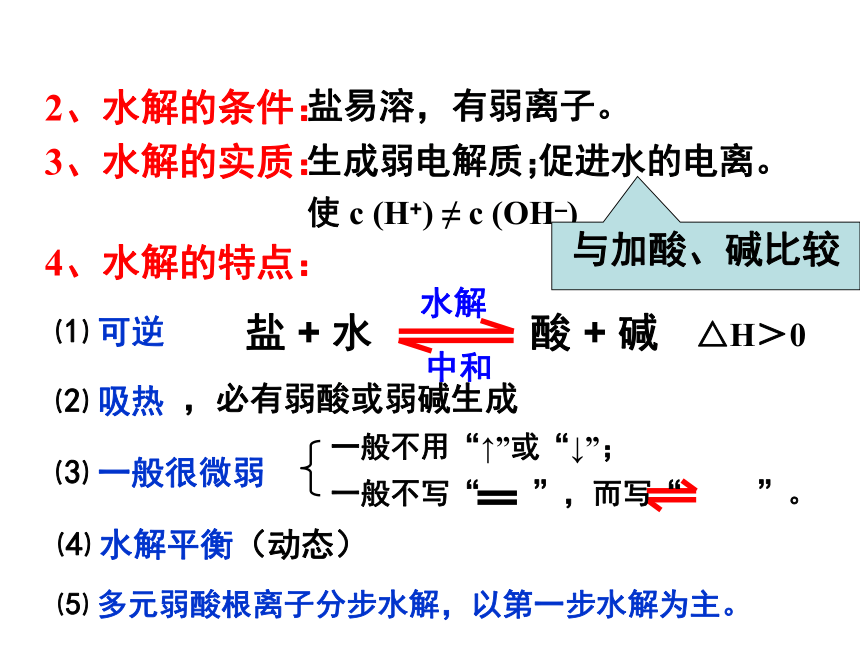
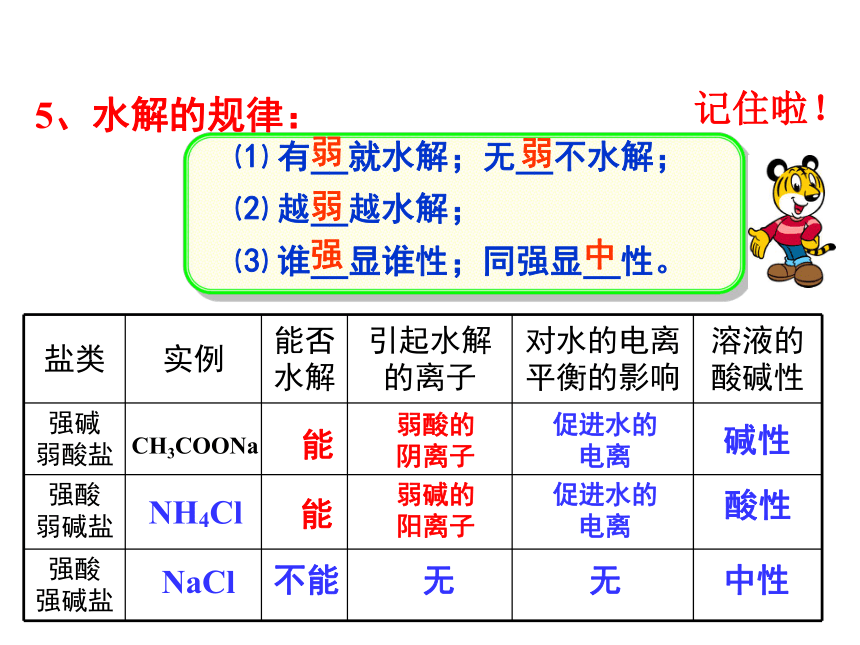
(5)相关的化学方程式?【探究1】 往水中加NaCl形成溶液。Na+、Cl–、H+、OH–、H2O无c(H+) c(OH–)=中性无(对水的电离平衡无影响)【探究2】 往水中加NH4Cl形成溶液。+有(促进水的电离) NH3 · H2O c(H+) c(OH–)>酸性Cl–、NH4+、H+、OH–、H2O、NH3 · H2O水解方程式【探究3】 往水中加CH3COONa形成溶液。+有(促进水的电离) CH3COOH c(H+) c(OH–)<碱性Na+、CH3COO–、OH–、H+、H2O、CH3COOH水解方程式二、盐溶液呈不同酸碱性的原因:盐类的水解 在水溶液中盐电离出来的离子跟水所电离出来的H+ 或OH –结合生成弱电解质(弱酸、弱碱)的反应,叫做盐类的水解。1、概念:盐 + 水 酸 + 碱盐 + 水 酸 + 碱盐易溶,有弱离子。促进水的电离。2、水解的条件:3、水解的实质:使 c (H+) ≠ c (OH–)生成弱电解质;4、水解的特点:⑴ 可逆⑵ 吸热⑶ 一般很微弱⑷ 水解平衡(动态)中和水解,必有弱酸或弱碱生成⑸ 多元弱酸根离子分步水解,以第一步水解为主。△H>0与加酸、碱比较5、水解的规律:⑴ 有__就水解;无__不水解;
⑵ 越__越水解;
⑶ 谁__显谁性;同强显__性。弱弱强中能弱酸的
阴离子促进水的
电离碱性NH4Cl能弱碱的
阳离子促进水的
电离酸性NaCl不能无无中性记住啦!CH3COONa弱 在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –D下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4①③④②⑤3. 等物质的量浓度、等体积的酸HA与碱NaOH
混合后,溶液的酸碱性是( )A、酸性 B、中性 C、碱性 D、不能确定D4. 下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠C酸性碱性5. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。A、大 B、小 C、等 D、无法确定A6. 盐类水解的过程中正确的说法是( )
A、盐的电离平衡破坏
B、水的电离平衡发生移动
C、溶液的pH减小
D、没有发生中和反应 B三、盐类水解方程式的书写:先找“弱”离子。
一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。(一)一元弱酸强碱盐如:CH3COONa、NaF化学方程式:离子方程式:化学方程式:离子方程式:F– + H2O HF + OH–(二)多元弱酸强碱盐如:Na2CO3、 Na3PO4离子方程式:HCO3 – + H2O H2CO3 + OH –CO3 2– + H2O HCO3 – + OH –(主)(次)Na2CO3溶液中含有的粒子?5种离子,2种分子。?(三)弱碱强酸盐水解如:NH4Cl、CuSO4、AlCl3水解的离子方程式:NH4+ + H2O NH3·H2O + H+Cu2+ + 2H2O Cu(OH)2 + 2H+Al 3+ + 3H2O Al(OH)3 + 3H+(四)多元弱酸酸式酸根的水解与电离的区别:⑴ NaHCO3HCO3 – + H2O H2CO3 + OH –①② HCO3 – CO32– + H +① 水解② 电离程度:>∴溶液呈 性碱⑵ NaHSO3HSO3 – + H2O H2SO3 + OH –①② HSO3 – SO32– + H +① 水解② 电离程度:<∴溶液呈 性酸【课堂小结】一、盐的类型与盐溶液酸碱性的关系:二、盐溶液呈不同酸碱性的原因:三、盐类水解:1、概念:2、水解的条件:3、水解的实质:4、水解的特点:5、水解的规律:溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应。盐易溶,有弱离子。破坏水的电离平衡。生成弱电解质;可逆;吸热;一般微弱;水解平衡。有弱就水解;无弱不水解;
越弱越水解;谁强显谁性;
同强显中性。常见的、典型的双水解反应:双水解:
两种水解情况相反的盐溶液混合时会互相促进,使双方水解程度都增大2Al3++3S2-+6H2O == 2Al(OH)3↓+3H2S↑(四) 判定离子能否大量共存:Al3+ 与 AlO2–Al3+ 与 HCO3–Al3+ 与 CO32–Al 3+ + 3AlO2 – + H2OAl(OH)346Al 3+ + 3HCO3 – Al(OH)3 + 3CO22Al3+ + 3CO32– + 3H2O 2Al(OH)3 + 3CO2第二课时专题三 溶液中的离子反应
第三单元 盐类的水解四、盐类水解平衡影响因素在一定条件下,当盐类的水解速率等于中和速率时,达到水解平衡。(动态平衡)1、内因:盐本身的性质。(越弱越水解)① 不同弱酸对应的盐NaClO (aq) CH3COONa (aq) MgCl2 (aq) AlCl3 (aq) 对应的酸HClO CH3COOH <>碱 性② 不同弱碱对应的盐对应的碱酸 性Mg(OH)2 Al(OH)3<>161、内因:盐本身的性质。(越弱越水解)③ 同一弱酸对应的盐Na2CO3 (aq) NaHCO3 (aq) 对应的酸HCO3– H2CO3<>碱 性∴ 正盐的水解程度 酸式盐的水解程度>11对于水解平衡2、外因:① 温度:升温,促进水解。② 浓度:加水稀释,促进水解。③ 加酸: 弱碱阳离子的水解。 弱酸根离子的水解。抑制促进④ 加碱: 弱碱阳离子的水解。 弱酸根离子的水解。促进抑制配制FeCl3溶液需要注意什么问题?加入一定量的 ,抑制FeCl3的水解。思考HCl10H2SO4?1.为什么KAl(SO4)2 ,FeCl3等盐可用做净水剂? 思考:4.在必修I学习胶体性质时,我们知道制取氢氧化铁胶体时是在沸水中滴入FeCl3溶液,你现在知道其中的原理了吗?2.纯碱为什么有去污力?去污时为何用热水? 3.泡沫灭火器的化学反应原理是什么?泡沫灭火器的原理 Al2(SO4)3 和 NaHCO3溶液:Al 3+ + 3HCO3– Al(OH)3 + 3CO2 混合前
混合后六、盐类水解的应用:(一)日常生活中的应用 盐作净化剂的原理:明矾、FeCl3 等本身无毒,胶体可吸附不溶性杂质,起到净水作用。热的纯碱去污能力更强,为什么?升温,促进CO32–水解。(二) 易水解盐溶液的配制与保存:配制 FeCl3溶液:加少量 ;配制 FeCl2溶液:加少量 ;保存NH4F溶液 :加相应的酸或碱稀盐酸稀盐酸和Fe粉不能存放在玻璃瓶中!铅容器或塑料瓶配制 FeSO4溶液:加少量 ;稀硫酸和Fe粉(三) 判断盐溶液的酸碱性:NaCl溶液CH3COONa溶液NH4Cl溶液中性碱性酸性CH3COONH4溶液中性NaHCO3溶液碱性(相同温度和浓度)(五) 某些盐的无水物,不能用蒸发溶液的方法制取AlCl3溶液蒸干Al(OH)3灼烧Al2O3MgCl2· 6H2OMg(OH)2MgO晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2Fe2O3Fe2O3Fe2(SO4)3Na2SO4CaCO3下列盐溶液加热蒸干、灼烧后,得到什么固体物质? 制备纳米材料。如:用TiCl4制备TiO2第三课时专题三 溶液中的离子反应
第三单元 盐类的水解周清熙QQ:545152578(六)水溶液中微粒浓度的大小比较:1、电离理论:② 多元弱酸电离是分步的,主要由第一步决定① 弱电解质电离是微弱的如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+) 如:H2S溶液中:> > > 如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)> > > > ③二元弱酸的酸式盐溶液?如:NaHCO3溶液中:对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。如:NaHCO3溶液中:
c (Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)2、水解理论:① 弱离子由于水解而损耗。如:KAl(SO4)2 溶液中:c (K+) c (Al3+)② 水解是微弱③ 多元弱酸水解是分步,主要决定第一步c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)如:Na2CO3 溶液中:
c (CO32–) c (HCO3–) c (H2CO3)> > > > > > > 单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。 如:NH4Cl 溶液中:盐类水解
的应用1、电荷守恒 如:NH4Cl 溶液中
阳离子: NH4+ H+
阴离子: Cl– OH–
正电荷总数 == 负电荷总数
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )溶液中阴离子和阳离子所带的电荷总数相等。c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )七、电解质溶液中的守恒关系 阳离子: Na+ 、H+ 阴离子: OH– 、 S2– 、 HS–又如:Na2S 溶液
Na2S == 2Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )∵ 正电荷总数 == 负电荷总数2、物料守恒(元素或原子守恒)溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。如:a mol / L 的Na2CO3 溶液中
Na2CO3 == 2 Na+ + CO32– H2O H+ + OH–
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH– ∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]c (Na+ ) = 2 a mol / Lc (CO32–) + c (HCO3–) + c (H2CO3) = a mol / L即 c (Na+) : c (C) =2 : 1如:Na2S 溶液
Na2S == 2 Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– 因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]∵ c (Na+) : c (S) =2 : 1如:NaHCO3溶液∵ c (Na+) : c (C) = 1 : 1因此
c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3)3、质子(H+)守恒电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。如:NH4Cl溶液中 为得到质子后的产物,
为失去质子后的产物,
因此:H3O+(H+)NH3·H2O、OH–、c(H+) = c(NH3·H2O) + c(OH–)如Na2S溶液中:
质子转移示意图:由上图不难看出质子守恒的关系式为:
?c (H3O+) + c (HS-) + 2c (H2S) = c (OH-)或 ?c (H+) + c (HS-) + 2c (H2S) = c (OH-)实际上,质子守恒也可根据电荷守恒和物料守恒联合求出:
在Na2S溶液中的电荷守恒: c(Na+) + c(H+) = c(OH-) + c(HS-) + 2c(S2-) 如:CH3COONa溶液中 为得到质子后的产物,
为失去质子后的产物,因此:H3O+ (H+)、CH3COOHOH–c(H3O+) + c(CH3COOH) = c(OH–) 电荷守恒- 物料守恒 = 质子守恒 三种守恒之间的关系:例1:在0.1 mol/L的NH3·H2O溶液中,关系正确的是
A.c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)
B.c (NH4+) > c (NH3·H2O) > c (OH–) > c (H+)
C.c (NH3·H2O) > c (NH4+) = c (OH–) > c (H+)??
D.c (NH3·H2O) > c (NH4+) > c (H+) > c (OH–) 解析: NH3·H2O是一元弱碱,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O ? NH4+ + OH–),所以 c (NH3·H2O) 必大于 c (NH4+)及 c (OH–)。
因为电荷守恒 c (OH–) = c (H+) + c (NH4+),所以
c (OH–) > c (NH4+)。综合起来,
c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)。A例2:用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是
A. c (OH–) > c (H+)
B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/L
C. c (CH3COOH) > c (CH3COO– )?????
D. c (CH3COO– )?+ c (OH– ) = 0.2 mol/L 解析: CH3COOH和CH3COONa的混合溶液中,CH3COOH的
电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+]。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。 周清熙QQ:5451525781. 下列溶液pH小于7的是A、氯化钾 B、硫酸铜 C、硫化钠 D、硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A. 碳酸钾 B. 硫酸氢钠 C. 碳酸氢钠 D. 氯化铁3. 下列离子在水溶液中不会发生水解的是A. NH4+ B. SO42– C. Al3+ D. F –4.?氯化铵溶液中离子浓度从大到小排列正确的是A. NH4+ 、H + 、OH –、Cl –
B. Cl – 、 NH4+ 、H + 、OH –
C. H +、 Cl – 、 NH4+ 、OH –
D. Cl – 、 NH4+ 、 OH – 、H +【课堂练习】
第三单元 盐类的水解第一课时根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?酸 + 碱 == 盐 + 水 (中和反应)酸强酸弱酸弱碱强碱碱生成的盐1、强酸强碱盐2、强酸弱碱盐3、强碱弱酸盐4、弱酸弱碱盐NaCl、 K2SO4FeCl3、NH4ClCH3COONH4、(NH4)2CO3CH3COONa、K2CO3Na2CO3俗称什么?分别往Na2CO3和NaHCO3的溶液中滴加酚酞,可观察到什么现象??寻找规律探究盐溶液的酸碱性中性碱性碱性酸性中性碱性酸性强酸强碱盐强碱弱酸盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐强酸弱碱盐一、盐的类型与盐溶液酸碱性的关系:中性酸性碱性探究原因盐溶液呈现不同酸碱性的原因H2O H+ + OH–纯水中:当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:(1)相关的电离方程式?
(2)盐溶液中存在哪些粒子?
(3)哪些粒子间可能结合(生成弱电解质)?
(4)对水的电离平衡有何影响?
(5)相关的化学方程式?【探究1】 往水中加NaCl形成溶液。Na+、Cl–、H+、OH–、H2O无c(H+) c(OH–)=中性无(对水的电离平衡无影响)【探究2】 往水中加NH4Cl形成溶液。+有(促进水的电离) NH3 · H2O c(H+) c(OH–)>酸性Cl–、NH4+、H+、OH–、H2O、NH3 · H2O水解方程式【探究3】 往水中加CH3COONa形成溶液。+有(促进水的电离) CH3COOH c(H+) c(OH–)<碱性Na+、CH3COO–、OH–、H+、H2O、CH3COOH水解方程式二、盐溶液呈不同酸碱性的原因:盐类的水解 在水溶液中盐电离出来的离子跟水所电离出来的H+ 或OH –结合生成弱电解质(弱酸、弱碱)的反应,叫做盐类的水解。1、概念:盐 + 水 酸 + 碱盐 + 水 酸 + 碱盐易溶,有弱离子。促进水的电离。2、水解的条件:3、水解的实质:使 c (H+) ≠ c (OH–)生成弱电解质;4、水解的特点:⑴ 可逆⑵ 吸热⑶ 一般很微弱⑷ 水解平衡(动态)中和水解,必有弱酸或弱碱生成⑸ 多元弱酸根离子分步水解,以第一步水解为主。△H>0与加酸、碱比较5、水解的规律:⑴ 有__就水解;无__不水解;
⑵ 越__越水解;
⑶ 谁__显谁性;同强显__性。弱弱强中能弱酸的
阴离子促进水的
电离碱性NH4Cl能弱碱的
阳离子促进水的
电离酸性NaCl不能无无中性记住啦!CH3COONa弱 在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –D下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4①③④②⑤3. 等物质的量浓度、等体积的酸HA与碱NaOH
混合后,溶液的酸碱性是( )A、酸性 B、中性 C、碱性 D、不能确定D4. 下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是( )
A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠C酸性碱性5. 在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。A、大 B、小 C、等 D、无法确定A6. 盐类水解的过程中正确的说法是( )
A、盐的电离平衡破坏
B、水的电离平衡发生移动
C、溶液的pH减小
D、没有发生中和反应 B三、盐类水解方程式的书写:先找“弱”离子。
一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。(一)一元弱酸强碱盐如:CH3COONa、NaF化学方程式:离子方程式:化学方程式:离子方程式:F– + H2O HF + OH–(二)多元弱酸强碱盐如:Na2CO3、 Na3PO4离子方程式:HCO3 – + H2O H2CO3 + OH –CO3 2– + H2O HCO3 – + OH –(主)(次)Na2CO3溶液中含有的粒子?5种离子,2种分子。?(三)弱碱强酸盐水解如:NH4Cl、CuSO4、AlCl3水解的离子方程式:NH4+ + H2O NH3·H2O + H+Cu2+ + 2H2O Cu(OH)2 + 2H+Al 3+ + 3H2O Al(OH)3 + 3H+(四)多元弱酸酸式酸根的水解与电离的区别:⑴ NaHCO3HCO3 – + H2O H2CO3 + OH –①② HCO3 – CO32– + H +① 水解② 电离程度:>∴溶液呈 性碱⑵ NaHSO3HSO3 – + H2O H2SO3 + OH –①② HSO3 – SO32– + H +① 水解② 电离程度:<∴溶液呈 性酸【课堂小结】一、盐的类型与盐溶液酸碱性的关系:二、盐溶液呈不同酸碱性的原因:三、盐类水解:1、概念:2、水解的条件:3、水解的实质:4、水解的特点:5、水解的规律:溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应。盐易溶,有弱离子。破坏水的电离平衡。生成弱电解质;可逆;吸热;一般微弱;水解平衡。有弱就水解;无弱不水解;
越弱越水解;谁强显谁性;
同强显中性。常见的、典型的双水解反应:双水解:
两种水解情况相反的盐溶液混合时会互相促进,使双方水解程度都增大2Al3++3S2-+6H2O == 2Al(OH)3↓+3H2S↑(四) 判定离子能否大量共存:Al3+ 与 AlO2–Al3+ 与 HCO3–Al3+ 与 CO32–Al 3+ + 3AlO2 – + H2OAl(OH)346Al 3+ + 3HCO3 – Al(OH)3 + 3CO22Al3+ + 3CO32– + 3H2O 2Al(OH)3 + 3CO2第二课时专题三 溶液中的离子反应
第三单元 盐类的水解四、盐类水解平衡影响因素在一定条件下,当盐类的水解速率等于中和速率时,达到水解平衡。(动态平衡)1、内因:盐本身的性质。(越弱越水解)① 不同弱酸对应的盐NaClO (aq) CH3COONa (aq) MgCl2 (aq) AlCl3 (aq) 对应的酸HClO CH3COOH <>碱 性② 不同弱碱对应的盐对应的碱酸 性Mg(OH)2 Al(OH)3<>161、内因:盐本身的性质。(越弱越水解)③ 同一弱酸对应的盐Na2CO3 (aq) NaHCO3 (aq) 对应的酸HCO3– H2CO3<>碱 性∴ 正盐的水解程度 酸式盐的水解程度>11对于水解平衡2、外因:① 温度:升温,促进水解。② 浓度:加水稀释,促进水解。③ 加酸: 弱碱阳离子的水解。 弱酸根离子的水解。抑制促进④ 加碱: 弱碱阳离子的水解。 弱酸根离子的水解。促进抑制配制FeCl3溶液需要注意什么问题?加入一定量的 ,抑制FeCl3的水解。思考HCl10H2SO4?1.为什么KAl(SO4)2 ,FeCl3等盐可用做净水剂? 思考:4.在必修I学习胶体性质时,我们知道制取氢氧化铁胶体时是在沸水中滴入FeCl3溶液,你现在知道其中的原理了吗?2.纯碱为什么有去污力?去污时为何用热水? 3.泡沫灭火器的化学反应原理是什么?泡沫灭火器的原理 Al2(SO4)3 和 NaHCO3溶液:Al 3+ + 3HCO3– Al(OH)3 + 3CO2 混合前
混合后六、盐类水解的应用:(一)日常生活中的应用 盐作净化剂的原理:明矾、FeCl3 等本身无毒,胶体可吸附不溶性杂质,起到净水作用。热的纯碱去污能力更强,为什么?升温,促进CO32–水解。(二) 易水解盐溶液的配制与保存:配制 FeCl3溶液:加少量 ;配制 FeCl2溶液:加少量 ;保存NH4F溶液 :加相应的酸或碱稀盐酸稀盐酸和Fe粉不能存放在玻璃瓶中!铅容器或塑料瓶配制 FeSO4溶液:加少量 ;稀硫酸和Fe粉(三) 判断盐溶液的酸碱性:NaCl溶液CH3COONa溶液NH4Cl溶液中性碱性酸性CH3COONH4溶液中性NaHCO3溶液碱性(相同温度和浓度)(五) 某些盐的无水物,不能用蒸发溶液的方法制取AlCl3溶液蒸干Al(OH)3灼烧Al2O3MgCl2· 6H2OMg(OH)2MgO晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2Fe2O3Fe2O3Fe2(SO4)3Na2SO4CaCO3下列盐溶液加热蒸干、灼烧后,得到什么固体物质? 制备纳米材料。如:用TiCl4制备TiO2第三课时专题三 溶液中的离子反应
第三单元 盐类的水解周清熙QQ:545152578(六)水溶液中微粒浓度的大小比较:1、电离理论:② 多元弱酸电离是分步的,主要由第一步决定① 弱电解质电离是微弱的如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+) 如:H2S溶液中:> > > 如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)> > > > ③二元弱酸的酸式盐溶液?如:NaHCO3溶液中:对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。如:NaHCO3溶液中:
c (Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)2、水解理论:① 弱离子由于水解而损耗。如:KAl(SO4)2 溶液中:c (K+) c (Al3+)② 水解是微弱③ 多元弱酸水解是分步,主要决定第一步c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)如:Na2CO3 溶液中:
c (CO32–) c (HCO3–) c (H2CO3)> > > > > > > 单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。 如:NH4Cl 溶液中:盐类水解
的应用1、电荷守恒 如:NH4Cl 溶液中
阳离子: NH4+ H+
阴离子: Cl– OH–
正电荷总数 == 负电荷总数
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )溶液中阴离子和阳离子所带的电荷总数相等。c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )七、电解质溶液中的守恒关系 阳离子: Na+ 、H+ 阴离子: OH– 、 S2– 、 HS–又如:Na2S 溶液
Na2S == 2Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )∵ 正电荷总数 == 负电荷总数2、物料守恒(元素或原子守恒)溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。如:a mol / L 的Na2CO3 溶液中
Na2CO3 == 2 Na+ + CO32– H2O H+ + OH–
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH– ∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]c (Na+ ) = 2 a mol / Lc (CO32–) + c (HCO3–) + c (H2CO3) = a mol / L即 c (Na+) : c (C) =2 : 1如:Na2S 溶液
Na2S == 2 Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– 因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]∵ c (Na+) : c (S) =2 : 1如:NaHCO3溶液∵ c (Na+) : c (C) = 1 : 1因此
c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3)3、质子(H+)守恒电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。如:NH4Cl溶液中 为得到质子后的产物,
为失去质子后的产物,
因此:H3O+(H+)NH3·H2O、OH–、c(H+) = c(NH3·H2O) + c(OH–)如Na2S溶液中:
质子转移示意图:由上图不难看出质子守恒的关系式为:
?c (H3O+) + c (HS-) + 2c (H2S) = c (OH-)或 ?c (H+) + c (HS-) + 2c (H2S) = c (OH-)实际上,质子守恒也可根据电荷守恒和物料守恒联合求出:
在Na2S溶液中的电荷守恒: c(Na+) + c(H+) = c(OH-) + c(HS-) + 2c(S2-) 如:CH3COONa溶液中 为得到质子后的产物,
为失去质子后的产物,因此:H3O+ (H+)、CH3COOHOH–c(H3O+) + c(CH3COOH) = c(OH–) 电荷守恒- 物料守恒 = 质子守恒 三种守恒之间的关系:例1:在0.1 mol/L的NH3·H2O溶液中,关系正确的是
A.c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)
B.c (NH4+) > c (NH3·H2O) > c (OH–) > c (H+)
C.c (NH3·H2O) > c (NH4+) = c (OH–) > c (H+)??
D.c (NH3·H2O) > c (NH4+) > c (H+) > c (OH–) 解析: NH3·H2O是一元弱碱,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O ? NH4+ + OH–),所以 c (NH3·H2O) 必大于 c (NH4+)及 c (OH–)。
因为电荷守恒 c (OH–) = c (H+) + c (NH4+),所以
c (OH–) > c (NH4+)。综合起来,
c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)。A例2:用均为0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中 c (CH3COO–) > c (Na+),对该混合溶液的下列判断正确的是
A. c (OH–) > c (H+)
B. c (CH3COOH) + c (CH3COO– ) = 0.2 mol/L
C. c (CH3COOH) > c (CH3COO– )?????
D. c (CH3COO– )?+ c (OH– ) = 0.2 mol/L 解析: CH3COOH和CH3COONa的混合溶液中,CH3COOH的
电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+]。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。 周清熙QQ:5451525781. 下列溶液pH小于7的是A、氯化钾 B、硫酸铜 C、硫化钠 D、硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A. 碳酸钾 B. 硫酸氢钠 C. 碳酸氢钠 D. 氯化铁3. 下列离子在水溶液中不会发生水解的是A. NH4+ B. SO42– C. Al3+ D. F –4.?氯化铵溶液中离子浓度从大到小排列正确的是A. NH4+ 、H + 、OH –、Cl –
B. Cl – 、 NH4+ 、H + 、OH –
C. H +、 Cl – 、 NH4+ 、OH –
D. Cl – 、 NH4+ 、 OH – 、H +【课堂练习】
