粤教版九年级下册化学 7.1溶解与乳化(共51张PPT)
文档属性
| 名称 | 粤教版九年级下册化学 7.1溶解与乳化(共51张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-27 00:00:00 | ||
图片预览










文档简介
第一节 溶解与乳化
海水是纯净物,还是混合物呢?
药品:蔗糖 硫酸铜晶体 食盐
仪器:试管(四支)
步骤:
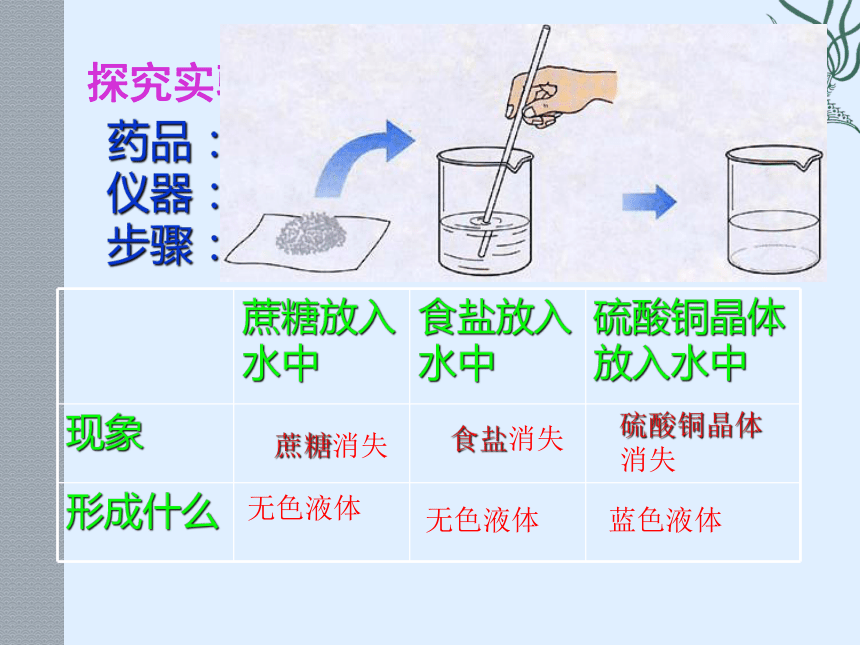
探究实验一:物质溶于水会形成什么?
蔗糖消失
食盐消失
硫酸铜晶体消失
无色液体
无色液体
蓝色液体
蔗糖放入水中 食盐放入水中 硫酸铜晶体放入水中
现象
形成什么
1、蔗糖、食盐、硫酸铜晶体放入水中,你还能不能凭肉眼看到它们的粒子呢?形成的物质是纯净物还是混合物?
2、溶液是否都是无色的?
3、如果取出一部分,剩下的和取出的浓稀程度是否一样?如不考虑水分蒸发,长期放置是否会分层?
4、蔗糖溶于水后的粒子是什么?食盐呢?
5、请你归纳它们形成的物质的特点。
(1)概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
(2)特征:均一、稳定。
均一是指溶液中任意一部分的组成和性质完全相同。
稳定是指外界条件不变时(温度、溶剂量、气体压强等),溶质不会从溶剂中分离出来。
(3)组成:由溶质和溶剂两部分组成
溶质:被溶解的物质,可是固体、气体或液体。
溶剂:能溶解其他物质的物质,水是最常见的溶剂。
溶液质量=溶质质量+溶剂质量
—某某溶质的某某溶剂的溶液
气体
液体
固体
液体
量少
量多
非水物
水
体系 溶质 溶剂
气+液
固+液
液+液 无水
有水
指出下列溶液中溶质、溶剂各是什么?
溶质 溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)75%的医用酒精
(4)油脂溶解在汽油里
(5)白磷的二硫化碳溶液
(6)盐酸
(7) CO2的水溶液
CuSO4
水
H2SO4
水
C2H5OH
水
油脂
汽油
白磷
二硫化碳
HCl
水
H2CO3
水
水是最常见的溶剂,汽油、酒精等也可以作为溶剂,相同溶质在不同溶剂里的溶解程度是否相同呢?反过来说,不同溶质在相同溶剂里的溶解程度是否相同呢?
实验探究二:影响物质溶解性的因素有哪些?
在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。
几乎不溶(液体黄色)
溶解,溶液棕色
溶解,溶液紫色
几乎不溶
物质的溶解性不仅与溶质有关,还与溶剂的性质有关。
溶剂 溶质 现象
水 碘
汽油 碘
水 高锰酸钾
汽油 高锰酸钾
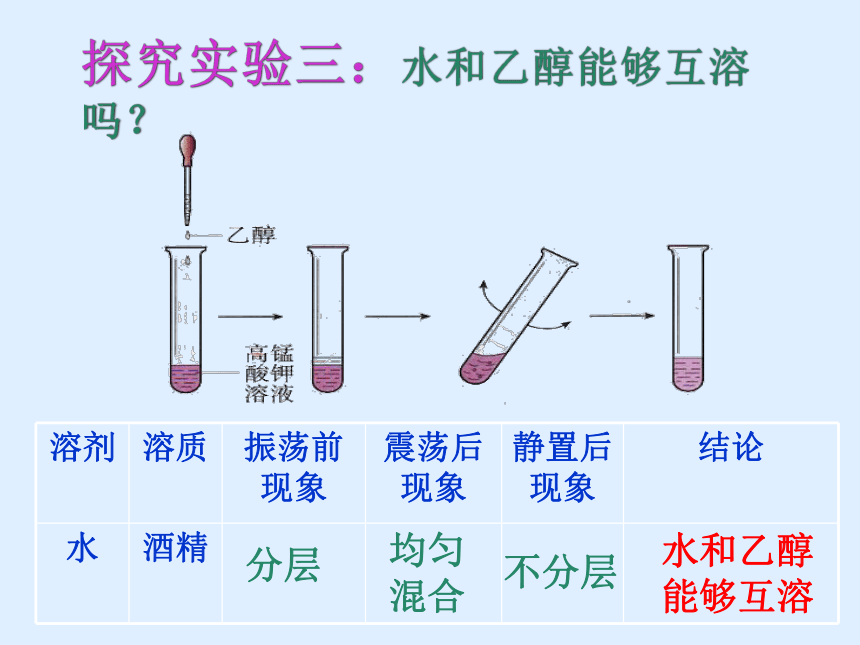
分层
均匀混合
不分层
水和乙醇能够互溶
溶剂 溶质 振荡前现象 震荡后现象 静置后现象 结论
水 酒精
实验二
实验假设: ? 有可能影响硫酸铜晶体溶解快慢的因素是: ? 假设1? 温度 ? 假设2? 溶质颗粒的大小 ? 假设3? 搅拌条件
实验操作:
在2个相同大小的烧杯中,分别注入100ml冷水和热水,再同时向烧杯中各加入一药匙(用量和颗粒大小相同)硫酸铜晶体。必要时可用玻璃棒做相同程度的搅拌
改变的条件
不变的条件
水温
水量相同
食盐量相同
同时加食盐
观察时间相同
加热能加快溶解
实验现象:
硫酸铜晶体在热水中溶解比在冷水中溶解快
实验结论:
一般情况下,溶剂温度越高,溶质的溶解速率越大
实验操作:
在2个相同大小烧杯中,分别注入100ml自来水,再同时向烧杯中各加入一药匙硫酸铜晶体(块状)和硫酸铜粉末。必要时可用玻璃棒做相同程度的搅拌
改变的条件
不变的条件
颗粒大小
水量相同
水温相同
水果糖量相同
同时加水果糖
观察时间相同
碾碎能加快溶解
实验现象:
硫酸铜晶体(块状)在水中的溶解要比硫酸铜粉末慢
实验结论:
固体溶质的形状影响溶质在水中的溶解速率,粉末状溶质比块状溶质在水中溶解快
实验操作:
在2个相同大小烧杯中,分别注入100ml自来水,再同时向烧杯中各加入一药匙硫酸铜晶体(颗粒大小相同);用玻璃棒搅拌其中一个烧杯内的水
改变的条件
不变的条件
搅 拌
水量相同
水温相同
食盐量相同
同时加食盐
观察时间相同
实验现象:
硫酸铜晶体在水中的溶解时,在搅拌水的情况下,溶解得快
实验结论:
在搅拌溶剂的情况下,溶质在溶剂中的溶解速率大
加快溶解速率的情况
升高水温
减小固体溶质的颗粒
使用玻璃棒搅拌
影响溶解速率的因素
温度
固体溶质的颗粒大小
“搅拌”条件
1、溶剂温度越高,溶质的溶解速率越快。
2、固体溶质的形状影响溶质在水中的溶解速率,粉末状溶质比块状溶质在水中溶解快。
3、越搅拌溶剂,则溶质的溶解速率越快。
思考:
李美经常用“立白”洗
涤剂洗碗,如果不用,
为什么很难洗干净油污?
1.在1支试管中注入3ml水和数滴植物油,观察到的现象是?植物油和水分成上下两层 ? 2.剧烈振荡试管,摇匀后观察到植物油会分裂成很小的油滴,并与水混合 ? 3.静置一会儿,观察到的现象是?植物油和水又重新分开成上下两层 ? 4.向试管里滴加洗涤剂,振荡,静置,细小的油滴和水?不会 分层
由小液滴分散到液体里形成的混合物叫做乳浊液或乳状液 (如牛奶和豆浆 )
乳浊液不稳定,易分成两层 。但当加入洗涤剂并振荡后,就不再分层了。
像洗涤剂这样的能使乳浊液稳定的物质称为乳化剂。乳化剂所起的作用称为乳化作用
悬浊液:
固体小颗粒悬浮于液体里形成的混合物叫做悬浊液(或悬浮液)。
乳浊液:
小液滴分散到液体里形成的混合物叫做乳浊液(或乳状液)。
悬浊液和乳浊液统称浊液。
浊液的特征:不均一、不稳定。
为什么肥皂和洗涤剂具有较强的去污能力呢?
这是因为它们所含主要成分的分子两端具有很不相同的特性。一端亲水,倾向溶入水中;另一端亲油,倾向溶入油中。这类一端亲水、另一端亲油的分子,叫做双亲性分子。双亲性分子遇到衣物上的油污时,分子的亲油端溶入油污中,另一亲水端仍留在水里,因而在油和水的界面上,整整齐齐地排成一圈单分子层,把油污团团围住。经过搓洗、振荡、翻滚等洗涤操作,这些油污被分散成珠滴,脱离衣物表面,进入水中。然后随泡沫上浮,经漂洗冲去,使衣物干净。?
???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
(讨论)
1、李美的妈妈经常用“立白”洗涤剂洗碗,
如果不用,为什么很难洗干净油污?
2、手上如果有油污,可以用天那水洗去,
也可以用洗涤剂和水洗去。它们各自的
原理是什么?
3、“非典”期间要特别注意卫生。为了使碗洗
得干净,你一般用什么来洗?为什么?
4、怎样知道碗或水杯是否洗干净了?
用洗涤剂洗餐具就是利用了洗涤剂的乳化作用。
溶液在我们的日常生活中有许多重要的用途,请你谈一谈。
魔术冰袋
化学发热袋
可溶的物质在溶解时,常常会使溶液的温度发生改变,这表明有些物质在溶解时会出现吸热现象,有些物质在溶解时则会出现放热现象。
有的温度升高(放热反应),有的温度降低(吸热反应)。这取决于物质的性质。如:
NaCl、NH4NO3、NaOH三种固体溶解于水时是放热还是吸热?
?
10 ℃
温度基本不变
温度降低
温度升高
溶解时可能吸热,也可能和放热
10 ℃
1 ℃
20 ℃
10 ℃
10 ℃
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度/℃
溶解现象
加入溶质后水的温度/℃
结论
实验结论:
氯化钠溶解后溶液的温度不变,说明溶解的过程无吸热也无放热;硝酸铵溶解后溶液的温度下降,说明溶解的过程是吸热的;氢氧化钠溶解后溶解温度升高,说明溶解的过程是放热的。
拓展与应用 ???
利用硝酸铵溶解时的吸热现象,可制成“化学冰袋”,这种冰袋特别适合在野外应用。
(1)浓硫酸、NaOH固体等溶于水温度升高;
(2)NaCl等溶于水温度不变;
(3)NH4NO3等溶于水温度降低。
向图中所示试管里的水中加入某种物质后,原来U型管左右两边支管内处于同一水平面上的红墨水,左边液面降低了些,右边液面上升了些,
则加入的物质为
( )
A. 蔗糖 B. 硝酸铵
C. 活性炭 D. 氢氧化钠
D
1.建筑工地上,我们常看到刚买来的生石灰加水时热气腾腾,这是因为生石灰加水“煮”成了熟石灰(即氢氧化钙)的缘故。试回答:
(1)写出生石灰加水“煮”成了熟石灰的化学方程式: 。
(2)这个反应是吸热反应还是放热反应? 。
(3)将生石灰加到足量的水中,充分溶解后,所得溶液中的溶质是 ,溶剂是 。
2.下列有关溶液说法错误的是 (???) ? A.溶液是一种混合物 ? B.溶液有的可以导电 ? C.动物摄取食物养料,食物被消化后变成溶液,才便于吸收 ? D.所有的溶液都是透明无色的
3.实验室中有稀食盐溶液和蒸馏水各一杯,你有几种不同的方法将它们区分开来?
D
(1)溶质分散到溶剂中形成溶液的过程中,发生了两种变化。
①扩散过程:溶质的分子(或离子)向水中扩散,吸收热量;
②水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量。
(2)溶解过程中温度变化。
①扩散过程中吸收热量>水合过程放出热量,溶液温度降低
②扩散过程吸收热量<水合过程中放出热量,溶液温度升高
③扩散过程吸收热量=水合过程放出热量,溶液温度不变
2、溶质可以为
固体
液体
气体
1、不同溶质在同一溶剂里的溶解性不同
同种溶质在同一溶剂里的溶解性不同
3、液-液互溶
多-溶剂 少-溶质
水是最常见的溶剂
溶质
被溶解
的物质
一种或几
种物质
分散
另一种物质
溶剂
均一、稳定
的混合物
溶液
乳浊液
乳化现象
乳化剂
4、
5、
能溶解其他
物质的物质
[例1] 下列关于溶液的叙述,正确的是 ( )
A.凡是均一的、稳定的、澄清的、透明的液体一定是溶液
B.当外界条件不变时,溶液不论放置多长时间,溶质也不会从溶剂中分离出来
C.一种溶液上面部分和下面部分所含的溶质是不同的
D.溶质和溶剂混合时开始是混合物,等到溶质,全部溶解后就变成纯净的、透明的纯净物了
B
[例2] 下列物质充分混合后所得混合物是否为溶液?是溶液的写出溶质的化学式。
(1)碳酸钙溶于过量的稀盐酸
(2)二氧化碳与适量石灰水恰好完全反应
(3)NaOH溶液与CuSO4溶液混合恰好完全反应
CaCl2、 HCl
Na2SO4
[例3] 如右图所示,向小试管中分别加入下列一定量的物质,右侧U形管中液面未发生明显变化,该物质是 ( )
A.氢氧化钠固体
B.浓硫酸
C.硝酸铵晶体
D.氯化钠晶体
D
[例4] 下列说法正确的是 ( )
A.溶液一定是液体
B.空气也是溶液
C.40mL酒精跟60mL水混合一定得到100mL溶液
D.盐水是溶液,糖水是溶液,两者混在一起,既有糖又有盐,则不是溶液了。
B
我会做
Ca(OH)2
H2O
C2H5OH
H2O
碘(I2)
C2H5OH
H2O
CH3COOH
溶液 澄清的石灰水 白酒 碘酒 食醋
溶质
溶剂
海水是纯净物,还是混合物呢?
药品:蔗糖 硫酸铜晶体 食盐
仪器:试管(四支)
步骤:
探究实验一:物质溶于水会形成什么?
蔗糖消失
食盐消失
硫酸铜晶体消失
无色液体
无色液体
蓝色液体
蔗糖放入水中 食盐放入水中 硫酸铜晶体放入水中
现象
形成什么
1、蔗糖、食盐、硫酸铜晶体放入水中,你还能不能凭肉眼看到它们的粒子呢?形成的物质是纯净物还是混合物?
2、溶液是否都是无色的?
3、如果取出一部分,剩下的和取出的浓稀程度是否一样?如不考虑水分蒸发,长期放置是否会分层?
4、蔗糖溶于水后的粒子是什么?食盐呢?
5、请你归纳它们形成的物质的特点。
(1)概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
(2)特征:均一、稳定。
均一是指溶液中任意一部分的组成和性质完全相同。
稳定是指外界条件不变时(温度、溶剂量、气体压强等),溶质不会从溶剂中分离出来。
(3)组成:由溶质和溶剂两部分组成
溶质:被溶解的物质,可是固体、气体或液体。
溶剂:能溶解其他物质的物质,水是最常见的溶剂。
溶液质量=溶质质量+溶剂质量
—某某溶质的某某溶剂的溶液
气体
液体
固体
液体
量少
量多
非水物
水
体系 溶质 溶剂
气+液
固+液
液+液 无水
有水
指出下列溶液中溶质、溶剂各是什么?
溶质 溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)75%的医用酒精
(4)油脂溶解在汽油里
(5)白磷的二硫化碳溶液
(6)盐酸
(7) CO2的水溶液
CuSO4
水
H2SO4
水
C2H5OH
水
油脂
汽油
白磷
二硫化碳
HCl
水
H2CO3
水
水是最常见的溶剂,汽油、酒精等也可以作为溶剂,相同溶质在不同溶剂里的溶解程度是否相同呢?反过来说,不同溶质在相同溶剂里的溶解程度是否相同呢?
实验探究二:影响物质溶解性的因素有哪些?
在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。
几乎不溶(液体黄色)
溶解,溶液棕色
溶解,溶液紫色
几乎不溶
物质的溶解性不仅与溶质有关,还与溶剂的性质有关。
溶剂 溶质 现象
水 碘
汽油 碘
水 高锰酸钾
汽油 高锰酸钾
分层
均匀混合
不分层
水和乙醇能够互溶
溶剂 溶质 振荡前现象 震荡后现象 静置后现象 结论
水 酒精
实验二
实验假设: ? 有可能影响硫酸铜晶体溶解快慢的因素是: ? 假设1? 温度 ? 假设2? 溶质颗粒的大小 ? 假设3? 搅拌条件
实验操作:
在2个相同大小的烧杯中,分别注入100ml冷水和热水,再同时向烧杯中各加入一药匙(用量和颗粒大小相同)硫酸铜晶体。必要时可用玻璃棒做相同程度的搅拌
改变的条件
不变的条件
水温
水量相同
食盐量相同
同时加食盐
观察时间相同
加热能加快溶解
实验现象:
硫酸铜晶体在热水中溶解比在冷水中溶解快
实验结论:
一般情况下,溶剂温度越高,溶质的溶解速率越大
实验操作:
在2个相同大小烧杯中,分别注入100ml自来水,再同时向烧杯中各加入一药匙硫酸铜晶体(块状)和硫酸铜粉末。必要时可用玻璃棒做相同程度的搅拌
改变的条件
不变的条件
颗粒大小
水量相同
水温相同
水果糖量相同
同时加水果糖
观察时间相同
碾碎能加快溶解
实验现象:
硫酸铜晶体(块状)在水中的溶解要比硫酸铜粉末慢
实验结论:
固体溶质的形状影响溶质在水中的溶解速率,粉末状溶质比块状溶质在水中溶解快
实验操作:
在2个相同大小烧杯中,分别注入100ml自来水,再同时向烧杯中各加入一药匙硫酸铜晶体(颗粒大小相同);用玻璃棒搅拌其中一个烧杯内的水
改变的条件
不变的条件
搅 拌
水量相同
水温相同
食盐量相同
同时加食盐
观察时间相同
实验现象:
硫酸铜晶体在水中的溶解时,在搅拌水的情况下,溶解得快
实验结论:
在搅拌溶剂的情况下,溶质在溶剂中的溶解速率大
加快溶解速率的情况
升高水温
减小固体溶质的颗粒
使用玻璃棒搅拌
影响溶解速率的因素
温度
固体溶质的颗粒大小
“搅拌”条件
1、溶剂温度越高,溶质的溶解速率越快。
2、固体溶质的形状影响溶质在水中的溶解速率,粉末状溶质比块状溶质在水中溶解快。
3、越搅拌溶剂,则溶质的溶解速率越快。
思考:
李美经常用“立白”洗
涤剂洗碗,如果不用,
为什么很难洗干净油污?
1.在1支试管中注入3ml水和数滴植物油,观察到的现象是?植物油和水分成上下两层 ? 2.剧烈振荡试管,摇匀后观察到植物油会分裂成很小的油滴,并与水混合 ? 3.静置一会儿,观察到的现象是?植物油和水又重新分开成上下两层 ? 4.向试管里滴加洗涤剂,振荡,静置,细小的油滴和水?不会 分层
由小液滴分散到液体里形成的混合物叫做乳浊液或乳状液 (如牛奶和豆浆 )
乳浊液不稳定,易分成两层 。但当加入洗涤剂并振荡后,就不再分层了。
像洗涤剂这样的能使乳浊液稳定的物质称为乳化剂。乳化剂所起的作用称为乳化作用
悬浊液:
固体小颗粒悬浮于液体里形成的混合物叫做悬浊液(或悬浮液)。
乳浊液:
小液滴分散到液体里形成的混合物叫做乳浊液(或乳状液)。
悬浊液和乳浊液统称浊液。
浊液的特征:不均一、不稳定。
为什么肥皂和洗涤剂具有较强的去污能力呢?
这是因为它们所含主要成分的分子两端具有很不相同的特性。一端亲水,倾向溶入水中;另一端亲油,倾向溶入油中。这类一端亲水、另一端亲油的分子,叫做双亲性分子。双亲性分子遇到衣物上的油污时,分子的亲油端溶入油污中,另一亲水端仍留在水里,因而在油和水的界面上,整整齐齐地排成一圈单分子层,把油污团团围住。经过搓洗、振荡、翻滚等洗涤操作,这些油污被分散成珠滴,脱离衣物表面,进入水中。然后随泡沫上浮,经漂洗冲去,使衣物干净。?
???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
(讨论)
1、李美的妈妈经常用“立白”洗涤剂洗碗,
如果不用,为什么很难洗干净油污?
2、手上如果有油污,可以用天那水洗去,
也可以用洗涤剂和水洗去。它们各自的
原理是什么?
3、“非典”期间要特别注意卫生。为了使碗洗
得干净,你一般用什么来洗?为什么?
4、怎样知道碗或水杯是否洗干净了?
用洗涤剂洗餐具就是利用了洗涤剂的乳化作用。
溶液在我们的日常生活中有许多重要的用途,请你谈一谈。
魔术冰袋
化学发热袋
可溶的物质在溶解时,常常会使溶液的温度发生改变,这表明有些物质在溶解时会出现吸热现象,有些物质在溶解时则会出现放热现象。
有的温度升高(放热反应),有的温度降低(吸热反应)。这取决于物质的性质。如:
NaCl、NH4NO3、NaOH三种固体溶解于水时是放热还是吸热?
?
10 ℃
温度基本不变
温度降低
温度升高
溶解时可能吸热,也可能和放热
10 ℃
1 ℃
20 ℃
10 ℃
10 ℃
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度/℃
溶解现象
加入溶质后水的温度/℃
结论
实验结论:
氯化钠溶解后溶液的温度不变,说明溶解的过程无吸热也无放热;硝酸铵溶解后溶液的温度下降,说明溶解的过程是吸热的;氢氧化钠溶解后溶解温度升高,说明溶解的过程是放热的。
拓展与应用 ???
利用硝酸铵溶解时的吸热现象,可制成“化学冰袋”,这种冰袋特别适合在野外应用。
(1)浓硫酸、NaOH固体等溶于水温度升高;
(2)NaCl等溶于水温度不变;
(3)NH4NO3等溶于水温度降低。
向图中所示试管里的水中加入某种物质后,原来U型管左右两边支管内处于同一水平面上的红墨水,左边液面降低了些,右边液面上升了些,
则加入的物质为
( )
A. 蔗糖 B. 硝酸铵
C. 活性炭 D. 氢氧化钠
D
1.建筑工地上,我们常看到刚买来的生石灰加水时热气腾腾,这是因为生石灰加水“煮”成了熟石灰(即氢氧化钙)的缘故。试回答:
(1)写出生石灰加水“煮”成了熟石灰的化学方程式: 。
(2)这个反应是吸热反应还是放热反应? 。
(3)将生石灰加到足量的水中,充分溶解后,所得溶液中的溶质是 ,溶剂是 。
2.下列有关溶液说法错误的是 (???) ? A.溶液是一种混合物 ? B.溶液有的可以导电 ? C.动物摄取食物养料,食物被消化后变成溶液,才便于吸收 ? D.所有的溶液都是透明无色的
3.实验室中有稀食盐溶液和蒸馏水各一杯,你有几种不同的方法将它们区分开来?
D
(1)溶质分散到溶剂中形成溶液的过程中,发生了两种变化。
①扩散过程:溶质的分子(或离子)向水中扩散,吸收热量;
②水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量。
(2)溶解过程中温度变化。
①扩散过程中吸收热量>水合过程放出热量,溶液温度降低
②扩散过程吸收热量<水合过程中放出热量,溶液温度升高
③扩散过程吸收热量=水合过程放出热量,溶液温度不变
2、溶质可以为
固体
液体
气体
1、不同溶质在同一溶剂里的溶解性不同
同种溶质在同一溶剂里的溶解性不同
3、液-液互溶
多-溶剂 少-溶质
水是最常见的溶剂
溶质
被溶解
的物质
一种或几
种物质
分散
另一种物质
溶剂
均一、稳定
的混合物
溶液
乳浊液
乳化现象
乳化剂
4、
5、
能溶解其他
物质的物质
[例1] 下列关于溶液的叙述,正确的是 ( )
A.凡是均一的、稳定的、澄清的、透明的液体一定是溶液
B.当外界条件不变时,溶液不论放置多长时间,溶质也不会从溶剂中分离出来
C.一种溶液上面部分和下面部分所含的溶质是不同的
D.溶质和溶剂混合时开始是混合物,等到溶质,全部溶解后就变成纯净的、透明的纯净物了
B
[例2] 下列物质充分混合后所得混合物是否为溶液?是溶液的写出溶质的化学式。
(1)碳酸钙溶于过量的稀盐酸
(2)二氧化碳与适量石灰水恰好完全反应
(3)NaOH溶液与CuSO4溶液混合恰好完全反应
CaCl2、 HCl
Na2SO4
[例3] 如右图所示,向小试管中分别加入下列一定量的物质,右侧U形管中液面未发生明显变化,该物质是 ( )
A.氢氧化钠固体
B.浓硫酸
C.硝酸铵晶体
D.氯化钠晶体
D
[例4] 下列说法正确的是 ( )
A.溶液一定是液体
B.空气也是溶液
C.40mL酒精跟60mL水混合一定得到100mL溶液
D.盐水是溶液,糖水是溶液,两者混在一起,既有糖又有盐,则不是溶液了。
B
我会做
Ca(OH)2
H2O
C2H5OH
H2O
碘(I2)
C2H5OH
H2O
CH3COOH
溶液 澄清的石灰水 白酒 碘酒 食醋
溶质
溶剂
