湖南省益阳市箴言中学2019届高考考前化学指导讲座(2019年4月)33张ppt
文档属性
| 名称 | 湖南省益阳市箴言中学2019届高考考前化学指导讲座(2019年4月)33张ppt |

|
|
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-27 00:00:00 | ||
图片预览








文档简介
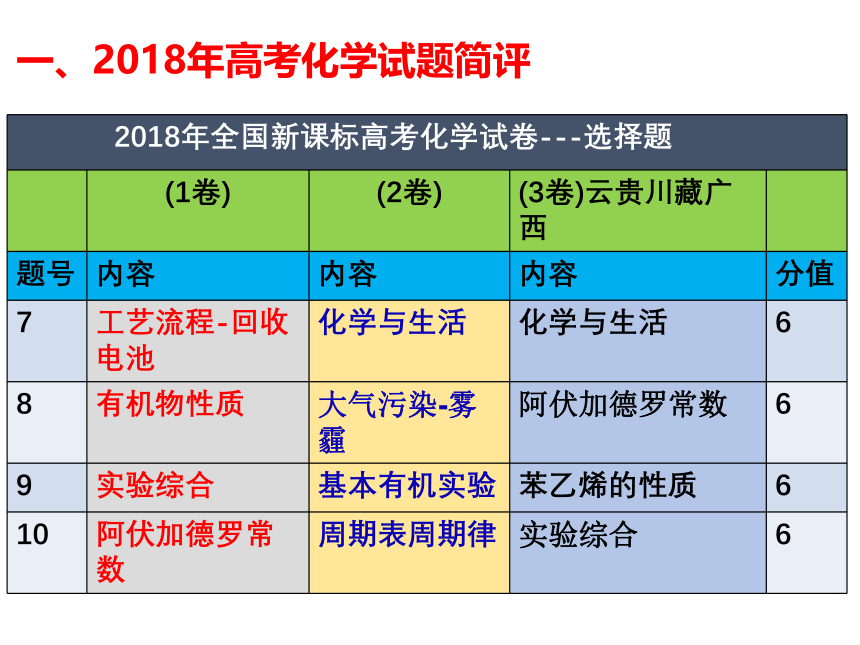
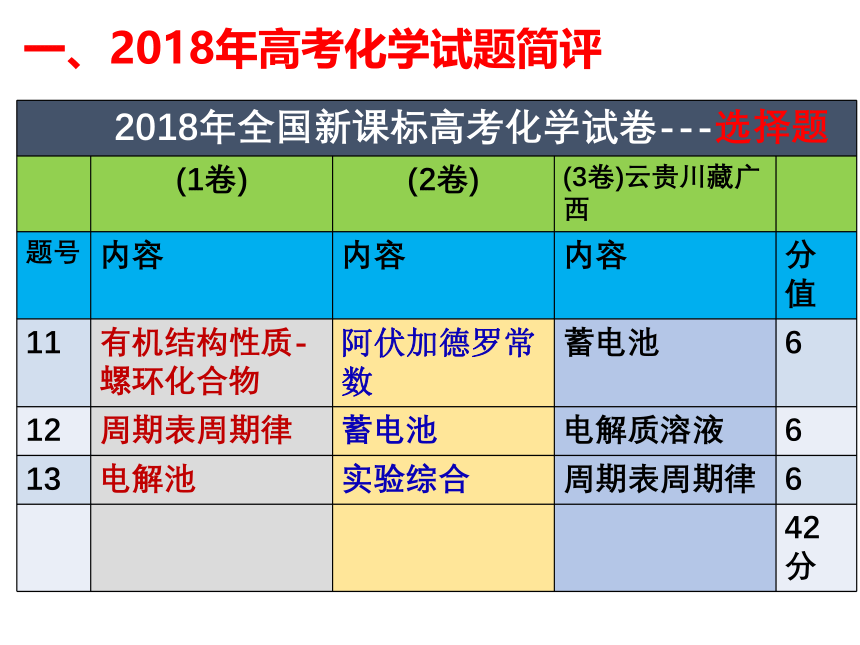
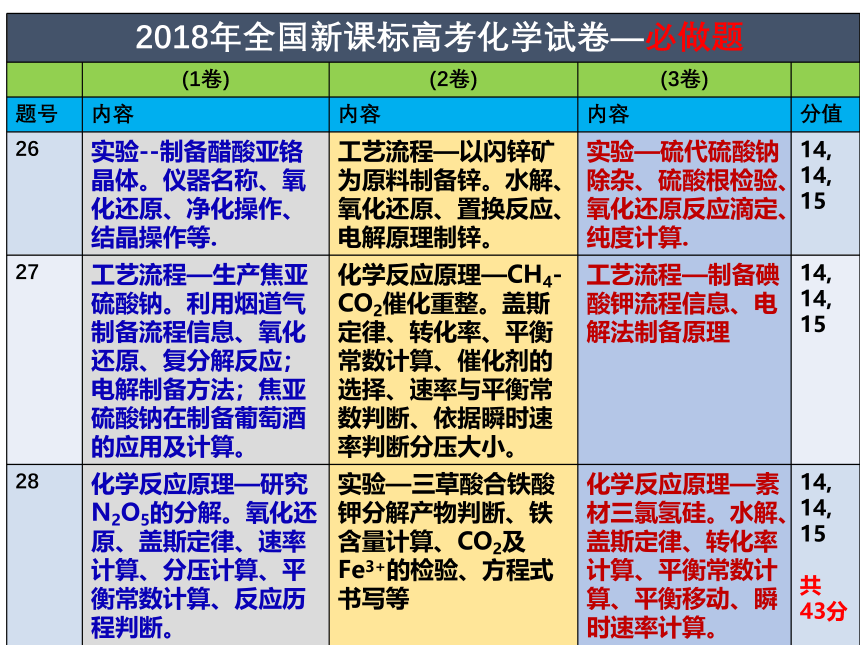
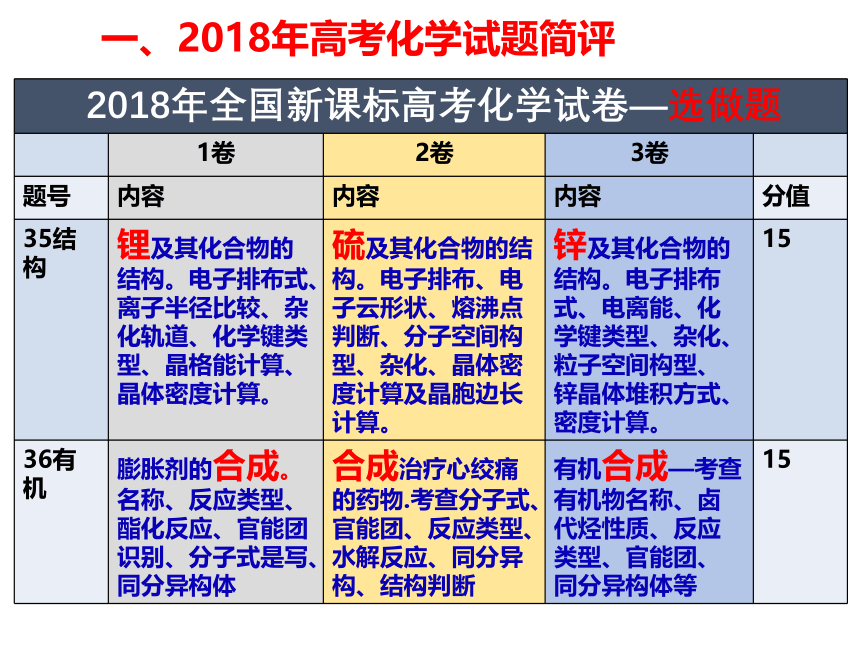
课件33张PPT。益阳市箴言中学2019届高考化学指导严谨求实细备考 勤苦奋进铸辉煌高三 化学备课组一、2018年高考化学试题简评一、2018年高考化学试题简评一、2018年高考化学试题简评 2018年的整体难度较中,尤其是非选择题。
学生普遍反映试题简单。这是因为入手顺畅,每道题都能做。但简单,不一定能得高分。因为此卷中化学计算多处出现,文字解释也多次出现,结构选做题有一定创新。 二、 2019年高考化学考纲深度解读 从近几年高考试题来看,高考对该部分的考查基本方向变化很小,重点在于突出化学学科的价值,体现化学在生产、生活、科技、环保等领域的应用;近两年出现了结合我国古代、近代化学成就体现化学知识的题目以及工业生产路线分析型的题目,均体现化学学科核心素养与知识的融合。复习时应了解常见物质的性质与用途,并关注最新科技成果和古代化学成就。模块一: 化学学科特点和基本研究方法 2. 化学用语及常用物理量二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论1. 物质的组成、性质和分类 近几年高考对该部分内容的考查相对稳定,主要以选择题的形式呈现,考查常见物质的简单性质、物质的类别以及相关概念的辨析。物质的组成、性质和分类在高考试题中常见于选择题的若干选项或者非选择题中的一小问,所占分值较小,但渗透于整个高中化学知识体系中。 溶液这一部分主要考查基本概念和基础知识。高考中一般会从以下几个角度进行命题:
(1)联系生活、生产实际考查胶体的性质和应用;
(2)联系阿伏伽德罗常数考查胶体的特征和制备;
(3)联系化学实验考查一定物质的量浓度溶液的配制;(4)联系反应原理考查物质的量浓度的有关计算二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论 3.溶液 物质结构和元素周期律是高中化学的重要主干知识,近几年高考对本部分内容的考也比较固定,重点在选择题中以残缺周期表或原子核外电子排布规律、物质性质等为载体命题,偶尔也会在非选择题中设置一小问考查元素周期律知识。 二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论4. 物质结构和元素周期律 模块二:化学基本概念和基本理论二、 2019年高考化学考纲深度解读 化学反应原理是高中主干知识,在高考中所占分值比例也较大,难度中等。高考对该部分内容的考查,在选择题中,着重考查新情境下原电池原理和电解池原理的应用,涉及的知识点有电极的判断、电极反应式的判断、电解液pH的变化情况判断等;在非选择题中,主要考查盖斯定律的运用以及反应热的计算,电极反应式的书写、陌生氧化还原反应方程式的书写等,也不时会涉及电化学原理的考查。5. 化学反应与能量 高考对本部分内容的考查常常结合氧化还原反应、热化学、电解质溶液中的平衡进行组合命题,重点以有气体参与的可逆反应为载体,考查化学反应速率的比较或计算、化学平衡状态的判断、转化率、化学平衡常数的相关计算以及平衡移动等,有时也会以溶液中的可逆反应为载体进行命题。本部分知识难度较大,计算量也较大。化学反应速率通常改为速率表达式,计算瞬时速率,用物质的量分数与压强表示,实用性与可操作性强。
二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论6. 化学反应速率和化学平衡 本部分内容是高中化学知识体系中的一大难点,也是高考必考内容,且试题难度较大。高考对本部分内容的重点考查方向有:(1)中和滴定图像分析及有关计算;(2)微粒浓度关系判断;(3)沉淀溶解平衡及溶度积常数的应用;(4)溶液中的离子反应(离子共存和离子推断);(5)结合图像考查弱电解质的电离和盐类的水解等。在选择题中,通常会设置一道压轴题考查电解质溶液,多会结合图像进行考查,在非选择题中,一般不会单独命题,常会在化学反应原理综合题或工艺流程题中设置一两小问进行考查。新增盐类水解平衡常数Kh二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论7.电解质溶液
由于高考试题的题量有限,高考中一般很少出现单独就无机物进行命题,主要考查方式是结合化学实验或工艺流程对常见无机物的性质、制备进行考查。
重点考查方向:
(1)结合实验考查无机物之间的反应;
(2)以无机工艺流程为载体考查无机物之间的转化;
(3)常见无机物的鉴别与推断。
重点考查元素:Na、Al、Fe、S、Cl、N。 二、 2019年高考化学考纲深度解读模块三 : 常见无机物及其应用
高考中关于常见有机物及其应用内容的考查通常以选择题的形式出现,难度适中。涉及的有机物类型通常有:烷烃、烯烃、芳香烃、卤代烃。
主要有以下考查方向:
(1)有机物的结构、性质与应用的判断;
(2)限定条件下的同分异构体的数目判断;
(3)陌生有机物的结构与性质的判断;
(4)有机反应类型的判断。
另外还经常涉及原子共面判断以及有机物的鉴别与分离。 二、 2019年高考化学考纲深度解读模块四 : 常见有机物及其应用 在高考中,化学实验在选择题和非选择题中均会考查所占分值较高,主要考查化学实验基础知识、基本操作、实验数据分析和处理、实验方案的设计与评价等。从近几年高考试题的命题趋势来看,题目的难度先增加,到了2018年难度又有所下降,预计2019年总体难度会保持稳定。主要考查角度:
(1)常见仪器的识别;
(2)仪器的连接顺序;
(3)实验试剂的选择或用途描述;
(4)物质的除杂与分离;
(5)实验现象的判断;
(6)实验方案的设计;
(7)实验结论的评价与计算。实验装置的选择与连接是重点二、 2019年高考化学考纲深度解读模块五 : 化学实验基础 《有机化学基础》选考题考查形式为有机合成与推断大题,题型非常固定。该题常以有机新材料、医药新产品、生活调料品为题材,以“流程图+信息”为载体,流程图中的物质以分子式、字母、结构简式、名称等形式呈现,考查有机物的性质与转化关系、同分异构体、有机化学用语及考生的逻辑推理能力,信息量大,陌生程度高,是典型的综合类题目。高考考点主要有:(1)有机物的命名和官能团名称的书写;(2)反应类型的判断;(3)有机物结构简式的书写及相关计算;(4)有机化学方程式的书写;(5)限定条件下同分异构体的书写(有可能不要求写种数,或种数不会太多);(6)有机合成路线的设计(一般由题给信息迁移,合成步骤不会太多3—4步)。从知识和能力上看,考查的是有机主干基础知识,同时考查了学生对知识理解、综合应用能力以及信息获取能力等化学核心素养。二、 2019年高考化学考纲深度解读模块六: 有机化学基础观念入心:做题即考试,作答即得分。
方法入手:答题习惯再具体,分类精准再指导
(1)做题的心态,审题的关键,思考的过程,作答的习惯
(2)化学用语表达:名称,化学式,离子方程式,化学方程式
电极反应式、总反应式,热化学方程式等
(3)文字叙述:确定思路+熟记模板+用语规范
(4)计算结果:表达式,计算式,比值,百分数,有效数字保
留等
(5)每次考后的反思总结抓手:得分经验,丢分教训,如何
避免?
11、结合题型考向特点,变学法为考法指导向状态,习惯再要30分!三、 2019年高考化学备考措施三、 2019年高考化学备考措施2、重读教材1)溶液的配制(必修1-P16)、中和热测定(选修4-P4)
滴定曲线(选修4-P50)
2)混合物的分离提纯:
过滤、蒸发、重结晶、蒸馏、萃取(必修1-P6、选修5-P18/19)
3)金属(Na、K、Mg、Al、Fe)与水反应装置和现象(必修1-P50、必修2-P6、必修2-P16)
钠、铝箔、钾与氧气的反应现象(必修1-P48,必修2-P6)
Mg、Al与酸碱的反应(必修1-P51、必修2-P6)
铝热反应(必修2-P89)
pH试纸使用
4)Fe(OH)3、Al(OH)3、H2SiO3胶体制备与性质(必修1P26、P59、P76)3、整合教材实验15)碳酸钠和NaHCO3碱性比较和分解实验装置(必修1-P56)
6)氢氧化铝的制备和性质(必修1-P58)
7)Fe(OH)2、Fe(OH)3的制备、转化
(必修1-P60、选修4-P87)
钢铁的析氢吸氧腐蚀(选修4-P85)
8)Cl2的制备和漂白性(必修1-P84)3、整合教材实验19)以及Fe2+和Fe3+的检验Cl-的检验(必修1-P61/86)
10)H2SO4的速率测定实验(选修4-P18);H2O2加入MnO2和FeCl3反应速率比较、KMnO4与H2C2O4的反应褪色实验(或加入MnSO4)、Na2S2O3与H2SO4变浑浊实验、KI与H2SO4溶液在氧气中的反应(选修4-P20/21/23)3、整合教材实验14、高考题和对应教材:金属的腐蚀和防腐4、高考题和对应教材:金属的腐蚀和防腐4、高考题和对应教材:高考题来自课本客观题--保分题
阿伏伽德罗常数
有机化学基础
元素周期表、律
化学与STSE
基础实验梳理高考题考查角度
明确每个题型的考点
总结各个题型的思路
高考题 模拟题训练5、理清思路,强化学科短板1元素周期律与推断【18年全国Ⅰ卷】 12.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A.常温常压下X的单质为气态 B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价
【18年全国Ⅱ卷】10.W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
1题型示例【 18年新课标Ⅲ卷-12 】 13.W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是
A.原子半径大小为W<X<Y<Z
B.X的氢化物水溶液酸性强于Z的
C.Y2W2与ZW2均含有非极性共价键
D.标准状况下W的单质状态与X的相同
【17年新课标Ⅰ卷-12】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期元素周期律与推断专题1专题示例2、考查角度:
(1)正、负极(阴阳极)的判断
(2)电子、离子的流向
(3)电极反应式的书写
(4)依据电子守恒的相关计算
(5)与金属腐蚀相融合
(6)与物理学科的综合1电化学专题:3、突破思路:【学科素养:宏观辨识与微观分析,模型认知】
宏观分析与微观辨析相结合,构建认知模型1、命题方向:多以新型电池材料为背景,真正贯彻考试中心
展现成果,突出贡献,发挥学科育人功能用电器或电源电化学认知模型(单液)体现宏观辨识与微观探析素养1电化学改进装置模型离子导体
盐 桥
构成闭合回路;
平衡电荷;
将氧化剂和还原剂隔开,提高电池效率交换膜
选择性透过某些离子11化学工艺流程题明确命题方向:
一是真实工业生产情境。应用性(通过设置新颖的问题情境,引导学生关注社会进步和科学发展)
二是信息大,呈现方式多样。创新性(提供新知识或原有知识的延伸拓展信息,考查探究能力和创新精神)
三是跨度大,考查内容广泛。综合性(考察学生综合运用学科知识、思维方法,多角度地观察、思考,发现、分析和解决问题的能力)
1化学工艺流程题
学生普遍反映试题简单。这是因为入手顺畅,每道题都能做。但简单,不一定能得高分。因为此卷中化学计算多处出现,文字解释也多次出现,结构选做题有一定创新。 二、 2019年高考化学考纲深度解读 从近几年高考试题来看,高考对该部分的考查基本方向变化很小,重点在于突出化学学科的价值,体现化学在生产、生活、科技、环保等领域的应用;近两年出现了结合我国古代、近代化学成就体现化学知识的题目以及工业生产路线分析型的题目,均体现化学学科核心素养与知识的融合。复习时应了解常见物质的性质与用途,并关注最新科技成果和古代化学成就。模块一: 化学学科特点和基本研究方法 2. 化学用语及常用物理量二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论1. 物质的组成、性质和分类 近几年高考对该部分内容的考查相对稳定,主要以选择题的形式呈现,考查常见物质的简单性质、物质的类别以及相关概念的辨析。物质的组成、性质和分类在高考试题中常见于选择题的若干选项或者非选择题中的一小问,所占分值较小,但渗透于整个高中化学知识体系中。 溶液这一部分主要考查基本概念和基础知识。高考中一般会从以下几个角度进行命题:
(1)联系生活、生产实际考查胶体的性质和应用;
(2)联系阿伏伽德罗常数考查胶体的特征和制备;
(3)联系化学实验考查一定物质的量浓度溶液的配制;(4)联系反应原理考查物质的量浓度的有关计算二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论 3.溶液 物质结构和元素周期律是高中化学的重要主干知识,近几年高考对本部分内容的考也比较固定,重点在选择题中以残缺周期表或原子核外电子排布规律、物质性质等为载体命题,偶尔也会在非选择题中设置一小问考查元素周期律知识。 二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论4. 物质结构和元素周期律 模块二:化学基本概念和基本理论二、 2019年高考化学考纲深度解读 化学反应原理是高中主干知识,在高考中所占分值比例也较大,难度中等。高考对该部分内容的考查,在选择题中,着重考查新情境下原电池原理和电解池原理的应用,涉及的知识点有电极的判断、电极反应式的判断、电解液pH的变化情况判断等;在非选择题中,主要考查盖斯定律的运用以及反应热的计算,电极反应式的书写、陌生氧化还原反应方程式的书写等,也不时会涉及电化学原理的考查。5. 化学反应与能量 高考对本部分内容的考查常常结合氧化还原反应、热化学、电解质溶液中的平衡进行组合命题,重点以有气体参与的可逆反应为载体,考查化学反应速率的比较或计算、化学平衡状态的判断、转化率、化学平衡常数的相关计算以及平衡移动等,有时也会以溶液中的可逆反应为载体进行命题。本部分知识难度较大,计算量也较大。化学反应速率通常改为速率表达式,计算瞬时速率,用物质的量分数与压强表示,实用性与可操作性强。
二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论6. 化学反应速率和化学平衡 本部分内容是高中化学知识体系中的一大难点,也是高考必考内容,且试题难度较大。高考对本部分内容的重点考查方向有:(1)中和滴定图像分析及有关计算;(2)微粒浓度关系判断;(3)沉淀溶解平衡及溶度积常数的应用;(4)溶液中的离子反应(离子共存和离子推断);(5)结合图像考查弱电解质的电离和盐类的水解等。在选择题中,通常会设置一道压轴题考查电解质溶液,多会结合图像进行考查,在非选择题中,一般不会单独命题,常会在化学反应原理综合题或工艺流程题中设置一两小问进行考查。新增盐类水解平衡常数Kh二、 2019年高考化学考纲深度解读模块二:化学基本概念和基本理论7.电解质溶液
由于高考试题的题量有限,高考中一般很少出现单独就无机物进行命题,主要考查方式是结合化学实验或工艺流程对常见无机物的性质、制备进行考查。
重点考查方向:
(1)结合实验考查无机物之间的反应;
(2)以无机工艺流程为载体考查无机物之间的转化;
(3)常见无机物的鉴别与推断。
重点考查元素:Na、Al、Fe、S、Cl、N。 二、 2019年高考化学考纲深度解读模块三 : 常见无机物及其应用
高考中关于常见有机物及其应用内容的考查通常以选择题的形式出现,难度适中。涉及的有机物类型通常有:烷烃、烯烃、芳香烃、卤代烃。
主要有以下考查方向:
(1)有机物的结构、性质与应用的判断;
(2)限定条件下的同分异构体的数目判断;
(3)陌生有机物的结构与性质的判断;
(4)有机反应类型的判断。
另外还经常涉及原子共面判断以及有机物的鉴别与分离。 二、 2019年高考化学考纲深度解读模块四 : 常见有机物及其应用 在高考中,化学实验在选择题和非选择题中均会考查所占分值较高,主要考查化学实验基础知识、基本操作、实验数据分析和处理、实验方案的设计与评价等。从近几年高考试题的命题趋势来看,题目的难度先增加,到了2018年难度又有所下降,预计2019年总体难度会保持稳定。主要考查角度:
(1)常见仪器的识别;
(2)仪器的连接顺序;
(3)实验试剂的选择或用途描述;
(4)物质的除杂与分离;
(5)实验现象的判断;
(6)实验方案的设计;
(7)实验结论的评价与计算。实验装置的选择与连接是重点二、 2019年高考化学考纲深度解读模块五 : 化学实验基础 《有机化学基础》选考题考查形式为有机合成与推断大题,题型非常固定。该题常以有机新材料、医药新产品、生活调料品为题材,以“流程图+信息”为载体,流程图中的物质以分子式、字母、结构简式、名称等形式呈现,考查有机物的性质与转化关系、同分异构体、有机化学用语及考生的逻辑推理能力,信息量大,陌生程度高,是典型的综合类题目。高考考点主要有:(1)有机物的命名和官能团名称的书写;(2)反应类型的判断;(3)有机物结构简式的书写及相关计算;(4)有机化学方程式的书写;(5)限定条件下同分异构体的书写(有可能不要求写种数,或种数不会太多);(6)有机合成路线的设计(一般由题给信息迁移,合成步骤不会太多3—4步)。从知识和能力上看,考查的是有机主干基础知识,同时考查了学生对知识理解、综合应用能力以及信息获取能力等化学核心素养。二、 2019年高考化学考纲深度解读模块六: 有机化学基础观念入心:做题即考试,作答即得分。
方法入手:答题习惯再具体,分类精准再指导
(1)做题的心态,审题的关键,思考的过程,作答的习惯
(2)化学用语表达:名称,化学式,离子方程式,化学方程式
电极反应式、总反应式,热化学方程式等
(3)文字叙述:确定思路+熟记模板+用语规范
(4)计算结果:表达式,计算式,比值,百分数,有效数字保
留等
(5)每次考后的反思总结抓手:得分经验,丢分教训,如何
避免?
11、结合题型考向特点,变学法为考法指导向状态,习惯再要30分!三、 2019年高考化学备考措施三、 2019年高考化学备考措施2、重读教材1)溶液的配制(必修1-P16)、中和热测定(选修4-P4)
滴定曲线(选修4-P50)
2)混合物的分离提纯:
过滤、蒸发、重结晶、蒸馏、萃取(必修1-P6、选修5-P18/19)
3)金属(Na、K、Mg、Al、Fe)与水反应装置和现象(必修1-P50、必修2-P6、必修2-P16)
钠、铝箔、钾与氧气的反应现象(必修1-P48,必修2-P6)
Mg、Al与酸碱的反应(必修1-P51、必修2-P6)
铝热反应(必修2-P89)
pH试纸使用
4)Fe(OH)3、Al(OH)3、H2SiO3胶体制备与性质(必修1P26、P59、P76)3、整合教材实验15)碳酸钠和NaHCO3碱性比较和分解实验装置(必修1-P56)
6)氢氧化铝的制备和性质(必修1-P58)
7)Fe(OH)2、Fe(OH)3的制备、转化
(必修1-P60、选修4-P87)
钢铁的析氢吸氧腐蚀(选修4-P85)
8)Cl2的制备和漂白性(必修1-P84)3、整合教材实验19)以及Fe2+和Fe3+的检验Cl-的检验(必修1-P61/86)
10)H2SO4的速率测定实验(选修4-P18);H2O2加入MnO2和FeCl3反应速率比较、KMnO4与H2C2O4的反应褪色实验(或加入MnSO4)、Na2S2O3与H2SO4变浑浊实验、KI与H2SO4溶液在氧气中的反应(选修4-P20/21/23)3、整合教材实验14、高考题和对应教材:金属的腐蚀和防腐4、高考题和对应教材:金属的腐蚀和防腐4、高考题和对应教材:高考题来自课本客观题--保分题
阿伏伽德罗常数
有机化学基础
元素周期表、律
化学与STSE
基础实验梳理高考题考查角度
明确每个题型的考点
总结各个题型的思路
高考题 模拟题训练5、理清思路,强化学科短板1元素周期律与推断【18年全国Ⅰ卷】 12.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A.常温常压下X的单质为气态 B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价
【18年全国Ⅱ卷】10.W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
1题型示例【 18年新课标Ⅲ卷-12 】 13.W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是
A.原子半径大小为W<X<Y<Z
B.X的氢化物水溶液酸性强于Z的
C.Y2W2与ZW2均含有非极性共价键
D.标准状况下W的单质状态与X的相同
【17年新课标Ⅰ卷-12】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期元素周期律与推断专题1专题示例2、考查角度:
(1)正、负极(阴阳极)的判断
(2)电子、离子的流向
(3)电极反应式的书写
(4)依据电子守恒的相关计算
(5)与金属腐蚀相融合
(6)与物理学科的综合1电化学专题:3、突破思路:【学科素养:宏观辨识与微观分析,模型认知】
宏观分析与微观辨析相结合,构建认知模型1、命题方向:多以新型电池材料为背景,真正贯彻考试中心
展现成果,突出贡献,发挥学科育人功能用电器或电源电化学认知模型(单液)体现宏观辨识与微观探析素养1电化学改进装置模型离子导体
盐 桥
构成闭合回路;
平衡电荷;
将氧化剂和还原剂隔开,提高电池效率交换膜
选择性透过某些离子11化学工艺流程题明确命题方向:
一是真实工业生产情境。应用性(通过设置新颖的问题情境,引导学生关注社会进步和科学发展)
二是信息大,呈现方式多样。创新性(提供新知识或原有知识的延伸拓展信息,考查探究能力和创新精神)
三是跨度大,考查内容广泛。综合性(考察学生综合运用学科知识、思维方法,多角度地观察、思考,发现、分析和解决问题的能力)
1化学工艺流程题
同课章节目录
