人教版化学选修五:1.4.1有机化合物的分离、提纯课件 (共31张PPT)
文档属性
| 名称 | 人教版化学选修五:1.4.1有机化合物的分离、提纯课件 (共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-30 20:38:13 | ||
图片预览











文档简介
课件31张PPT。第四节 研究有机化合物的一般步骤和方法第1课时 有机化合物的分离、提纯知识铺垫新知预习自主测试1.蒸馏是利用互溶液体的沸点不同,除去易挥发、难挥发或不挥发的杂质。常用的玻璃仪器有酒精灯、锥形瓶、牛角管、温度计、蒸馏烧瓶、冷凝管等。
2.过滤是分离难溶性固体与液体的一种方法。常用玻璃仪器有:漏斗、烧杯、玻璃棒。
3.萃取是利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液中提取出来的一种方法;将萃取后两种互不相溶的液体分开的操作叫做分液。常用的玻璃仪器是分液漏斗。知识铺垫新知预习自主测试一、研究有机化合物的一般步骤
纯净物→元素定量分析→测定相对分子质量→波谱分析
↑ ↓ ↓ ↓
分离、提纯 确定实验式 确定分子式 确定结构式
二、有机物的分离与提纯
1.蒸馏
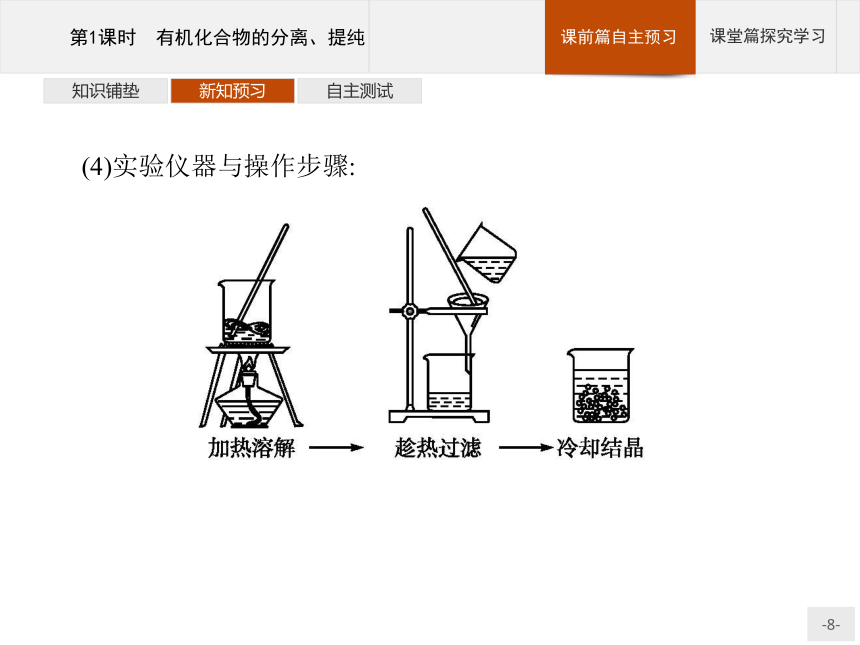
(1)用途:分离、提纯液态有机物。知识铺垫新知预习自主测试(3)装置和主要仪器: 知识铺垫新知预习自主测试2.重结晶
(1)用途:分离提纯固态有机物。
(2)原理:利用两种物质在同一溶剂中溶解度随温度的变化相差较大,采用冷却或蒸发将物质分离提纯。
(3)适用条件
①杂质在所选溶剂中溶解度很小或很大,易于除去。
②被提纯的有机化合物在所选溶剂中的溶解度,受温度的影响
较大。该有机化合物在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出。知识铺垫新知预习自主测试(4)实验仪器与操作步骤: 知识铺垫新知预习自主测试3.萃取
(1)原理:
液—液萃取是利用有机化合物在两种互不相溶的溶剂里溶解度的不同,将有机化合物从一种溶剂中转移到另一种溶剂中的过程。
固—液萃取是用有机溶剂从固体物质中溶解出有机化合物的过程。
(2)适用条件:有机化合物与杂质在某种溶剂中的溶解度有较大差异。
(3)实验装置:知识铺垫新知预习自主测试(4)实验操作:
加萃取剂后充分振荡,静置分层后,打开分液漏斗活塞,从下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出。
[思考]在苯甲酸的重结晶实验中,是不是结晶的温度越低越好?
提示不是。温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯的目的;温度极低,溶剂也会结晶,给实验操作带来麻烦。知识铺垫新知预习自主测试1.判断正误(正确的打“√”,错误的打“×”)。
(1)分离固体混合物的过程中,一般情况下需要先溶解。( )
(2)提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法。( )
(3)将Cl2与HCl的混合气体通过饱和食盐水可得到纯净的Cl2。( )
(4)分别用加热法除去NaCl中的NH4Cl与I2原理相同。( )
(5)用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出。( )
(6)将Mg(OH)2悬浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀。( )
答案(1)√ (2)× (3)× (4)× (5)× (6)×知识铺垫新知预习自主测试2.下列属于分离、提纯液态有机物操作的是( )
A.蒸馏 B.蒸发 C.重结晶 D.过滤
答案A
3.下列各组液体混合物,可以用分液漏斗分离的是 ( )
A.乙醇和水 B.溴乙烷和水
C.溴乙烷和氯仿 D.苯和溴苯
答案B
4.天然色素的提取往往应用到萃取操作,现在有用大量水提取的天然色素,下列溶剂不能用来萃取富集这些天然色素的是( )
A.石油醚 B.苯 C.乙醇 D.四氯化碳
答案C任务随堂演练有机物的分离、提纯
问题探究任务随堂演练1.图1所示有机物分离方法的名称是什么?实验中应注意哪些问题?
提示蒸馏。
蒸馏烧瓶中应加入沸石;温度计水银球位于蒸馏烧瓶支管口处;冷却水从下口进入,上口流出;实验开始先通冷却水,后加热等。
2.图2分离有机物方法的名称是什么?
提示分液。
3.工业乙醇含水、甲醇等杂质,通过蒸馏可获得含95.6%的乙醇和4.4%的水的共沸混合物,如果要制得无水乙醇,你有什么方法?
提示要除去乙醇中的少量水,可加入生石灰与水反应生成Ca(OH)2,再用蒸馏的方法分离出纯净的乙醇。即先加入生石灰后再蒸馏。任务随堂演练4.结合苯甲酸重结晶实验,试总结重结晶的操作流程。
提示思维建模
1.分离、提纯有机物的常用方法任务随堂演练任务随堂演练2.常见有机物的分离提纯方法(括号内为杂质) 典例引领
【例题】 某化学小组利用下图所示装置由环己醇制备环己烯。任务随堂演练任务随堂演练(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中加入碎瓷片的作用是 ,?
导管B除了导气外还具有的作用是? 。?
②试管C置于冰水浴中的目的是? 。?
(2)制备精品。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填“上”或“下”),分液后用 (填入编号)洗涤。?
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液任务随堂演练②再将环己烯按下图所示装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是 。?任务随堂演练③收集产品时,控制的温度应在 左右,实验制得的环己烯精品产量低于理论产量,可能的原因是 。?
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时部分环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 。?
a.用高锰酸钾酸性溶液 b.用金属钠 c.测定沸点任务随堂演练解析解答本题可以联想制备乙酸乙酯的实验装置。
(1)粗品的制备既要防止反应物暴沸,又要减少生成物挥发。
(2)精品的制备关键在于除杂,此过程涉及分液和蒸馏。环己烯密度比水小在上层,洗涤时选用KMnO4溶液会氧化环己烯,又因粗品中混有少量酸性物质,洗涤时不能再用稀硫酸,选用Na2CO3溶液可以除掉酸性杂质。其中的水分可用生石灰除去。由于环己醇的沸点较低,制备粗品时随产品一起蒸出,导致产量低于理论值。
(3)区分精品与粗品不能选用KMnO4酸性溶液,因为环己醇和环己烯皆可被KMnO4酸性溶液氧化;由于粗品中含有环己醇等,可与钠反应产生气体,故可用钠加以区分;测定沸点也能很好地区分二者。
答案(1)①防暴沸 冷凝 ②使环己烯冷凝,减少环己烯挥发 (2)①上 c ②g 除去水分 ③83 ℃ c (3)b、c任务随堂演练 分离提纯物质的“四原则” 任务随堂演练变式训练现拟分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,指出A、B、C、E所代表的分离所得有关物质的化学式。
(1)a ,b ;?
(2)① ,② ,③ ;?
(3)A ,B ,C ,E 。?任务随堂演练解析乙酸乙酯、乙酸和乙醇的分离,应该先用饱和Na2CO3溶液洗涤,首先分离出乙酸乙酯,而在洗涤液中留下CH3COONa和乙醇,再用蒸馏的方法蒸出乙醇,最后把CH3COONa转化为CH3COOH再蒸馏,即可得到CH3COOH。
答案(1)饱和Na2CO3溶液 稀硫酸
(2)分液 蒸馏 蒸馏
(3)乙酸乙酯 乙醇和乙酸钠 乙酸钠 乙醇任务随堂演练1.下图实验装置一般不用于分离物质的是( )
解析A项用于分离沸点不同的液体混合物;B项用于不相溶的液体化合物的分离;C项为液固混合物的分离——过滤;D项用于一定物质的量浓度溶液的配制,不用于分离物质。
答案D任务随堂演练2.现有一瓶乙二醇和丙三醇的混合液,已知它们的部分性质如下表所示:
据此,将乙二醇和丙三醇分离的最佳方法是( )
A.萃取 B.升华 C.蒸馏 D.蒸发
解析两种物质均属于醇类,可以互溶。从表中数据可知两者的沸点相差较大,故可用蒸馏法将其分离。
答案C任务随堂演练3.下列分离或除杂方法正确的是( )
A.用分液法分离水和酒精
B.用蒸馏法分离苯和溴苯
C.用燃烧的方法除去CH4中混有的少量H2
D.用催化加氢的方法除去乙烷中混有的少量乙烯
解析酒精和水以任意比例互溶,无法用分液法进行分离;CH4和H2都能燃烧,不能用燃烧法除去CH4中混有的少量H2;尽管催化加氢能使乙烯转变为乙烷,但H2的量难以控制,过量时会使乙烷中混有H2,不足时又不能除尽乙烯,且反应的条件要求很高,不适用于除杂。
答案B任务随堂演练4.除去下列物质中所含的杂质(括号内的物质),所选用的试剂不正确的是( )
A.乙酸(苯甲酸):NaOH溶液
B.甲烷(乙烯):溴水
C.苯(苯甲酸):NaOH溶液
D.乙炔(硫化氢):亚硫酸钠酸性溶液
解析乙酸和苯甲酸都能与NaOH反应,A项不正确;通过溴水洗气可以除去乙烯,B项正确;苯甲酸溶于NaOH溶液,用NaOH溶液充分溶解苯甲酸后进行分液,可以除去苯中的苯甲酸杂质,C项正确;通过亚硫酸钠酸性溶液可以除去乙炔中的硫化氢,因为硫化氢与亚硫酸钠反应生成了硫,D项正确。
答案A任务随堂演练5.选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1) 分离食盐水与沙子的混合物。?
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。?
(3) 分离水和汽油的混合物。?
(4) 分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。?
(5) 除去混在乙烷中的乙烯。?
(6) 提取碘水中的碘。?任务随堂演练解析沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大,而NaCl在水中的溶解度受温度影响不大,采用重结晶和过滤的方法可将其分离;水和汽油互不相溶,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点相差大于30 ℃,可用蒸馏法分离;乙烯可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液的方法提取。
答案(1)F (2)CF (3)D (4)E (5)G (6)A
2.过滤是分离难溶性固体与液体的一种方法。常用玻璃仪器有:漏斗、烧杯、玻璃棒。
3.萃取是利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液中提取出来的一种方法;将萃取后两种互不相溶的液体分开的操作叫做分液。常用的玻璃仪器是分液漏斗。知识铺垫新知预习自主测试一、研究有机化合物的一般步骤
纯净物→元素定量分析→测定相对分子质量→波谱分析
↑ ↓ ↓ ↓
分离、提纯 确定实验式 确定分子式 确定结构式
二、有机物的分离与提纯
1.蒸馏
(1)用途:分离、提纯液态有机物。知识铺垫新知预习自主测试(3)装置和主要仪器: 知识铺垫新知预习自主测试2.重结晶
(1)用途:分离提纯固态有机物。
(2)原理:利用两种物质在同一溶剂中溶解度随温度的变化相差较大,采用冷却或蒸发将物质分离提纯。
(3)适用条件
①杂质在所选溶剂中溶解度很小或很大,易于除去。
②被提纯的有机化合物在所选溶剂中的溶解度,受温度的影响
较大。该有机化合物在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出。知识铺垫新知预习自主测试(4)实验仪器与操作步骤: 知识铺垫新知预习自主测试3.萃取
(1)原理:
液—液萃取是利用有机化合物在两种互不相溶的溶剂里溶解度的不同,将有机化合物从一种溶剂中转移到另一种溶剂中的过程。
固—液萃取是用有机溶剂从固体物质中溶解出有机化合物的过程。
(2)适用条件:有机化合物与杂质在某种溶剂中的溶解度有较大差异。
(3)实验装置:知识铺垫新知预习自主测试(4)实验操作:
加萃取剂后充分振荡,静置分层后,打开分液漏斗活塞,从下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出。
[思考]在苯甲酸的重结晶实验中,是不是结晶的温度越低越好?
提示不是。温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯的目的;温度极低,溶剂也会结晶,给实验操作带来麻烦。知识铺垫新知预习自主测试1.判断正误(正确的打“√”,错误的打“×”)。
(1)分离固体混合物的过程中,一般情况下需要先溶解。( )
(2)提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法。( )
(3)将Cl2与HCl的混合气体通过饱和食盐水可得到纯净的Cl2。( )
(4)分别用加热法除去NaCl中的NH4Cl与I2原理相同。( )
(5)用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出。( )
(6)将Mg(OH)2悬浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀。( )
答案(1)√ (2)× (3)× (4)× (5)× (6)×知识铺垫新知预习自主测试2.下列属于分离、提纯液态有机物操作的是( )
A.蒸馏 B.蒸发 C.重结晶 D.过滤
答案A
3.下列各组液体混合物,可以用分液漏斗分离的是 ( )
A.乙醇和水 B.溴乙烷和水
C.溴乙烷和氯仿 D.苯和溴苯
答案B
4.天然色素的提取往往应用到萃取操作,现在有用大量水提取的天然色素,下列溶剂不能用来萃取富集这些天然色素的是( )
A.石油醚 B.苯 C.乙醇 D.四氯化碳
答案C任务随堂演练有机物的分离、提纯
问题探究任务随堂演练1.图1所示有机物分离方法的名称是什么?实验中应注意哪些问题?
提示蒸馏。
蒸馏烧瓶中应加入沸石;温度计水银球位于蒸馏烧瓶支管口处;冷却水从下口进入,上口流出;实验开始先通冷却水,后加热等。
2.图2分离有机物方法的名称是什么?
提示分液。
3.工业乙醇含水、甲醇等杂质,通过蒸馏可获得含95.6%的乙醇和4.4%的水的共沸混合物,如果要制得无水乙醇,你有什么方法?
提示要除去乙醇中的少量水,可加入生石灰与水反应生成Ca(OH)2,再用蒸馏的方法分离出纯净的乙醇。即先加入生石灰后再蒸馏。任务随堂演练4.结合苯甲酸重结晶实验,试总结重结晶的操作流程。
提示思维建模
1.分离、提纯有机物的常用方法任务随堂演练任务随堂演练2.常见有机物的分离提纯方法(括号内为杂质) 典例引领
【例题】 某化学小组利用下图所示装置由环己醇制备环己烯。任务随堂演练任务随堂演练(1)制备粗品:将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中加入碎瓷片的作用是 ,?
导管B除了导气外还具有的作用是? 。?
②试管C置于冰水浴中的目的是? 。?
(2)制备精品。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填“上”或“下”),分液后用 (填入编号)洗涤。?
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液任务随堂演练②再将环己烯按下图所示装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是 。?任务随堂演练③收集产品时,控制的温度应在 左右,实验制得的环己烯精品产量低于理论产量,可能的原因是 。?
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时部分环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 。?
a.用高锰酸钾酸性溶液 b.用金属钠 c.测定沸点任务随堂演练解析解答本题可以联想制备乙酸乙酯的实验装置。
(1)粗品的制备既要防止反应物暴沸,又要减少生成物挥发。
(2)精品的制备关键在于除杂,此过程涉及分液和蒸馏。环己烯密度比水小在上层,洗涤时选用KMnO4溶液会氧化环己烯,又因粗品中混有少量酸性物质,洗涤时不能再用稀硫酸,选用Na2CO3溶液可以除掉酸性杂质。其中的水分可用生石灰除去。由于环己醇的沸点较低,制备粗品时随产品一起蒸出,导致产量低于理论值。
(3)区分精品与粗品不能选用KMnO4酸性溶液,因为环己醇和环己烯皆可被KMnO4酸性溶液氧化;由于粗品中含有环己醇等,可与钠反应产生气体,故可用钠加以区分;测定沸点也能很好地区分二者。
答案(1)①防暴沸 冷凝 ②使环己烯冷凝,减少环己烯挥发 (2)①上 c ②g 除去水分 ③83 ℃ c (3)b、c任务随堂演练 分离提纯物质的“四原则” 任务随堂演练变式训练现拟分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,指出A、B、C、E所代表的分离所得有关物质的化学式。
(1)a ,b ;?
(2)① ,② ,③ ;?
(3)A ,B ,C ,E 。?任务随堂演练解析乙酸乙酯、乙酸和乙醇的分离,应该先用饱和Na2CO3溶液洗涤,首先分离出乙酸乙酯,而在洗涤液中留下CH3COONa和乙醇,再用蒸馏的方法蒸出乙醇,最后把CH3COONa转化为CH3COOH再蒸馏,即可得到CH3COOH。
答案(1)饱和Na2CO3溶液 稀硫酸
(2)分液 蒸馏 蒸馏
(3)乙酸乙酯 乙醇和乙酸钠 乙酸钠 乙醇任务随堂演练1.下图实验装置一般不用于分离物质的是( )
解析A项用于分离沸点不同的液体混合物;B项用于不相溶的液体化合物的分离;C项为液固混合物的分离——过滤;D项用于一定物质的量浓度溶液的配制,不用于分离物质。
答案D任务随堂演练2.现有一瓶乙二醇和丙三醇的混合液,已知它们的部分性质如下表所示:
据此,将乙二醇和丙三醇分离的最佳方法是( )
A.萃取 B.升华 C.蒸馏 D.蒸发
解析两种物质均属于醇类,可以互溶。从表中数据可知两者的沸点相差较大,故可用蒸馏法将其分离。
答案C任务随堂演练3.下列分离或除杂方法正确的是( )
A.用分液法分离水和酒精
B.用蒸馏法分离苯和溴苯
C.用燃烧的方法除去CH4中混有的少量H2
D.用催化加氢的方法除去乙烷中混有的少量乙烯
解析酒精和水以任意比例互溶,无法用分液法进行分离;CH4和H2都能燃烧,不能用燃烧法除去CH4中混有的少量H2;尽管催化加氢能使乙烯转变为乙烷,但H2的量难以控制,过量时会使乙烷中混有H2,不足时又不能除尽乙烯,且反应的条件要求很高,不适用于除杂。
答案B任务随堂演练4.除去下列物质中所含的杂质(括号内的物质),所选用的试剂不正确的是( )
A.乙酸(苯甲酸):NaOH溶液
B.甲烷(乙烯):溴水
C.苯(苯甲酸):NaOH溶液
D.乙炔(硫化氢):亚硫酸钠酸性溶液
解析乙酸和苯甲酸都能与NaOH反应,A项不正确;通过溴水洗气可以除去乙烯,B项正确;苯甲酸溶于NaOH溶液,用NaOH溶液充分溶解苯甲酸后进行分液,可以除去苯中的苯甲酸杂质,C项正确;通过亚硫酸钠酸性溶液可以除去乙炔中的硫化氢,因为硫化氢与亚硫酸钠反应生成了硫,D项正确。
答案A任务随堂演练5.选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1) 分离食盐水与沙子的混合物。?
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。?
(3) 分离水和汽油的混合物。?
(4) 分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。?
(5) 除去混在乙烷中的乙烯。?
(6) 提取碘水中的碘。?任务随堂演练解析沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大,而NaCl在水中的溶解度受温度影响不大,采用重结晶和过滤的方法可将其分离;水和汽油互不相溶,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点相差大于30 ℃,可用蒸馏法分离;乙烯可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液的方法提取。
答案(1)F (2)CF (3)D (4)E (5)G (6)A
