人教版高中化学必修二4.1开发利用金属矿物和海水资源课件(共44张PPT)
文档属性
| 名称 | 人教版高中化学必修二4.1开发利用金属矿物和海水资源课件(共44张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-30 21:40:38 | ||
图片预览








文档简介
课件44张PPT。开发利用金属矿物和海水资源第1课时知识与技能目标:帮助学生体会和认识化学在矿物资源开发利用中的意义和作用;掌握金属的冶炼方法。
过程与方法目标:自主学习,培养学生自学能力;通过了解金属资源的开发及冶炼培养学生的归纳能力、比较能力。
情感、态度与价值观目标: 帮助学生树立节约资源、爱护环境、变废为宝等意识。 金属矿物的开发和利用含三价铁的红色石英自然界中存在着丰富的矿产资源纤磷锰铁矿蓝 铜 矿赤 铁 矿“金属的冶炼”的实质是什么? 冶炼金属的实质是用还原的方法
使金属化合物中的金属离子得到
电子变成金属原子。 将金属从其化合物中还原出来用于生产和制造各种金属材料的过程在工业上称为金属的冶炼。冶炼金属的方法根据金属的活动性顺序不同,采取不同的冶炼方法1、热分解法(适合一些不活泼金属)
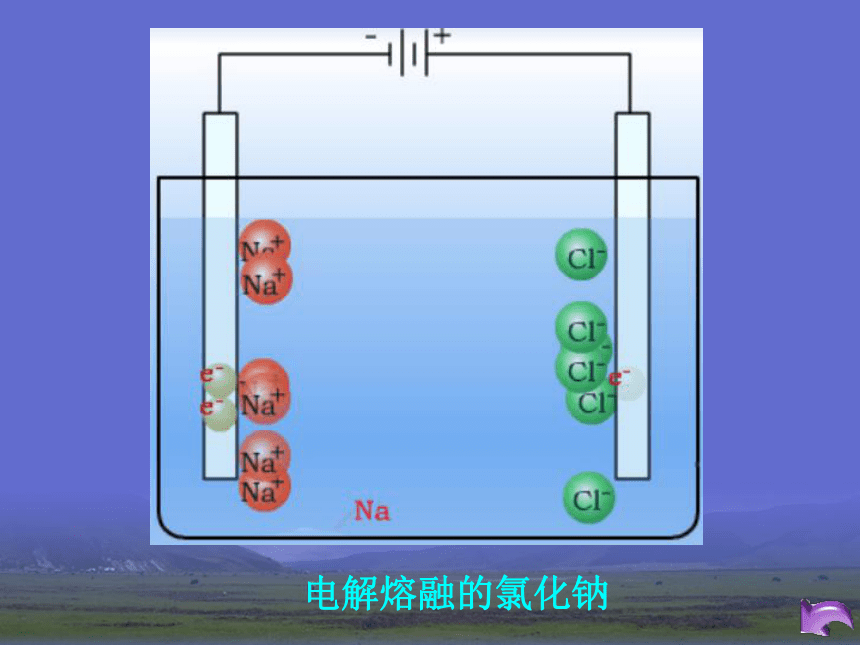
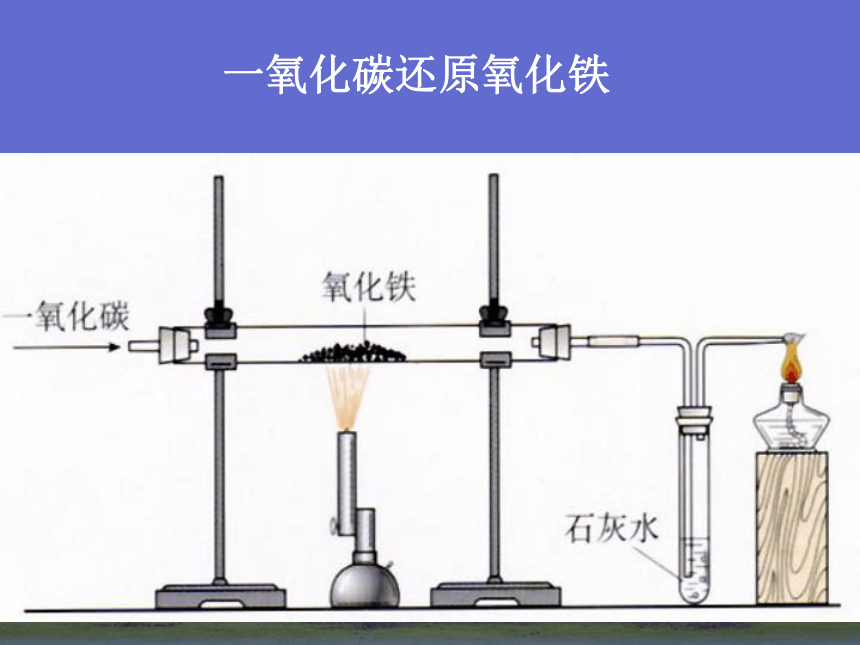
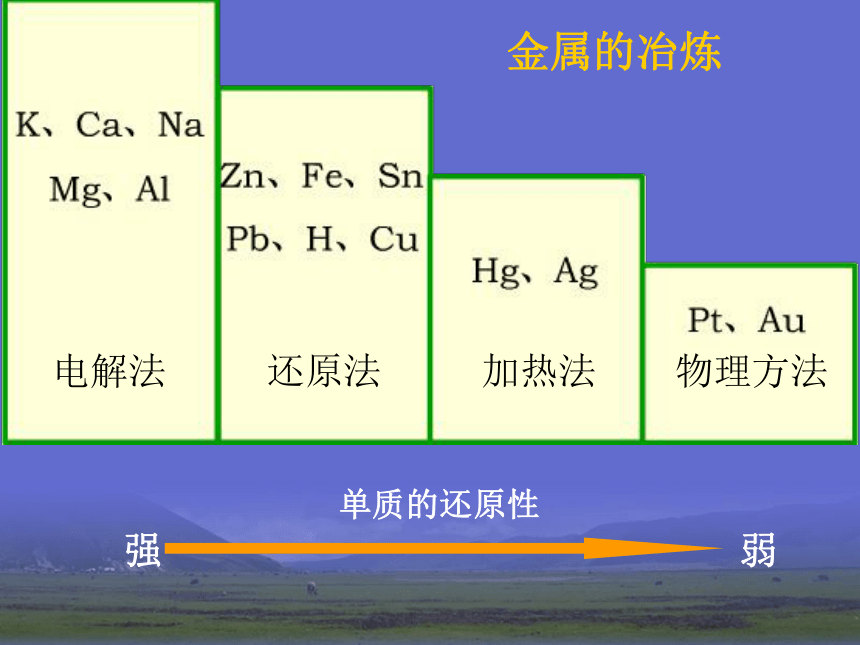
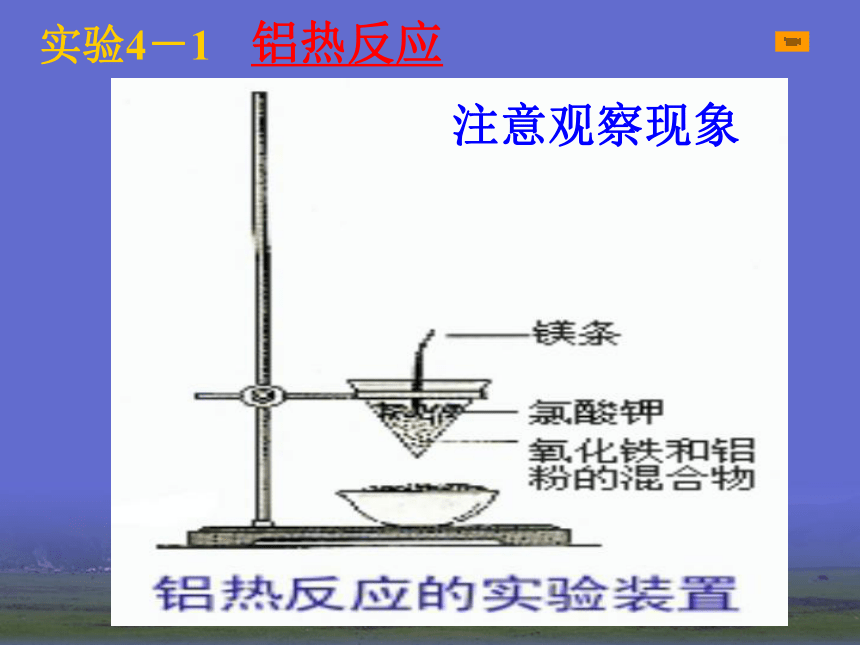
2HgO = 2Hg + O2 ↑加热2Ag2O = 4Ag + O2 ↑加热2、电解法(适合一些非常活泼金属) MgCl2 (熔融) = Mg + Cl2 ↑电解2Al2O3 (熔融) = 4Al + 3O2 ↑电解冰晶石2NaCl (熔融) = 2Na + Cl2 ↑电解电解熔融的氯化钠3、热还原法(适合大部分金属)CuO+H2 = Cu + H2O高温Fe2O3 + 3CO = 2Fe + 3CO2 ↑高温一氧化碳还原氧化铁单质的还原性强弱电解法还原法加热法物理方法金属的冶炼实验4-1 铝热反应注意观察现象反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。1、镁条的作用是什么?
2、氯酸钾的作用是什么?铝热剂问题:与氧气反应放出大量的热,为铝热反应提供热量。受热分解产生氧气,使镁条继续燃烧提供热量。其它铝热反应 铝热反应的应用??????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
??? 铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等合理开发和利用矿物资源,主要途径有:… … … … … 地球上的金属资源是有限的,必须合理开发和利用矿产资源,加强金属资源的回收和再利用。练习1、下列各种冶炼方法中,可以制得
相应金属的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
2、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na ②Zn
③Hg ④Au
C电解法加热还原法加热分解法物理提取法冶炼金属常用以下几种方法:
(1)以C或H2、CO作还原剂还原法;(2)热分解法(3)电解法(4)铝热法。现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼的方法。Al:______ Hg:______
Mg:______ Mn:______
Cu:______(3)(3)(1)(2)(4)开发利用金属矿物和海水资源第2课时a、海洋生物资源海洋资源b、海洋中的矿产资源含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多,被称为“元素的故乡”。海水中铀多达45亿吨
是已知陆地铀矿储量
的4500倍。氘有50亿
吨足够人类用上千万
年c、海水中的化学资源1、海水资源的广泛性:海洋约占地球表面积71%
海洋中的资源 :
动物:(鱼类、海狮、海马、贝类………
植物:(海草、海带…………
矿物:(各种盐、NaCl、MgCl2 ……….
海底金属结核矿、石油
水 : (水资源及各种溶解的盐类
2、海水资源的利用: 主要有:
1.海水中水资源的利用 海水的淡化(咸水 淡水)
2.直接利用海水进行循环冷却(作冷却用水)海水的淡化:(1)海水淡化的途径:
从海水中提取淡水
从海水中分离出盐
(2)海水淡化的方法:
蒸 馏 法(最先使用,技术成熟,但成本高)
电渗析法(成本低,但未能大量生产)
离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)蒸馏法所用的装置及原理原理:加热到水的沸点, 使水汽化变成水蒸气,再冷凝得淡水。
注意:图4-3海水蒸馏原理示意图进冷却水 出太阳能蒸发原理示意图用高分子分离膜淡化海水利用海水进行循环冷却天津碱厂海水循环冷却装置海水中溶解和悬浮有大量的无机物和有机物,按含量计,H、O、Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等元素超过总量的99%,其他为微量元素,总计含有80多种元素。3、海水的综合利用(1)海水制盐——生产NaCl
(2) NaCl的水溶液制NaOH
(3)制金属Na
(4)制Na2CO3
2 NaOH + CO2= Na2CO3 + H2O 煮
海为
盐海水晒盐海水浓缩过滤蒸发结晶食盐的提取
从海水中制金属镁海水蒸发? Mg(OH)2粗盐海水提溴将Br-转变为Br2是海水提溴中关键的化学反应。海水提溴是从海水中提取元素溴的技术。溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,需求量很大。国外从1934年开始海水提溴试验和开发,目前日本、法国、阿根廷和加拿大等国家和地区已建有海水提溴工厂,年产量基本保持在36万吨的水平。中国从1966年开始海水提溴,至今仍处于小型试生产的规模。 从海水中提取溴
(阅读资料卡片,写出有关的化学方程式)
2 NaBr + Cl2 =2 NaCl + Br2
Br2 + SO2 + 2H2O = 2HBr + H2SO4
2HBr + Cl2 = 2HCl + Br2海水淡化厂兼电厂海水综合利用联合工业体系一例赤 潮 现 象厦 门 近 海赤 潮定义:
在一定的条件下,海域中的某些生物在短时间内大量繁殖或聚集的现象,常使海水变红色或褐色.
危害:
污染环境,对海洋养殖业构成极大的威胁.
合理利用海洋资源保护海洋,不进行近海石油开采。
建立可持续的海洋渔业。
保护海洋生态系统 。
把污水处理后再排入海洋,合理捕捞,严格防止石油外泄. 一位遇上海难的水手,随着木排在海上漂流.他用完了淡水,感到异常的口渴,但是他不喝海水,因为他知道海水会致命,原因( )A.海水有苦涩味,根本喝不下去.
B.海水中含有多种盐,能使肠胃溃烂导致人死亡.
C.海水中有多种微生物,有些微生物可以使人死亡.
D.海水会造成水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡.D
过程与方法目标:自主学习,培养学生自学能力;通过了解金属资源的开发及冶炼培养学生的归纳能力、比较能力。
情感、态度与价值观目标: 帮助学生树立节约资源、爱护环境、变废为宝等意识。 金属矿物的开发和利用含三价铁的红色石英自然界中存在着丰富的矿产资源纤磷锰铁矿蓝 铜 矿赤 铁 矿“金属的冶炼”的实质是什么? 冶炼金属的实质是用还原的方法
使金属化合物中的金属离子得到
电子变成金属原子。 将金属从其化合物中还原出来用于生产和制造各种金属材料的过程在工业上称为金属的冶炼。冶炼金属的方法根据金属的活动性顺序不同,采取不同的冶炼方法1、热分解法(适合一些不活泼金属)
2HgO = 2Hg + O2 ↑加热2Ag2O = 4Ag + O2 ↑加热2、电解法(适合一些非常活泼金属) MgCl2 (熔融) = Mg + Cl2 ↑电解2Al2O3 (熔融) = 4Al + 3O2 ↑电解冰晶石2NaCl (熔融) = 2Na + Cl2 ↑电解电解熔融的氯化钠3、热还原法(适合大部分金属)CuO+H2 = Cu + H2O高温Fe2O3 + 3CO = 2Fe + 3CO2 ↑高温一氧化碳还原氧化铁单质的还原性强弱电解法还原法加热法物理方法金属的冶炼实验4-1 铝热反应注意观察现象反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。1、镁条的作用是什么?
2、氯酸钾的作用是什么?铝热剂问题:与氧气反应放出大量的热,为铝热反应提供热量。受热分解产生氧气,使镁条继续燃烧提供热量。其它铝热反应 铝热反应的应用??????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????
??? 铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等合理开发和利用矿物资源,主要途径有:… … … … … 地球上的金属资源是有限的,必须合理开发和利用矿产资源,加强金属资源的回收和再利用。练习1、下列各种冶炼方法中,可以制得
相应金属的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
2、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na ②Zn
③Hg ④Au
C电解法加热还原法加热分解法物理提取法冶炼金属常用以下几种方法:
(1)以C或H2、CO作还原剂还原法;(2)热分解法(3)电解法(4)铝热法。现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼的方法。Al:______ Hg:______
Mg:______ Mn:______
Cu:______(3)(3)(1)(2)(4)开发利用金属矿物和海水资源第2课时a、海洋生物资源海洋资源b、海洋中的矿产资源含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多,被称为“元素的故乡”。海水中铀多达45亿吨
是已知陆地铀矿储量
的4500倍。氘有50亿
吨足够人类用上千万
年c、海水中的化学资源1、海水资源的广泛性:海洋约占地球表面积71%
海洋中的资源 :
动物:(鱼类、海狮、海马、贝类………
植物:(海草、海带…………
矿物:(各种盐、NaCl、MgCl2 ……….
海底金属结核矿、石油
水 : (水资源及各种溶解的盐类
2、海水资源的利用: 主要有:
1.海水中水资源的利用 海水的淡化(咸水 淡水)
2.直接利用海水进行循环冷却(作冷却用水)海水的淡化:(1)海水淡化的途径:
从海水中提取淡水
从海水中分离出盐
(2)海水淡化的方法:
蒸 馏 法(最先使用,技术成熟,但成本高)
电渗析法(成本低,但未能大量生产)
离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)蒸馏法所用的装置及原理原理:加热到水的沸点, 使水汽化变成水蒸气,再冷凝得淡水。
注意:图4-3海水蒸馏原理示意图进冷却水 出太阳能蒸发原理示意图用高分子分离膜淡化海水利用海水进行循环冷却天津碱厂海水循环冷却装置海水中溶解和悬浮有大量的无机物和有机物,按含量计,H、O、Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等元素超过总量的99%,其他为微量元素,总计含有80多种元素。3、海水的综合利用(1)海水制盐——生产NaCl
(2) NaCl的水溶液制NaOH
(3)制金属Na
(4)制Na2CO3
2 NaOH + CO2= Na2CO3 + H2O 煮
海为
盐海水晒盐海水浓缩过滤蒸发结晶食盐的提取
从海水中制金属镁海水蒸发? Mg(OH)2粗盐海水提溴将Br-转变为Br2是海水提溴中关键的化学反应。海水提溴是从海水中提取元素溴的技术。溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,需求量很大。国外从1934年开始海水提溴试验和开发,目前日本、法国、阿根廷和加拿大等国家和地区已建有海水提溴工厂,年产量基本保持在36万吨的水平。中国从1966年开始海水提溴,至今仍处于小型试生产的规模。 从海水中提取溴
(阅读资料卡片,写出有关的化学方程式)
2 NaBr + Cl2 =2 NaCl + Br2
Br2 + SO2 + 2H2O = 2HBr + H2SO4
2HBr + Cl2 = 2HCl + Br2海水淡化厂兼电厂海水综合利用联合工业体系一例赤 潮 现 象厦 门 近 海赤 潮定义:
在一定的条件下,海域中的某些生物在短时间内大量繁殖或聚集的现象,常使海水变红色或褐色.
危害:
污染环境,对海洋养殖业构成极大的威胁.
合理利用海洋资源保护海洋,不进行近海石油开采。
建立可持续的海洋渔业。
保护海洋生态系统 。
把污水处理后再排入海洋,合理捕捞,严格防止石油外泄. 一位遇上海难的水手,随着木排在海上漂流.他用完了淡水,感到异常的口渴,但是他不喝海水,因为他知道海水会致命,原因( )A.海水有苦涩味,根本喝不下去.
B.海水中含有多种盐,能使肠胃溃烂导致人死亡.
C.海水中有多种微生物,有些微生物可以使人死亡.
D.海水会造成水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡.D
