高中化学人教版选修3课件:第2章第2节分子的立体结构(63张)
文档属性
| 名称 | 高中化学人教版选修3课件:第2章第2节分子的立体结构(63张) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-05 00:00:00 | ||
图片预览



文档简介
课件63张PPT。第二章 分子结构与性质第二节 分子的立体结构
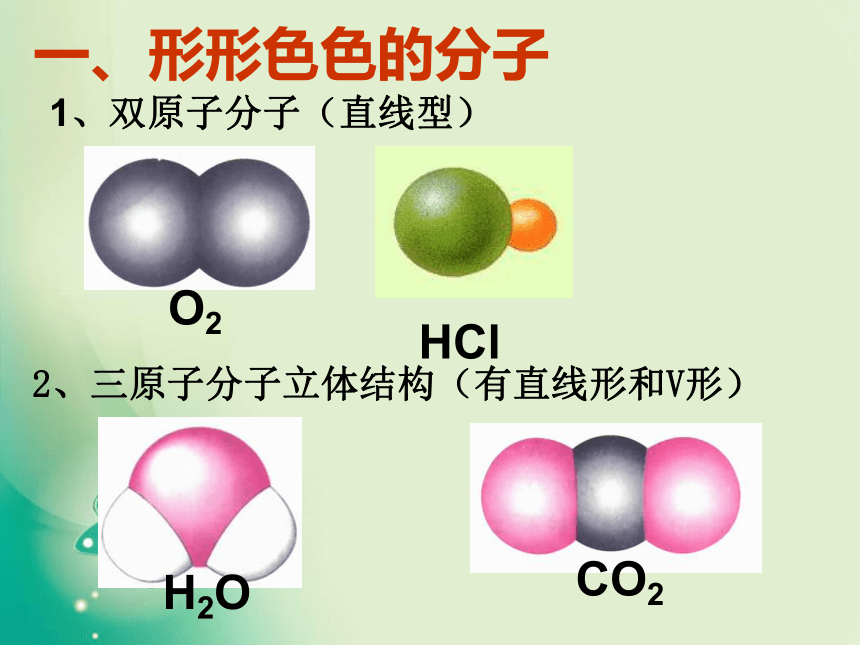
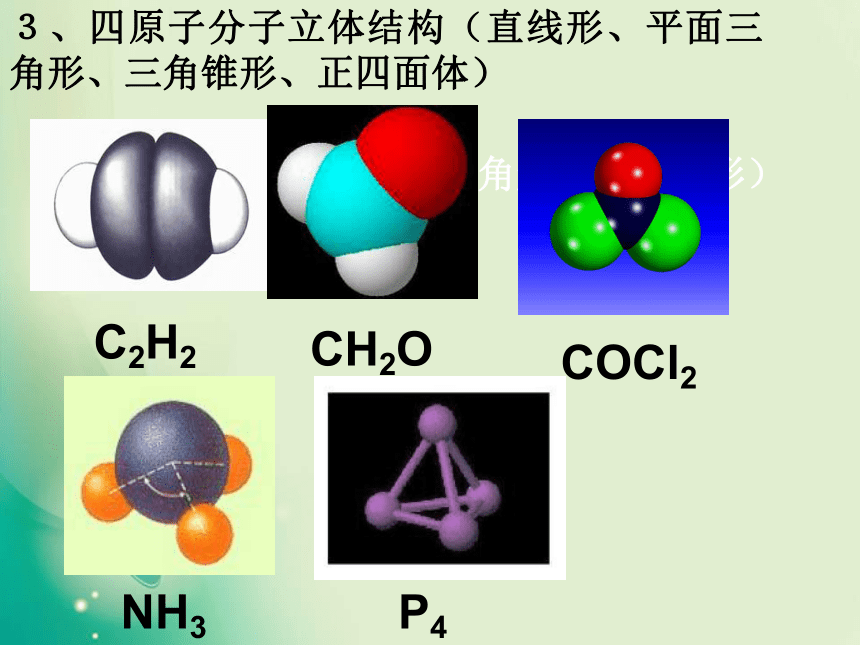
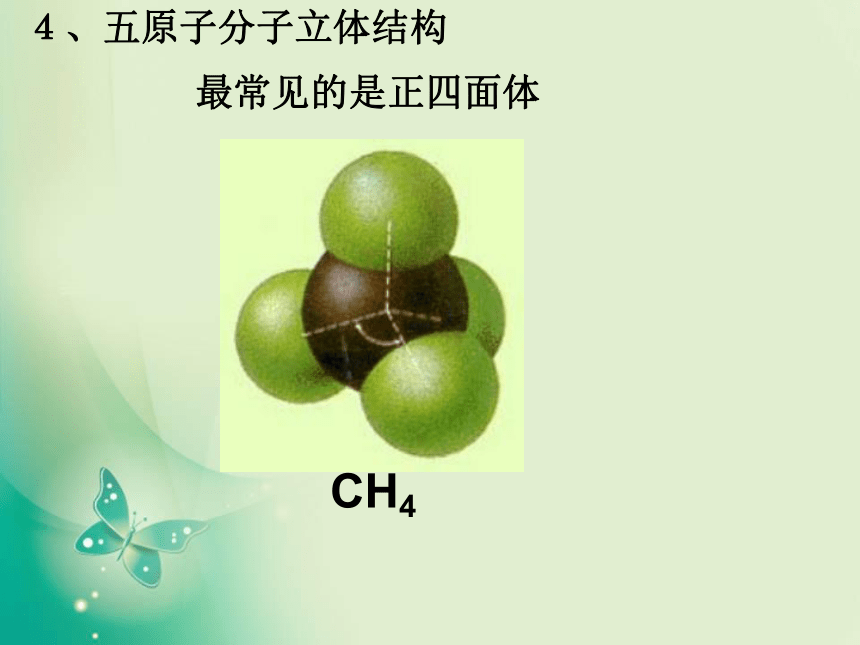
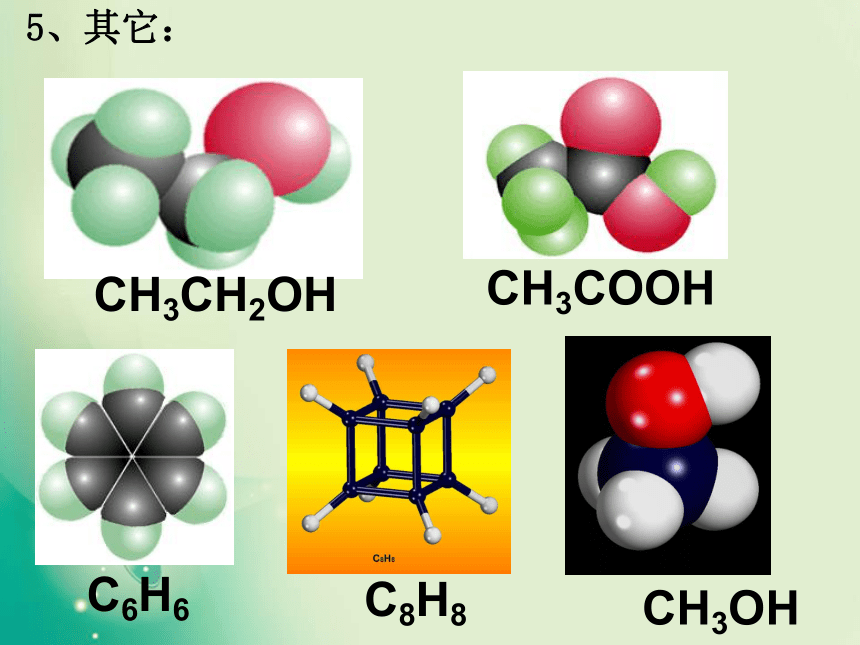
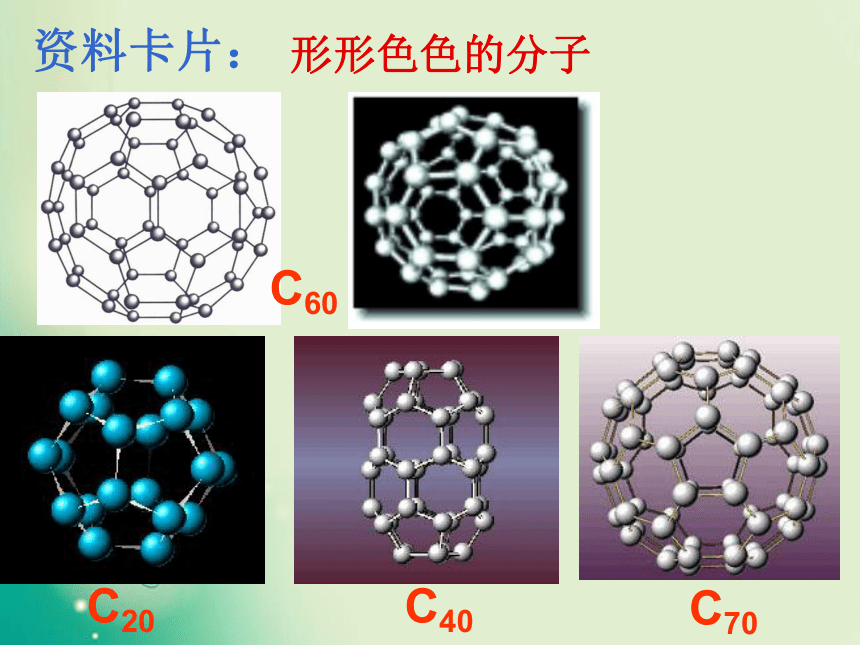
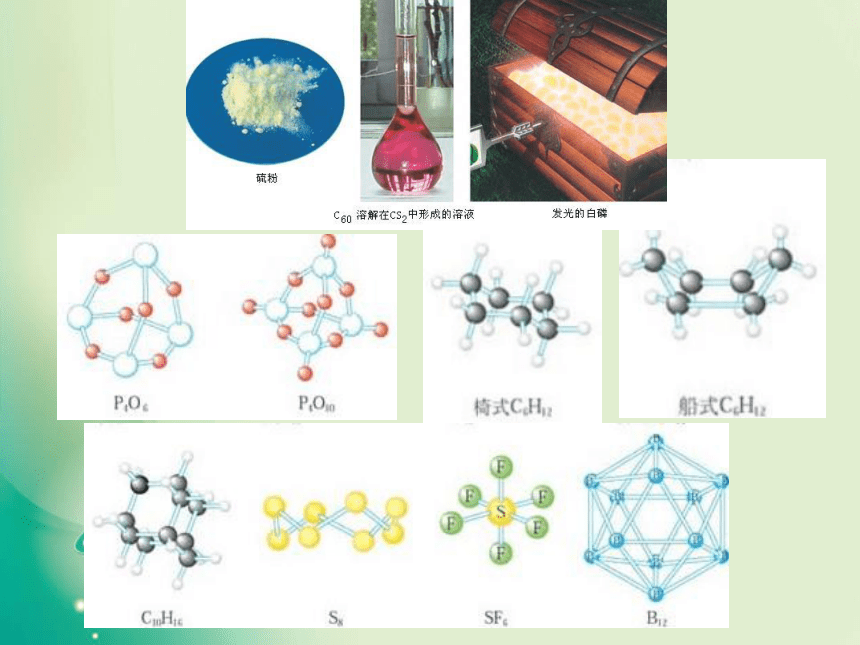
一、形形色色的分子O2HClH2OCO21、双原子分子(直线型)2、三原子分子立体结构(有直线形和V形)3、四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)(平面三角形,三角锥形)C2H2CH2OCOCl2NH3P44、五原子分子立体结构最常见的是正四面体CH4CH3CH2OHCH3COOHC6H6C8H8CH3OH5、其它:C60C20C40C70资料卡片:形形色色的分子分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
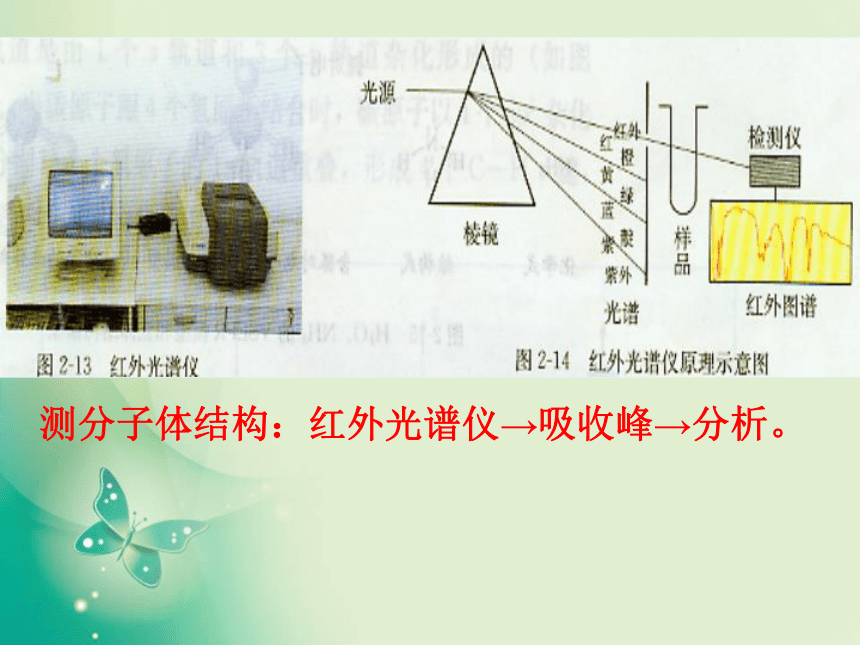
那么分子结构又是怎么测定的呢?测分子体结构:红外光谱仪→吸收峰→分析。
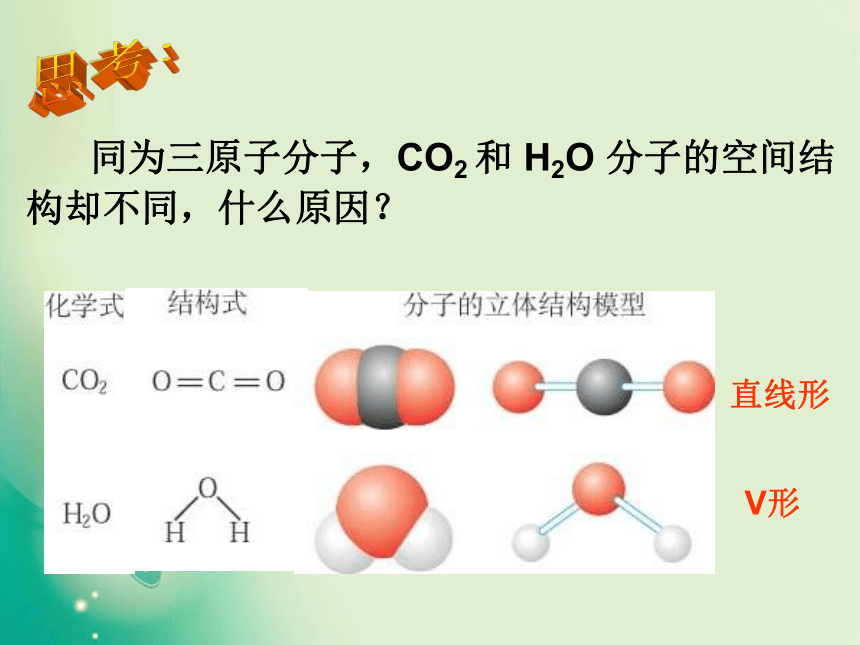
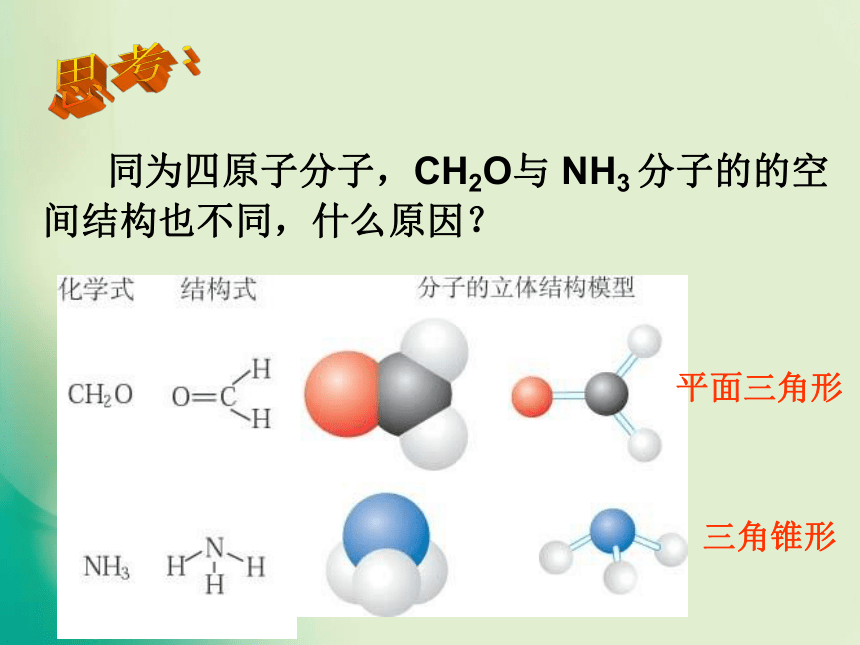
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考:直线形V形 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?思考:三角锥形平面三角形二.价层电子对互斥理论★价层电子对互斥模型(VSEPR模型)
是一种可以用来预测分子立体结构的模型,总的原则是分子的中心原子上孤对电子对与成键电子对之间的排斥力最小(注意:分子中的双键、叁键等多重键要作为一对电子看待)。 这种理论把中心原子上所有电子(成键电子未用于形成共价键的电子),都要占据中心原子周围的空间,并参与互相排斥。1.价层电子对数目的计算价层电子对数 = 1/2( a + xb ) a为中心原子的价电子数;x为与中
心原子结合的原子数;b为与中心原
子结合的原子最多能接受的电子数强调:(1)与中心原子连接的原子如果是氧或是硫则b为0
(2)阴阳离子的孤电子对计算价层电子对数目
=δ键电子对+孤电子对数SNC6
2
0
1
5-1=4
4
1
0
4+2=6
3
0
0
3
4
3
P53141CO2
SO2
SO3
NH3
BF3
SiCl4
CHCl3
H3O+
NH4+
SO42-
PO43-
价层电子对数目:2,3,4价层电子对数目:5,6价层电子对互斥模型(VSEPR模型)价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体02100直线形V 形三角
锥形 平面
三角形 正
四面体24434CO2
SO2
SO3
NH3
BF3
SiCl4
CHCl3
H3O+
NH4+
SO42-
PO43-
直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型思考:H2O和NH3的VSEPRS模型都是四面体形,为什么键角不是109°28'?价电子对之间的斥力(1)孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
(2)三键>双键>单键课堂练习:
1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是
形。
2 、下列分子或离子中,不含有孤对电子的是 ___
A、H2O、B、H3O+、C、NH3、D、NH4+
3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大的顺序为___
4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是____
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④ C、①②⑤ D、①④⑤
5、用价层电子对互斥模型判断SO3的分子构型 ___
A、正四面体形 B、V形 C、三角锥形 D、平面三角形
直线V平面三角三角锥③ ② ① ④DCD正四面体课堂练习6.下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2 B.H2S C.PCl3 D.SiCl4
7.下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D.P4BBC8.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确课堂练习C美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力:只要给他物质的分子式,他就能通过“毛估”法,大体上想象出这种物质的分子结构模型。请你根据价层电子对互斥理论,“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4 课堂练习三角双锥形三角锥形平面三角形正四面体思考:CH4四个C-H键的键长相同,键角为109°28',可C原子价层原子轨道是3个垂直的2p轨道和一个球形2s轨道,为什么得到正四面体构型?杂化轨道基本要点:在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道。这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道。
杂化前后轨道数目不变。
杂化后轨道伸展方向,形状发生改变。杂化轨道CH4的空间构型为正四面体C:2s22p2sp3杂化 乙烯中的C在轨道杂化时,有一个P轨道未参与杂化,只是C的2s与两个2p轨道发生杂化,形成三个相同的sp2杂化轨道,三个sp2杂化轨道分别指向平面三角形的三个顶点。未杂化p轨道垂直于sp2杂化轨道所在平面。杂化轨道间夹角为120°。C的sp2杂化sp2杂化轨道 ?键的形成 两个碳原子在形成双键时,两个sp2杂化轨道形成一个(sp2 -sp2 )?键。其余sp2杂化轨道则与H原子成键。
每个碳原子上各剩有一个垂直于sp2杂化轨道所在平面的未成键的p轨道,这两个p轨道从侧面重叠(好象两人“肩并肩”),这样就形成一种新的化学键,我们称之为?键。sp2杂化形成σ键 p轨道相互平行重叠形成π键 1)sp杂化 乙炔中的碳原子为SP杂化,分子呈直线构型。两个碳原子的sp杂化轨道沿各自对称轴形成C—C ? 键,另两个sp杂化轨道分别与两个氢原子的1s轨道重叠形成两个C—H ?键,两个py轨道和两个pz轨道分别从侧面相互重叠,形成两个相互垂直的C—C?键,形成乙炔分子。 2)空间结构是直线型:
三个σ键在一条直线上。 sp杂化轨道 对于ABn型分子或离子,其中心原子A
的杂化轨道数恰好与A的价层电子对数相等。另外:对于复杂的Abn型分子或离子,其中心原子A的价层电子对数可依公式★注意:杂化轨道只用于形成σ键或者用来容纳孤对电子杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数所谓“芳香性”,是指苯具有的特殊稳定性(如难发生氧化反应),易发生取代反应,而难发生加成反应的性质。苯分子结构的现代解释苯分子中6个碳原子的P轨道相互重叠形成了一个“大? 键”,从而形成了苯的环状闭合共轭体系,这是苯具有“芳香性”性质的根本原因。指出下列物质中的化学键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键、离子键极性键、离子键HCHO CH3 CH3
极性分子与非极性分子
分子极性成因探究+ -+ -±极性分子:正电中心和负电中心不重合,使分子
的某一部分呈正电性,另一部份呈负电性。非极性分子:正电中心和负电中心重合,不出现
分子的某 一部分带正电,另一部分带负电的分子。
分子极性的判断
【理论探究】正负电中心确定δ+δ+δ- δ-H2O+ -若CH4 分子中一个H原子被Cl原子取代呢?CH4δ+δ+δ-δ-CO2±
分子极性的判断
【理论探究】根据分子式判断直 线形 正三角形正四面体V形 直线形 四面体三角锥形多原子分子的极性:非极性非极性非极性极性极性极性极性?
H2、N2、O2、P4、C60非极性分子重合非极性键同核原子分子异核双原子分子异核多原子分子极性键分子中各键向量和为零分子中各键向量和不为零重合不重合不重合非极性分子极性分子极性分子CO、HClCO2、CH4HCN、H2O、NH3、CH3Cl分子极性的判断
⑴ 只含有非极性键的单质分子是非极性分子。
⑵ 含有极性键的双原子化合物分子都是极性分子。
⑶ 含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的为极性分子。 极性分子和非极性分子的其他规律判断:1.中心原子有无孤对电子
有---极性分子 (NH3 ) 无 ---非极性分子(BF3)
2.极性键极性的向量和是否为0
为0 ---非极性分子(CO2) 不为0 ---极性分子(H2O)3.中心原子化合价的绝对值是否等于价电子数
等于--- 非极性分子(SO3) 不等于---极性分子(SO2)
2.CO2、CH4、BF3都是非极性分子,H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律正确的是 ( )
A.所有原子在同一平面内
B.分子中不含有氢原子
C.在ABn分子中A原子没有孤对电子
D.A的相对原子质量小于B 1.把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是 ( )
A.CCl4 B.C2H50H C.CS2 D.CH2Cl2 3.现已知03分子为V字形结构,据理推断O3应为 (极性或非极性)分子,03在水中的溶解度比O2要 (大或小)得多,其主要原因是 . -----由同种元素组成的非金属单质分子不一定是非极性分子4.判断XY2型分子是极性分子的主要依据是 ( )
A. 分子中存在极性键
B. 分子中存在离子键
C. 直线型结构,两个X--Y键的夹角为1800
D. 非直线型结构,两个X--Y键的夹角小于1800
5.能说明BF3分子中的四个原子在同一平面内的理由是
A. 任意两个B--F键之间的夹角为1200 ( )
B.B--F键是非极性键
C.B原子与每个F原子的相互作用相同
D.B原子与每个F原子的距离相等
6.带静电的有机玻璃棒靠近下列液体的细流,细流会发
生偏转的是 ( )
A.苯 B.二硫化碳 C. 溴水 D.四氯化碳 7.下列叙述正确的是 ( )
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C. 在CaO和SiO2晶体中,都不存在单个小分子
H
I
D.甲烷的结构式:H--C--H是对称的平面结构, I 所以是非极性分子
H 8.有A、B 、C 3种物质,每个分子中都有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子。
则A的电子式是 ;
B的结构式是 ;
C的名称是 .
离子键 离子化合物
不同种元素原子 不对称
类型
极性键 极性分子
共价键 非极性键 共价化合物
(配位键) (单质) 非极性分子
金属键 同种原子
对称
键能 决定
键参数 键长 分子稳定性
决定
键角 分子空间构型
表示方法:电子式、结构式 化 学 键应用反馈:0120100022233444直线形 V 形V形平面三角形三角锥形四面体正四面体正四面体04正四面体02100直线形V 形三角
锥形 平面
三角形 正
四面体24434
一、形形色色的分子O2HClH2OCO21、双原子分子(直线型)2、三原子分子立体结构(有直线形和V形)3、四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)(平面三角形,三角锥形)C2H2CH2OCOCl2NH3P44、五原子分子立体结构最常见的是正四面体CH4CH3CH2OHCH3COOHC6H6C8H8CH3OH5、其它:C60C20C40C70资料卡片:形形色色的分子分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
那么分子结构又是怎么测定的呢?测分子体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考:直线形V形 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?思考:三角锥形平面三角形二.价层电子对互斥理论★价层电子对互斥模型(VSEPR模型)
是一种可以用来预测分子立体结构的模型,总的原则是分子的中心原子上孤对电子对与成键电子对之间的排斥力最小(注意:分子中的双键、叁键等多重键要作为一对电子看待)。 这种理论把中心原子上所有电子(成键电子未用于形成共价键的电子),都要占据中心原子周围的空间,并参与互相排斥。1.价层电子对数目的计算价层电子对数 = 1/2( a + xb ) a为中心原子的价电子数;x为与中
心原子结合的原子数;b为与中心原
子结合的原子最多能接受的电子数强调:(1)与中心原子连接的原子如果是氧或是硫则b为0
(2)阴阳离子的孤电子对计算价层电子对数目
=δ键电子对+孤电子对数SNC6
2
0
1
5-1=4
4
1
0
4+2=6
3
0
0
3
4
3
P53141CO2
SO2
SO3
NH3
BF3
SiCl4
CHCl3
H3O+
NH4+
SO42-
PO43-
价层电子对数目:2,3,4价层电子对数目:5,6价层电子对互斥模型(VSEPR模型)价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体02100直线形V 形三角
锥形 平面
三角形 正
四面体24434CO2
SO2
SO3
NH3
BF3
SiCl4
CHCl3
H3O+
NH4+
SO42-
PO43-
直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型思考:H2O和NH3的VSEPRS模型都是四面体形,为什么键角不是109°28'?价电子对之间的斥力(1)孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
(2)三键>双键>单键课堂练习:
1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是
形。
2 、下列分子或离子中,不含有孤对电子的是 ___
A、H2O、B、H3O+、C、NH3、D、NH4+
3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大的顺序为___
4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是____
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④ C、①②⑤ D、①④⑤
5、用价层电子对互斥模型判断SO3的分子构型 ___
A、正四面体形 B、V形 C、三角锥形 D、平面三角形
直线V平面三角三角锥③ ② ① ④DCD正四面体课堂练习6.下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2 B.H2S C.PCl3 D.SiCl4
7.下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D.P4BBC8.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确课堂练习C美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力:只要给他物质的分子式,他就能通过“毛估”法,大体上想象出这种物质的分子结构模型。请你根据价层电子对互斥理论,“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4 课堂练习三角双锥形三角锥形平面三角形正四面体思考:CH4四个C-H键的键长相同,键角为109°28',可C原子价层原子轨道是3个垂直的2p轨道和一个球形2s轨道,为什么得到正四面体构型?杂化轨道基本要点:在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道。这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道。
杂化前后轨道数目不变。
杂化后轨道伸展方向,形状发生改变。杂化轨道CH4的空间构型为正四面体C:2s22p2sp3杂化 乙烯中的C在轨道杂化时,有一个P轨道未参与杂化,只是C的2s与两个2p轨道发生杂化,形成三个相同的sp2杂化轨道,三个sp2杂化轨道分别指向平面三角形的三个顶点。未杂化p轨道垂直于sp2杂化轨道所在平面。杂化轨道间夹角为120°。C的sp2杂化sp2杂化轨道 ?键的形成 两个碳原子在形成双键时,两个sp2杂化轨道形成一个(sp2 -sp2 )?键。其余sp2杂化轨道则与H原子成键。
每个碳原子上各剩有一个垂直于sp2杂化轨道所在平面的未成键的p轨道,这两个p轨道从侧面重叠(好象两人“肩并肩”),这样就形成一种新的化学键,我们称之为?键。sp2杂化形成σ键 p轨道相互平行重叠形成π键 1)sp杂化 乙炔中的碳原子为SP杂化,分子呈直线构型。两个碳原子的sp杂化轨道沿各自对称轴形成C—C ? 键,另两个sp杂化轨道分别与两个氢原子的1s轨道重叠形成两个C—H ?键,两个py轨道和两个pz轨道分别从侧面相互重叠,形成两个相互垂直的C—C?键,形成乙炔分子。 2)空间结构是直线型:
三个σ键在一条直线上。 sp杂化轨道 对于ABn型分子或离子,其中心原子A
的杂化轨道数恰好与A的价层电子对数相等。另外:对于复杂的Abn型分子或离子,其中心原子A的价层电子对数可依公式★注意:杂化轨道只用于形成σ键或者用来容纳孤对电子杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数所谓“芳香性”,是指苯具有的特殊稳定性(如难发生氧化反应),易发生取代反应,而难发生加成反应的性质。苯分子结构的现代解释苯分子中6个碳原子的P轨道相互重叠形成了一个“大? 键”,从而形成了苯的环状闭合共轭体系,这是苯具有“芳香性”性质的根本原因。指出下列物质中的化学键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键、离子键极性键、离子键HCHO CH3 CH3
极性分子与非极性分子
分子极性成因探究+ -+ -±极性分子:正电中心和负电中心不重合,使分子
的某一部分呈正电性,另一部份呈负电性。非极性分子:正电中心和负电中心重合,不出现
分子的某 一部分带正电,另一部分带负电的分子。
分子极性的判断
【理论探究】正负电中心确定δ+δ+δ- δ-H2O+ -若CH4 分子中一个H原子被Cl原子取代呢?CH4δ+δ+δ-δ-CO2±
分子极性的判断
【理论探究】根据分子式判断直 线形 正三角形正四面体V形 直线形 四面体三角锥形多原子分子的极性:非极性非极性非极性极性极性极性极性?
H2、N2、O2、P4、C60非极性分子重合非极性键同核原子分子异核双原子分子异核多原子分子极性键分子中各键向量和为零分子中各键向量和不为零重合不重合不重合非极性分子极性分子极性分子CO、HClCO2、CH4HCN、H2O、NH3、CH3Cl分子极性的判断
⑴ 只含有非极性键的单质分子是非极性分子。
⑵ 含有极性键的双原子化合物分子都是极性分子。
⑶ 含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的为极性分子。 极性分子和非极性分子的其他规律判断:1.中心原子有无孤对电子
有---极性分子 (NH3 ) 无 ---非极性分子(BF3)
2.极性键极性的向量和是否为0
为0 ---非极性分子(CO2) 不为0 ---极性分子(H2O)3.中心原子化合价的绝对值是否等于价电子数
等于--- 非极性分子(SO3) 不等于---极性分子(SO2)
2.CO2、CH4、BF3都是非极性分子,H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律正确的是 ( )
A.所有原子在同一平面内
B.分子中不含有氢原子
C.在ABn分子中A原子没有孤对电子
D.A的相对原子质量小于B 1.把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是 ( )
A.CCl4 B.C2H50H C.CS2 D.CH2Cl2 3.现已知03分子为V字形结构,据理推断O3应为 (极性或非极性)分子,03在水中的溶解度比O2要 (大或小)得多,其主要原因是 . -----由同种元素组成的非金属单质分子不一定是非极性分子4.判断XY2型分子是极性分子的主要依据是 ( )
A. 分子中存在极性键
B. 分子中存在离子键
C. 直线型结构,两个X--Y键的夹角为1800
D. 非直线型结构,两个X--Y键的夹角小于1800
5.能说明BF3分子中的四个原子在同一平面内的理由是
A. 任意两个B--F键之间的夹角为1200 ( )
B.B--F键是非极性键
C.B原子与每个F原子的相互作用相同
D.B原子与每个F原子的距离相等
6.带静电的有机玻璃棒靠近下列液体的细流,细流会发
生偏转的是 ( )
A.苯 B.二硫化碳 C. 溴水 D.四氯化碳 7.下列叙述正确的是 ( )
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C. 在CaO和SiO2晶体中,都不存在单个小分子
H
I
D.甲烷的结构式:H--C--H是对称的平面结构, I 所以是非极性分子
H 8.有A、B 、C 3种物质,每个分子中都有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子。
则A的电子式是 ;
B的结构式是 ;
C的名称是 .
离子键 离子化合物
不同种元素原子 不对称
类型
极性键 极性分子
共价键 非极性键 共价化合物
(配位键) (单质) 非极性分子
金属键 同种原子
对称
键能 决定
键参数 键长 分子稳定性
决定
键角 分子空间构型
表示方法:电子式、结构式 化 学 键应用反馈:0120100022233444直线形 V 形V形平面三角形三角锥形四面体正四面体正四面体04正四面体02100直线形V 形三角
锥形 平面
三角形 正
四面体24434
