苏教版高中化学必修二:2.2化学反应中的热量(共35张PPT)
文档属性
| 名称 | 苏教版高中化学必修二:2.2化学反应中的热量(共35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 818.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-06 17:09:22 | ||
图片预览










文档简介
课件35张PPT。太阳能 机械能
风能
地热能
电能
潮汐能
光能
…………思考:请同学们列举在生活中应用到的各种能量知识点滴:能源、材料和信息是现代社会发展的三大支柱。 化学反应中的热量一、学习目标:
1.了解吸热反应和放热反应,认识化学键的断裂和形成是化学反应中能量变化的主要原因;
2.了解化学反应中热量变化的实质;石油气的燃烧燃料燃烧推动火箭镁条燃烧闪电时产生氮氧化物化学反应过程中常常伴随能量的变化化学能转化成热能化学能转化成光能和热能化学能转化成动能和热能电能转化成化学能化学反应在生成新物质的同时,必然伴随着能量的变化,而能量的变化通常表现为热量的变化,即表现为热量的放出或吸收。化学反应的基本特征:都有新物质生成,必然伴随有能量(热能、光能、电能)的变化,及发光、变色、放出气体,生成沉淀等现象的发生。
化学反应应用:制取物质;利用反应中的能量
自然界中基本规律: (1)质量守恒;(2)能量守恒
(3)能量最低原理:能量越低越稳定。新视野有气泡生成,温度计温度迅速上升、铝与盐酸反应
有热量放出温度降低氢氧化钡固体与
氯化铵固体反应
需要吸收热量活动探究P35化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。一.化学反应中的热量变化1..放热反应和吸热反应2.反应热
定义:在化学反应过程中放出或吸收的热量通常叫做反应热。又叫“晗变”
符号:△H 单位:KJ·mol-1
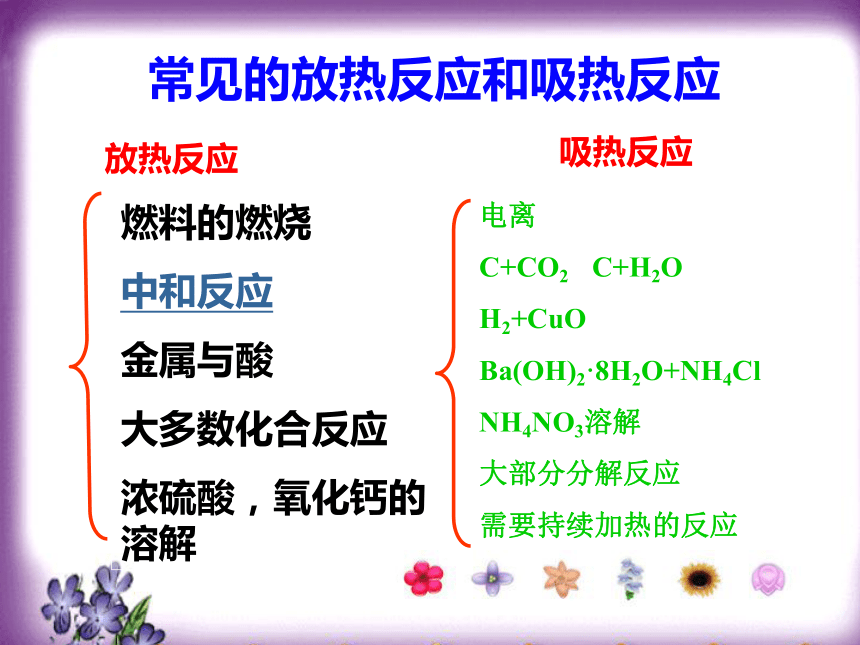
度量方式: 吸收热量: △H>0 ;放出热量: △H<0 常见的放热反应和吸热反应
放热反应燃料的燃烧
中和反应
金属与酸
大多数化合反应
浓硫酸,氧化钙的溶解吸热反应电离
C+CO2 C+H2O
H2+CuO
Ba(OH)2·8H2O+NH4Cl
NH4NO3溶解
大部分分解反应
需要持续加热的反应中和热概念:酸碱中和生成1mol水时,放出的热量叫中和热。1、判断下列是放热反应还是吸热反应:
A).镁条燃烧 放热反应 B).高温煅烧石灰石 吸热反应
C).氧化钙与水反应 放热反应 D).盐酸和氢氧化钠反应 放热反应
E).灼热的炭与二氧化碳反应 吸热反应
F).炭不完全燃烧生成一氧化碳 放热反应
G).高锰酸钾分解制氧气 吸热反应 H).氢气还原氧化铜 吸热反应
I).氢氧化钡晶体的粉末和氯化铵晶体混合 吸热反应
J).铝粉与氧化铁粉末反应 放热反应问题解决:思考与讨论一个反应整体的吸热或放热是由什么决定的?
化学反应中有热量变化的原因是什么?
吸热反应只有吸热的过程,或者说放热反应只有放热的过程吗? 2.是否吸热反应一定要加热,而放热反应一定不要加热,要加热的反应都是吸热反应?不一定,要持续加热的反应是吸热反应化学反应热量——第二课时释放能量
放热反应吸收能量
吸热反应贮 能释 能化学反应中的能量变化示意图2. 物质发生化学变化的实质:
物质发生化学变化的过程,实质上就是旧的化学键断裂和新的化学键形成过程。
断开化学键:吸收能量
形成化学键:放出能量 一.化学反应中的热量变化 生成或拆开1mol化学键所放出或消耗的能量 叫化学键的键能.对于一个物质:其键能越大,物质所含能量越低,物质越稳定;
其键能越小,物质所含能量越高,物质越不稳定。H2 + Cl2 == 2HCl++阅读教材P36资料卡,什么是键能△H=436.4KJ·mol-1-+242.7KJ·mol-1- 2*431.8KJ·mol-1吸收热量放出热量反应物的总能量与生成物的总能量的相对大小。反应物与生成物总能量比较图判断练习已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A X的能量一定高于M
B Y的能量一定高于N
C X和Y的总能量一定高于M和N的总能量
D 因该反应为放热反应,故不必加热就
可发生C用键能粗略计算反应热△H=生成物的总能量-反应物的总能量=反应物的键能总和-生成物的键能总和结论1、化学反应中能量变化的本质是:
旧键断裂吸收能量,新键形成释放能量。2、反应最终表现为放热还是吸热:
是反应物的总能量与生成物的总能量相比较的结果。与反应条件无关 H2(g) + Cl2(g)==2HCl(g) △H = - 184.6kJ/mol第三课时 热化学方程式 1).定义:表明反应放出或吸收的热量的化学方程式观察以下热化学反应方程式,你发现了什么?2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/mol
2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol结论:同种物质聚集状态不同,能量不同2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol
H2(g) +1/2O2(g)== H2O(l) △H=-285.8 kJ/mol结论:△H 的值与化学计量数成正比化学计量数只表示物质的量,可用分数结论:标明物质聚集状态,气(g)、液(l)、固(s)化学反应方程式: 2H2 + O2=点燃=2H2O热化学方程式结论:当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反热化学方程式书写步骤写方程式
标状态
配平
△H “+” “-”
系数与反应热对应
单位kJ/mol 热化学反应既能表示反应物质的变化,也能表示反应过程中能量的变化。书写热化学方程式注意事项:
(1)反应物和 生成物要标明其聚集状态,用g、l、s、aq分别代表气态、液态、固态、溶液。
(2)用△H标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
△H为“-”,表示放热; △H为“+”,表示吸热.
(3)反应温度、压强不同其△H 也不同,中学阶段指的是298K(25℃),101KPa
(4)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
(5)对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
(6)逆反应与正反应,反应热在数值上相等,符号相反。下列热化学方程式书写正确的是( )A.2SO2 + O2 == 2SO3 ;△H=- 196.6 kJ/mol
B.H2(g)+O2(g)== H2O (g);△H=- 241.8 kJ
C.2H2(g)+O2(g) == 2H2O(l);△H=- 571.6 kJ/mol
D.C(s) + O2(g) == CO2(g);△H= + 393.5 kJ/mol C课堂练习 [ 例1 ] 250C ,1.01×105Pa下,1g 硫粉在氧气中充分
燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。 1). 根据反应热书写热化学方程式1g 硫粉在氧气中充分燃烧放出 9. 36kJ 热量32g ×9.36kJ /g = 299.52 kJ 1 mol 硫粉在氧气中充分燃烧放出热量为:S ( 固) + O2 (气) = SO2 ( 气 ) ; △H =-299.52 kJ ?mol- S + O2 = SO2 6.有关热化学方程式的计算一.化学反应中的热量变化 [ 练习1 ] 25℃,1.01×105Pa下,4g CO在氧气中燃
烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学
方程式。 [ 例2 ] 在一定条件下,氢气和甲烷燃烧的化学方程
式为:2H2( g ) + O2 ( g ) = 2H2O ( l ) ;△H =- 572 kJ ?mol-
CH4( g ) +2O2 (g ) = CO2 (g ) +2H2O ( l ) ;△H =- 890 kJ ?mol-
由1mol 氢气和3mol甲烷组成的混合气体在上述条件
下完全燃烧时放出的热量为多少。2. )根据热化学方程式求反应热解:Q = (572kJ ÷ 2) + (890 kJ×3) =2956 kJ [ 练习2 ] 已知:
2H2O(l) = 2H2 (g) + O2 (g) ;△H =+517.6 kJ ?mol-1
CH4(g) +2O2 (g) = CO2 (g) +2H2O (l) ; △H =- 890.3 kJ ?mol-1
则:1g 氢气和1g甲烷分别燃烧后,放出热量之比约
为 (A) 1 :34 (B) 1 :1.7 (C) 2.3 :1 (D) 4.6 :1517.6/4 分析:890.3/16=517.6 890.3/4选 C [ 例3 ] 在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l) ;△H =- 571.6 kJ ?mol-1
C3H8(g) +5O2 (g) = 3CO2 (g) +4H2O (l) ;△H =- 2220 kJ ?mol-1
5mol 氢气和丙烷的混合气完全燃烧时放热3847kJ,则
氢气和甲烷的体积比为 (A) 1:3 (B) 3:1 (C) 1:4 (D) 1:13.) 求混合物的组成16.6%2.1%5.1%76.2%我国化石燃料和水电能源消耗构成图三大化石燃料全球化石燃料可开采期预测表№不可再生能源① 现今用的燃料是什么?主要是什么?
② 燃料充分燃烧的条件有哪些?
③ 燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④ 导致酸雨的主要原因之一是什么?
⑤ 怎样高效、清洁地利用煤炭?
⑥ 怎样提高固体和液体燃料的燃烧效率?二、燃料的充分燃烧
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面煤中所含硫在燃烧时会生成SO2要有适当过量的空气
燃料与空气要有足够大的接触面积
高效清洁利用煤炭的重要途径将焦炭在高温下与水蒸气反应,则得到CO和H2开发新能源——开源练习:简要说明使煤炉中的煤充分燃烧所应采取的措施。打开炉门在煤饼上打孔或将煤做成煤块
煤粉
燃烧时要有足够多的空气燃料与空气要有足够大的接触面 练习:如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是_________.
(2)产生上述现象的原因是_________.
(3)写出有关反应的离子方程式.
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于、“小于”、“等于”)镁片和盐酸的总能量.练习:下列说法正确的是( )
A.需加热才能发生的反应一定是吸热反应
B.放热的反应在常温下就一定能进行
C.反应是放热还是吸热是由反应物和生成物所具有的总能量的相对大小决定的
D.吸热反应在一定条件下也能进行 C、D
风能
地热能
电能
潮汐能
光能
…………思考:请同学们列举在生活中应用到的各种能量知识点滴:能源、材料和信息是现代社会发展的三大支柱。 化学反应中的热量一、学习目标:
1.了解吸热反应和放热反应,认识化学键的断裂和形成是化学反应中能量变化的主要原因;
2.了解化学反应中热量变化的实质;石油气的燃烧燃料燃烧推动火箭镁条燃烧闪电时产生氮氧化物化学反应过程中常常伴随能量的变化化学能转化成热能化学能转化成光能和热能化学能转化成动能和热能电能转化成化学能化学反应在生成新物质的同时,必然伴随着能量的变化,而能量的变化通常表现为热量的变化,即表现为热量的放出或吸收。化学反应的基本特征:都有新物质生成,必然伴随有能量(热能、光能、电能)的变化,及发光、变色、放出气体,生成沉淀等现象的发生。
化学反应应用:制取物质;利用反应中的能量
自然界中基本规律: (1)质量守恒;(2)能量守恒
(3)能量最低原理:能量越低越稳定。新视野有气泡生成,温度计温度迅速上升、铝与盐酸反应
有热量放出温度降低氢氧化钡固体与
氯化铵固体反应
需要吸收热量活动探究P35化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。一.化学反应中的热量变化1..放热反应和吸热反应2.反应热
定义:在化学反应过程中放出或吸收的热量通常叫做反应热。又叫“晗变”
符号:△H 单位:KJ·mol-1
度量方式: 吸收热量: △H>0 ;放出热量: △H<0 常见的放热反应和吸热反应
放热反应燃料的燃烧
中和反应
金属与酸
大多数化合反应
浓硫酸,氧化钙的溶解吸热反应电离
C+CO2 C+H2O
H2+CuO
Ba(OH)2·8H2O+NH4Cl
NH4NO3溶解
大部分分解反应
需要持续加热的反应中和热概念:酸碱中和生成1mol水时,放出的热量叫中和热。1、判断下列是放热反应还是吸热反应:
A).镁条燃烧 放热反应 B).高温煅烧石灰石 吸热反应
C).氧化钙与水反应 放热反应 D).盐酸和氢氧化钠反应 放热反应
E).灼热的炭与二氧化碳反应 吸热反应
F).炭不完全燃烧生成一氧化碳 放热反应
G).高锰酸钾分解制氧气 吸热反应 H).氢气还原氧化铜 吸热反应
I).氢氧化钡晶体的粉末和氯化铵晶体混合 吸热反应
J).铝粉与氧化铁粉末反应 放热反应问题解决:思考与讨论一个反应整体的吸热或放热是由什么决定的?
化学反应中有热量变化的原因是什么?
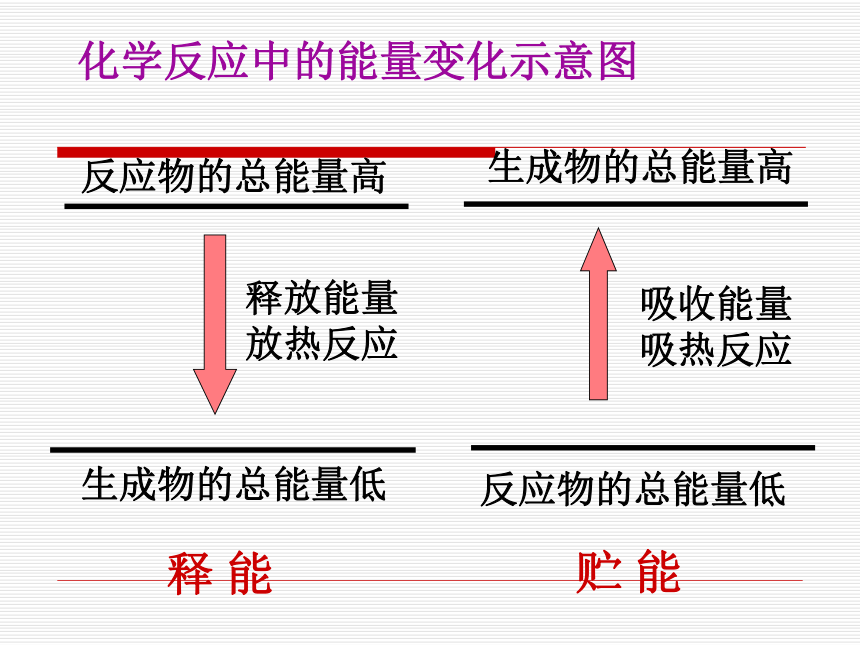
吸热反应只有吸热的过程,或者说放热反应只有放热的过程吗? 2.是否吸热反应一定要加热,而放热反应一定不要加热,要加热的反应都是吸热反应?不一定,要持续加热的反应是吸热反应化学反应热量——第二课时释放能量
放热反应吸收能量
吸热反应贮 能释 能化学反应中的能量变化示意图2. 物质发生化学变化的实质:
物质发生化学变化的过程,实质上就是旧的化学键断裂和新的化学键形成过程。
断开化学键:吸收能量
形成化学键:放出能量 一.化学反应中的热量变化 生成或拆开1mol化学键所放出或消耗的能量 叫化学键的键能.对于一个物质:其键能越大,物质所含能量越低,物质越稳定;
其键能越小,物质所含能量越高,物质越不稳定。H2 + Cl2 == 2HCl++阅读教材P36资料卡,什么是键能△H=436.4KJ·mol-1-+242.7KJ·mol-1- 2*431.8KJ·mol-1吸收热量放出热量反应物的总能量与生成物的总能量的相对大小。反应物与生成物总能量比较图判断练习已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A X的能量一定高于M
B Y的能量一定高于N
C X和Y的总能量一定高于M和N的总能量
D 因该反应为放热反应,故不必加热就
可发生C用键能粗略计算反应热△H=生成物的总能量-反应物的总能量=反应物的键能总和-生成物的键能总和结论1、化学反应中能量变化的本质是:
旧键断裂吸收能量,新键形成释放能量。2、反应最终表现为放热还是吸热:
是反应物的总能量与生成物的总能量相比较的结果。与反应条件无关 H2(g) + Cl2(g)==2HCl(g) △H = - 184.6kJ/mol第三课时 热化学方程式 1).定义:表明反应放出或吸收的热量的化学方程式观察以下热化学反应方程式,你发现了什么?2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/mol
2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol结论:同种物质聚集状态不同,能量不同2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol
H2(g) +1/2O2(g)== H2O(l) △H=-285.8 kJ/mol结论:△H 的值与化学计量数成正比化学计量数只表示物质的量,可用分数结论:标明物质聚集状态,气(g)、液(l)、固(s)化学反应方程式: 2H2 + O2=点燃=2H2O热化学方程式结论:当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反热化学方程式书写步骤写方程式
标状态
配平
△H “+” “-”
系数与反应热对应
单位kJ/mol 热化学反应既能表示反应物质的变化,也能表示反应过程中能量的变化。书写热化学方程式注意事项:
(1)反应物和 生成物要标明其聚集状态,用g、l、s、aq分别代表气态、液态、固态、溶液。
(2)用△H标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
△H为“-”,表示放热; △H为“+”,表示吸热.
(3)反应温度、压强不同其△H 也不同,中学阶段指的是298K(25℃),101KPa
(4)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
(5)对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
(6)逆反应与正反应,反应热在数值上相等,符号相反。下列热化学方程式书写正确的是( )A.2SO2 + O2 == 2SO3 ;△H=- 196.6 kJ/mol
B.H2(g)+O2(g)== H2O (g);△H=- 241.8 kJ
C.2H2(g)+O2(g) == 2H2O(l);△H=- 571.6 kJ/mol
D.C(s) + O2(g) == CO2(g);△H= + 393.5 kJ/mol C课堂练习 [ 例1 ] 250C ,1.01×105Pa下,1g 硫粉在氧气中充分
燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。 1). 根据反应热书写热化学方程式1g 硫粉在氧气中充分燃烧放出 9. 36kJ 热量32g ×9.36kJ /g = 299.52 kJ 1 mol 硫粉在氧气中充分燃烧放出热量为:S ( 固) + O2 (气) = SO2 ( 气 ) ; △H =-299.52 kJ ?mol- S + O2 = SO2 6.有关热化学方程式的计算一.化学反应中的热量变化 [ 练习1 ] 25℃,1.01×105Pa下,4g CO在氧气中燃
烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学
方程式。 [ 例2 ] 在一定条件下,氢气和甲烷燃烧的化学方程
式为:2H2( g ) + O2 ( g ) = 2H2O ( l ) ;△H =- 572 kJ ?mol-
CH4( g ) +2O2 (g ) = CO2 (g ) +2H2O ( l ) ;△H =- 890 kJ ?mol-
由1mol 氢气和3mol甲烷组成的混合气体在上述条件
下完全燃烧时放出的热量为多少。2. )根据热化学方程式求反应热解:Q = (572kJ ÷ 2) + (890 kJ×3) =2956 kJ [ 练习2 ] 已知:
2H2O(l) = 2H2 (g) + O2 (g) ;△H =+517.6 kJ ?mol-1
CH4(g) +2O2 (g) = CO2 (g) +2H2O (l) ; △H =- 890.3 kJ ?mol-1
则:1g 氢气和1g甲烷分别燃烧后,放出热量之比约
为 (A) 1 :34 (B) 1 :1.7 (C) 2.3 :1 (D) 4.6 :1517.6/4 分析:890.3/16=517.6 890.3/4选 C [ 例3 ] 在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l) ;△H =- 571.6 kJ ?mol-1
C3H8(g) +5O2 (g) = 3CO2 (g) +4H2O (l) ;△H =- 2220 kJ ?mol-1
5mol 氢气和丙烷的混合气完全燃烧时放热3847kJ,则
氢气和甲烷的体积比为 (A) 1:3 (B) 3:1 (C) 1:4 (D) 1:13.) 求混合物的组成16.6%2.1%5.1%76.2%我国化石燃料和水电能源消耗构成图三大化石燃料全球化石燃料可开采期预测表№不可再生能源① 现今用的燃料是什么?主要是什么?
② 燃料充分燃烧的条件有哪些?
③ 燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④ 导致酸雨的主要原因之一是什么?
⑤ 怎样高效、清洁地利用煤炭?
⑥ 怎样提高固体和液体燃料的燃烧效率?二、燃料的充分燃烧
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面煤中所含硫在燃烧时会生成SO2要有适当过量的空气
燃料与空气要有足够大的接触面积
高效清洁利用煤炭的重要途径将焦炭在高温下与水蒸气反应,则得到CO和H2开发新能源——开源练习:简要说明使煤炉中的煤充分燃烧所应采取的措施。打开炉门在煤饼上打孔或将煤做成煤块
煤粉
燃烧时要有足够多的空气燃料与空气要有足够大的接触面 练习:如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是_________.
(2)产生上述现象的原因是_________.
(3)写出有关反应的离子方程式.
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于、“小于”、“等于”)镁片和盐酸的总能量.练习:下列说法正确的是( )
A.需加热才能发生的反应一定是吸热反应
B.放热的反应在常温下就一定能进行
C.反应是放热还是吸热是由反应物和生成物所具有的总能量的相对大小决定的
D.吸热反应在一定条件下也能进行 C、D
