人教版高中化学必修二4.1开发利用金属矿物和海水资源 课件(共34张PPT)
文档属性
| 名称 | 人教版高中化学必修二4.1开发利用金属矿物和海水资源 课件(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-07 21:45:38 | ||
图片预览








文档简介
课件34张PPT。为什么中日在钓鱼岛问题上互不相让? 钓鱼岛又称钓鱼台、钓鱼台群岛、钓鱼台列岛(日本人称其为“尖阁列岛”),位于中国东海大陆架的东部边缘,在地质结构上是附属于台湾的大陆性岛屿。钓鱼列岛周围海域面积约为17万平方公里,相当于5个台湾本岛面积。钓鱼诸岛及其附近海域,不仅蕴藏有大量石油资源,在其他方面也有巨大的经济价值。问题与讨论:海底石油:1350亿吨
天然气:140万亿立方米
镁、钾、铀、锶等矿物:5亿亿吨(液体矿山)
锰结核:3万亿吨;
鱼虾贝藻:6亿吨/年,现在捕捞量9000万吨/年
波浪能:700亿千瓦
潮汐能:27亿千瓦
重水:200万吨
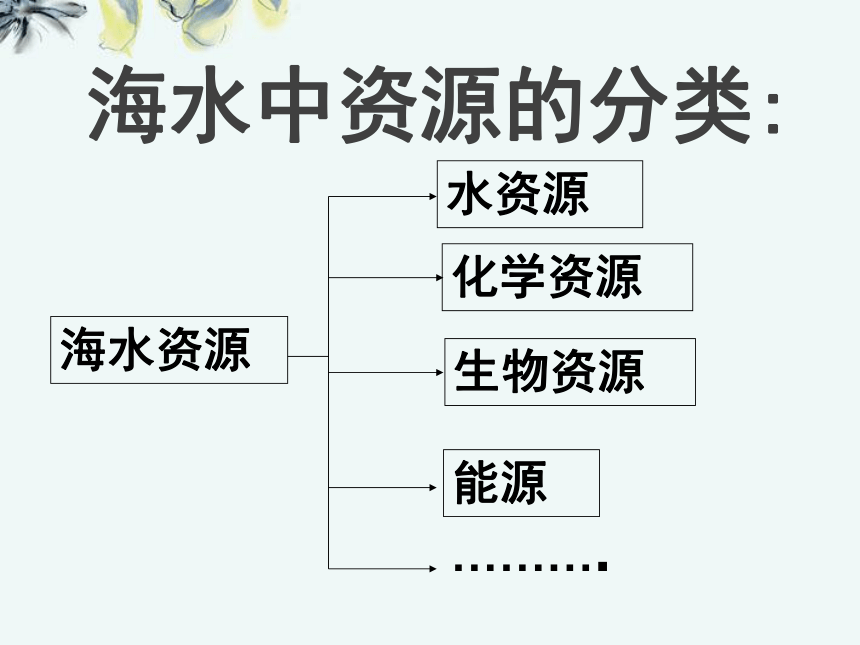
水:13亿亿吨资料:海水:名副其实的液体资源宝库!海水中资源的分类:海水资源水资源化学资源生物资源能源……….海水资源的分布特点:1、海水资源的广阔性2、海水资源的多样性3、海水资源的分散性 总之,海洋是一个远未完全开发的巨大化学资源宝库!!!第一节开发利用金属矿物和海水资源
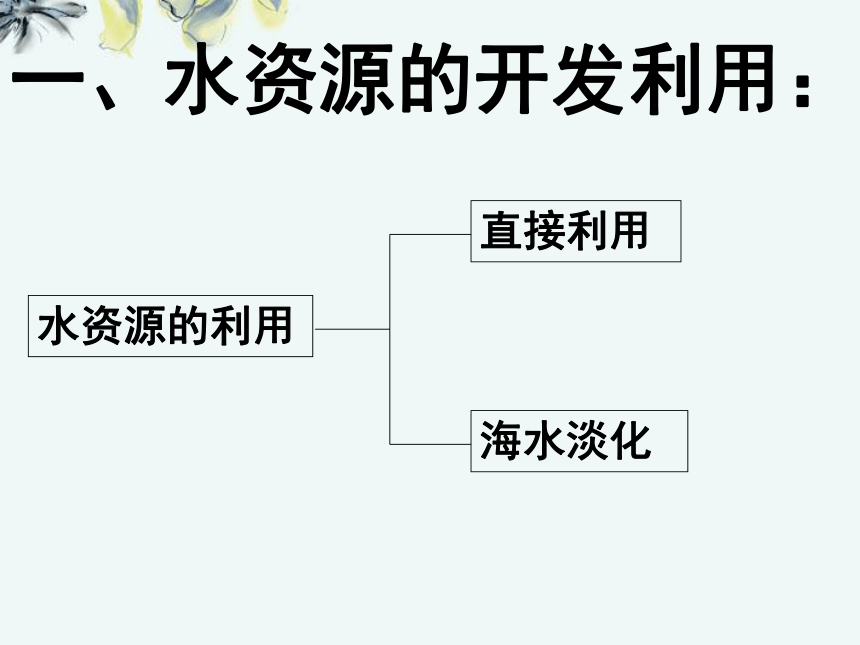
一、水资源的开发利用:海水的淡化: (1)海水淡化的途径:
◆从海水中提取淡水
◆从海水中分离出盐
(2)海水淡化的方法:p90
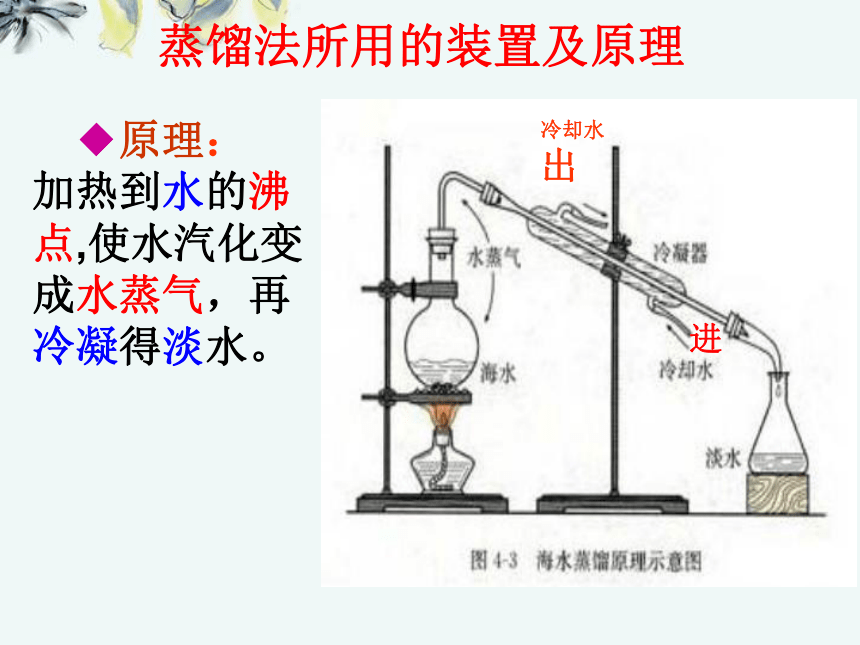
◆蒸 馏 法(最先使用,技术成熟,但成
本高)
◆电渗析法(成本低,但未能大量生产)
◆离子交换法(目前正迅速发展,但需要
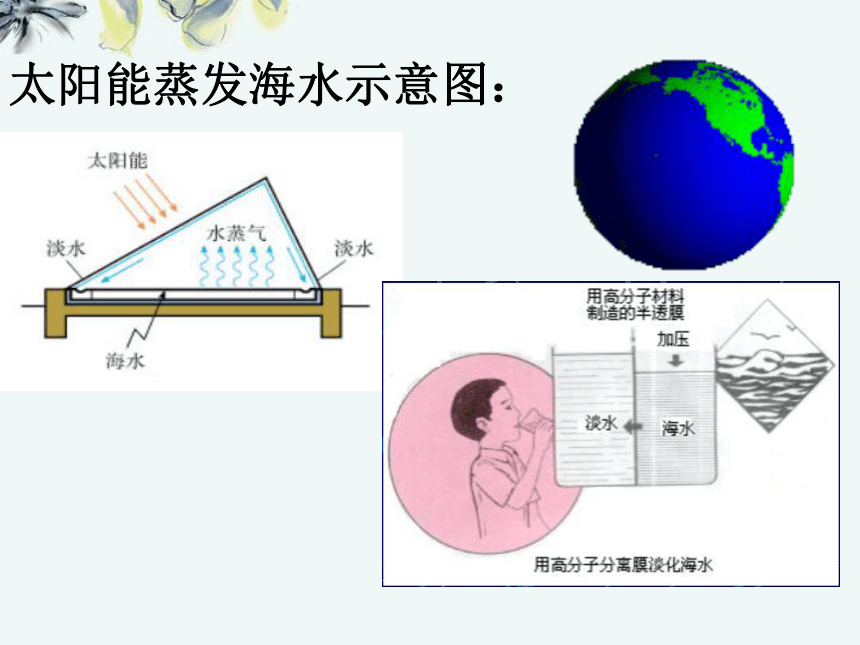
不断更新离子交换树脂)蒸馏法所用的装置及原理 ◆原理: 加热到水的沸点,使水汽化变成水蒸气,再冷凝得淡水。进冷却水 出太阳能蒸发海水示意图: 二、化学资源的开发利用:海
水
晒
盐海水浓缩过滤蒸发结晶过量食盐的提取
海水中Mg2+?Mg(OH)2① MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2◆从海水中制金属镁② Mg(OH)2 + 2HCl = MgCl2 + 2H2O①②③④1、写出步骤①②④涉及的方程式2、思考:从海水中提取氯化镁时,经历了“氯化镁----氢氧
化镁---氯化镁”的转 化过程,这样做的目的是什么?海水中氯化镁的含量少,但与Ca(OH)2反应后生成Mg(OH)2,
再与盐酸反应生成纯净的氯化镁,即提纯Mg2+,也称为Mg2+的富集
镁的用途知多少? 镁是一种重要的金属材料,密度较小,属于轻金属,它能和一些金属形成合金,合金的硬度和强度都很大,可用于制造飞机、火箭、导弹的零部件,镁也被称为国防金属。镁条燃烧时发出白光,所以可以用于制造焰火和信号弹海水中提取溴的实验海水中Br- 低浓度Br2①②HBr溶液液溴氯气氯气SO2③①向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。②向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。转化为氢溴酸③向吸收塔中溶液内通入适量的氯气。最后经蒸馏可得液溴
(用CCl4萃取)二、写出步骤①②③涉及的方程式一、工业流程:三、从海水中提取溴时,经历了“溴离子----溴单质---氢溴酸”的转 化过程,这样做的目的是什么?富集溴离子海水中提取溴实验的方程式2NaBr + Cl2 = Br2 + 2NaCl 上面置换反应得到的 Br2 的浓度
很低,难以收集,用空气吹出 Br2 后
用 SO2 吸收,使溴得到富集, Br2 + SO2 + 2H2O = 2HBr + H2SO42HBr + Cl2 = Br2 + 2HCl溴的化合物的用途如何证明海带中存在碘元素? [实验4-2] (一)实验方法:
(1)称取3g干海带,用刷子把干海带表面的附着物刷净
(不要用水洗)。 将海带剪碎,用酒精润
湿(便于灼烧)后,放在坩埚中。
(2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,
停止加热,冷却。 (3)将海带灰转移到小烧杯中,向烧杯中加入10ml蒸馏
水,搅拌,煮沸2min-3min,使可溶物溶解。 (4)用胶头滴管取上清液于试管中,向滤液中滴入几滴硫酸,再加入约1ml H2O2溶液,观察并记录现象。
取少量上述滤液,滴加几滴淀粉溶液,观察并记录现象。
为什么为什么因为碘离子会溶解在水中而损失将碘离子氧化为碘单质(二)实验现象:
加入H2O2溶液后,溶液颜色变为深黄
色;加入淀粉溶液后,溶液又变为深蓝色。(三) 化学方程式(关键步骤):
2KI + H2O2 + H2SO4 = I2+ K2SO4 + 2H2O 海水综合利用联合工业体系一例 p92证明海带中含有碘离子变式训练小组合作,设计实验方案探究,
如何从海带中提取得到碘单质?海带提碘流程图:海带海带灰溶解过滤灼烧残渣含I-的溶液稀H2SO4
H2O2含I2的溶液含I2的有机溶液萃取
分液蒸馏I2 碘对动植物的生命是极其重要的。海水里的碘化物和碘酸盐进入大多数海生物的新陈代谢中。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
碘及其相关化合物主要用于医药、照相及染料。它还可作为示踪剂,进行系统的监测,例如用于地热系统监测。海水中Mg2+?Mg(OH)2◆从海水中制金属镁①②③④① MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2② Mg(OH)2 + 2HCl = MgCl2 + 2H2O海水中提取溴的实验海水中Br- 低浓度Br2①②HBr溶液液溴氯气氯气SO2③工业流程:① 2NaBr + Cl2 = Br2 + 2NaCl② Br2 + SO2 + 2H2O = 2HBr + H2SO4(关键步骤)③2HBr + Cl2 = Br2 + 2HCl4.已知海带中的碘以I-形式存在,若将其转
化为单质碘,不能使用的物质是( )
A.Cl2 B.Br2
C.H2O2 D.H2O证明海带中含有碘,有以下步骤①灼烧海带至完全生成灰,停止加热,冷却;②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;③用剪刀剪碎海带,用酒精润湿,放入坩埚中; ④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.(1)合理的步骤是____________(2)证明含碘的步骤是____,现象是_____________________,反应的离子方程式是__________________③①④②②滴入淀粉溶液,溶液变蓝 由于镁很活泼,是还原性很强的金属,所以加热时能与许多气体物质反应。如空气、二氧化碳、氮气等,但不与氢气和稀有气体反应。练 习镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是镁蒸气在气体中冷却,下列可做冷却剂的是(1)空气 (2)CO2 (3)Ar (4)H2 (5)N2 A.(1)(2)? B.(2)(3) C.(3)(4)? D.(4)(5)???C2.下列叙述中所描述的物质一定是金属元
素的是
A.易失去电子的物
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有
2个电子的元素D3.铝加入下列物质中会产生气体的是
A.熔融NaOH???? B.KOH溶液
C.Na2O2 固体??? D.Na2O2和水
4.铝热剂中铝的作用是
A.催化剂?????? B.氧化剂?????
C.还原剂?????? D.填充剂B DC5.下列冶炼金属的反应,一定是置换反应
的是
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 C6.下列说法中不正确的是
A.金属的冶炼原理,就是利用氧化还原反应
原理,用还原剂在一定条件下将金属从矿
石中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一
般较弱A B 7.下列冶炼金属的反应,一定是分解反应
的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 A B8.列金属冶炼方法与其他三种不同的是
A.Fe B.K C.Mg D.Al A
天然气:140万亿立方米
镁、钾、铀、锶等矿物:5亿亿吨(液体矿山)
锰结核:3万亿吨;
鱼虾贝藻:6亿吨/年,现在捕捞量9000万吨/年
波浪能:700亿千瓦
潮汐能:27亿千瓦
重水:200万吨
水:13亿亿吨资料:海水:名副其实的液体资源宝库!海水中资源的分类:海水资源水资源化学资源生物资源能源……….海水资源的分布特点:1、海水资源的广阔性2、海水资源的多样性3、海水资源的分散性 总之,海洋是一个远未完全开发的巨大化学资源宝库!!!第一节开发利用金属矿物和海水资源
一、水资源的开发利用:海水的淡化: (1)海水淡化的途径:
◆从海水中提取淡水
◆从海水中分离出盐
(2)海水淡化的方法:p90
◆蒸 馏 法(最先使用,技术成熟,但成
本高)
◆电渗析法(成本低,但未能大量生产)
◆离子交换法(目前正迅速发展,但需要
不断更新离子交换树脂)蒸馏法所用的装置及原理 ◆原理: 加热到水的沸点,使水汽化变成水蒸气,再冷凝得淡水。进冷却水 出太阳能蒸发海水示意图: 二、化学资源的开发利用:海
水
晒
盐海水浓缩过滤蒸发结晶过量食盐的提取
海水中Mg2+?Mg(OH)2① MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2◆从海水中制金属镁② Mg(OH)2 + 2HCl = MgCl2 + 2H2O①②③④1、写出步骤①②④涉及的方程式2、思考:从海水中提取氯化镁时,经历了“氯化镁----氢氧
化镁---氯化镁”的转 化过程,这样做的目的是什么?海水中氯化镁的含量少,但与Ca(OH)2反应后生成Mg(OH)2,
再与盐酸反应生成纯净的氯化镁,即提纯Mg2+,也称为Mg2+的富集
镁的用途知多少? 镁是一种重要的金属材料,密度较小,属于轻金属,它能和一些金属形成合金,合金的硬度和强度都很大,可用于制造飞机、火箭、导弹的零部件,镁也被称为国防金属。镁条燃烧时发出白光,所以可以用于制造焰火和信号弹海水中提取溴的实验海水中Br- 低浓度Br2①②HBr溶液液溴氯气氯气SO2③①向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。②向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。转化为氢溴酸③向吸收塔中溶液内通入适量的氯气。最后经蒸馏可得液溴
(用CCl4萃取)二、写出步骤①②③涉及的方程式一、工业流程:三、从海水中提取溴时,经历了“溴离子----溴单质---氢溴酸”的转 化过程,这样做的目的是什么?富集溴离子海水中提取溴实验的方程式2NaBr + Cl2 = Br2 + 2NaCl 上面置换反应得到的 Br2 的浓度
很低,难以收集,用空气吹出 Br2 后
用 SO2 吸收,使溴得到富集, Br2 + SO2 + 2H2O = 2HBr + H2SO42HBr + Cl2 = Br2 + 2HCl溴的化合物的用途如何证明海带中存在碘元素? [实验4-2] (一)实验方法:
(1)称取3g干海带,用刷子把干海带表面的附着物刷净
(不要用水洗)。 将海带剪碎,用酒精润
湿(便于灼烧)后,放在坩埚中。
(2)用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,
停止加热,冷却。 (3)将海带灰转移到小烧杯中,向烧杯中加入10ml蒸馏
水,搅拌,煮沸2min-3min,使可溶物溶解。 (4)用胶头滴管取上清液于试管中,向滤液中滴入几滴硫酸,再加入约1ml H2O2溶液,观察并记录现象。
取少量上述滤液,滴加几滴淀粉溶液,观察并记录现象。
为什么为什么因为碘离子会溶解在水中而损失将碘离子氧化为碘单质(二)实验现象:
加入H2O2溶液后,溶液颜色变为深黄
色;加入淀粉溶液后,溶液又变为深蓝色。(三) 化学方程式(关键步骤):
2KI + H2O2 + H2SO4 = I2+ K2SO4 + 2H2O 海水综合利用联合工业体系一例 p92证明海带中含有碘离子变式训练小组合作,设计实验方案探究,
如何从海带中提取得到碘单质?海带提碘流程图:海带海带灰溶解过滤灼烧残渣含I-的溶液稀H2SO4
H2O2含I2的溶液含I2的有机溶液萃取
分液蒸馏I2 碘对动植物的生命是极其重要的。海水里的碘化物和碘酸盐进入大多数海生物的新陈代谢中。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
碘及其相关化合物主要用于医药、照相及染料。它还可作为示踪剂,进行系统的监测,例如用于地热系统监测。海水中Mg2+?Mg(OH)2◆从海水中制金属镁①②③④① MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2② Mg(OH)2 + 2HCl = MgCl2 + 2H2O海水中提取溴的实验海水中Br- 低浓度Br2①②HBr溶液液溴氯气氯气SO2③工业流程:① 2NaBr + Cl2 = Br2 + 2NaCl② Br2 + SO2 + 2H2O = 2HBr + H2SO4(关键步骤)③2HBr + Cl2 = Br2 + 2HCl4.已知海带中的碘以I-形式存在,若将其转
化为单质碘,不能使用的物质是( )
A.Cl2 B.Br2
C.H2O2 D.H2O证明海带中含有碘,有以下步骤①灼烧海带至完全生成灰,停止加热,冷却;②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;③用剪刀剪碎海带,用酒精润湿,放入坩埚中; ④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.(1)合理的步骤是____________(2)证明含碘的步骤是____,现象是_____________________,反应的离子方程式是__________________③①④②②滴入淀粉溶液,溶液变蓝 由于镁很活泼,是还原性很强的金属,所以加热时能与许多气体物质反应。如空气、二氧化碳、氮气等,但不与氢气和稀有气体反应。练 习镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是镁蒸气在气体中冷却,下列可做冷却剂的是(1)空气 (2)CO2 (3)Ar (4)H2 (5)N2 A.(1)(2)? B.(2)(3) C.(3)(4)? D.(4)(5)???C2.下列叙述中所描述的物质一定是金属元
素的是
A.易失去电子的物
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有
2个电子的元素D3.铝加入下列物质中会产生气体的是
A.熔融NaOH???? B.KOH溶液
C.Na2O2 固体??? D.Na2O2和水
4.铝热剂中铝的作用是
A.催化剂?????? B.氧化剂?????
C.还原剂?????? D.填充剂B DC5.下列冶炼金属的反应,一定是置换反应
的是
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 C6.下列说法中不正确的是
A.金属的冶炼原理,就是利用氧化还原反应
原理,用还原剂在一定条件下将金属从矿
石中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一
般较弱A B 7.下列冶炼金属的反应,一定是分解反应
的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁 A B8.列金属冶炼方法与其他三种不同的是
A.Fe B.K C.Mg D.Al A
