人教高中化学-必修二-4.1第一课时金属资源的开发利用课件(22张ppt)
文档属性
| 名称 | 人教高中化学-必修二-4.1第一课时金属资源的开发利用课件(22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-09 09:41:19 | ||
图片预览








文档简介
第一节 开发利用金属矿物和海水资源
第1课时 金属矿物的开发利用
了解化学方法在金属矿物开发(主要是金属的冶炼)中的作用。
学生在掌握金属冶炼的一般原理基础上,了解适用于不同金
属的冶炼方法。
[导入一]【问题导入】
在初中学习了金属活动顺序表。从左到右,金属性逐渐减弱,对应离子的氧化性逐渐增强。
[问题1]:在自然界中金属大多数以什么形式存在?
[问题2]:要使金属矿物转化为金属单质,金属元素的化合价如何变化?
? 知识点一 金属的冶炼
1.金属元素的存在
自然界中,除____、____等极少数金属外,绝大多数金属元素以________的形式存在。在地壳中,含量最高的金属元素是____,其次是____。
2.金属冶炼的实质
金属的冶炼是将金属矿石中的金属从其化合物中还原出来,用于生产和制造各种金属材料。也就是说用还原的方法,使金属化合物中的金属阳离子得到电子,变成金属原子。
金
铂
化合物
Al
Fe
即:Mn++ne- M
不活泼的金属
焦炭
一氧化碳
氢气
活泼
【思维拓展】
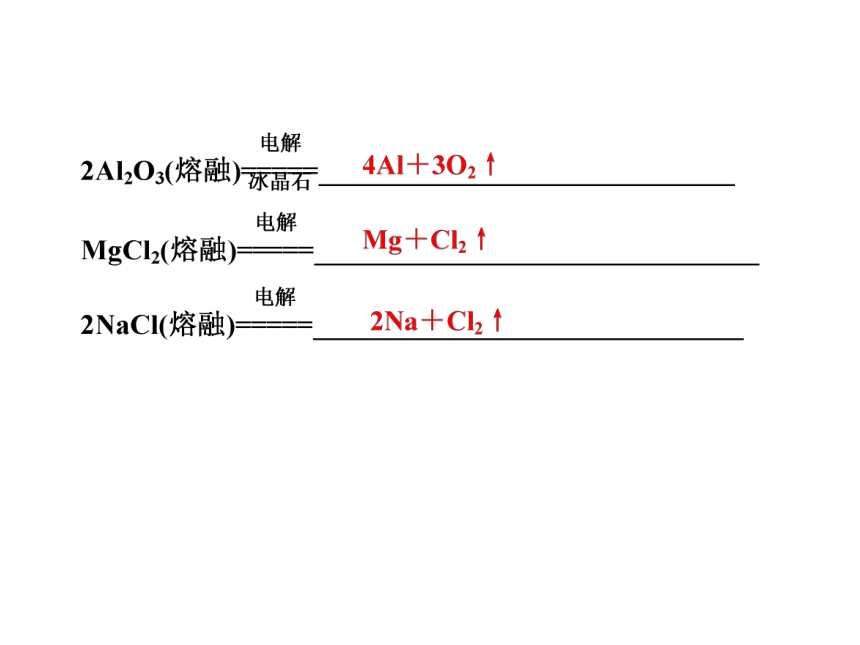
为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?
[答案] 工业上采用电解法冶炼铝的材料是Al2O3,而不是AlCl3,这是因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不能导电;工业上采用电解法冶炼镁的材料是MgCl2,而不是MgO,这是因为MgO虽是离子化合物,但其熔点太高,熔融时会消耗大量热能,成本较高。
C
【规律小结】
金属的冶炼方法与金属活动性顺序的关系:
金属活动
性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
单质
还原性 强→弱
离子
氧化性 弱→强
冶炼的
一般方法 电解法 热还原法 热分
解法 -
铝和金属氧化物
KClO3
Mg
黑色物质
[答案] 铝热反应为放热反应,但需要高温才能发生,镁条是引燃剂,氯酸钾是助氧剂,镁条燃烧提供热量,促使 KClO3发生分解;KClO3分解放出O2,保证镁条的继续燃烧,镁条燃烧放出热量,引发铝热反应进行。由于该反应为放热反应,反应放出的热量可以维持反应继续进行,因此反应一经引发,就可剧烈进行。纸漏斗用水浸湿,是为了防止滤纸被烧坏;蒸发皿中盛有沙子,是为了防止落下的熔融物炸裂蒸发皿。
Fe2O3
Al
置换
①②③④
使熔融物易于落下
防止溅落物炸裂蒸发皿
引发氯酸钾的分解反应
引发铝热反应
【规律小结】
答案: 2Al2O3(熔融) 4Al+3O2↑
2Al + Cr2O3 Cr + Al2O3
△
利用率
使用量
回收和再利用
其他材料
1.判断正误(正确的打“√”,错误的打“×”)。
(1)自然界中的金属都以化合态存在( )
(2)金属阳离子被还原,一定得到金属单质( )
×
×
(3)将钠加入氯化镁饱和溶液中制取镁( )
×
(4)Al和MgO的混合物是铝热剂( )
×
(5)利用CO冶炼铁的反应是置换反应( )
×
2.由下列物质冶炼相应金属时采用电解法的是( )
A.Fe2O3 B.NaCl C.Cu2S D.AlCl3
3.下列氧化物不能跟铝粉组成铝热剂的是( )
A.WO3 B.MnO2 C.Na2O D.V2O5
B
C
4、在反应Al+YaOb ====== Al2O3+Y中,Y不可能的物质是( )
A.Fe B.Mg C.Cr D.Mn
高温
B
5.用铝热法还原下列化合物,制得金属各1 mol,消耗铝最少的是( )
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
C
6、在熔融状态下,Na与KCl存在可逆反应:Na+KCl
NaCl+K,通过调整温度,可利用金属Na来制取K。
根据上表的熔点和沸点,确定由Na与KCl反应制取K的合适温度为( )
A.770 ℃ B.801 ℃
C.850 ℃ D.770~801 ℃
C
物质 K Na KCl NaCl
熔点(℃) 63.6 97.8 770 801
沸点(℃) 774 883 1 500 1 413
7、古代的“药金”外观与金相似,常误以为是金子。冶炼方法如下:将碳酸锌、赤铜矿(Cu2O)和木炭混合加热至800 ℃得金光闪闪的“药金”。
(1)“药金”的主要成分是 。?
(2)有关的化学方程式是 ?
Cu、Zn
ZnCO3 2Cu+CO↑
Cu2O+C 2Cu+CO↑
ZnO+C Zn+CO↑
第1课时 金属矿物的开发利用
了解化学方法在金属矿物开发(主要是金属的冶炼)中的作用。
学生在掌握金属冶炼的一般原理基础上,了解适用于不同金
属的冶炼方法。
[导入一]【问题导入】
在初中学习了金属活动顺序表。从左到右,金属性逐渐减弱,对应离子的氧化性逐渐增强。
[问题1]:在自然界中金属大多数以什么形式存在?
[问题2]:要使金属矿物转化为金属单质,金属元素的化合价如何变化?
? 知识点一 金属的冶炼
1.金属元素的存在
自然界中,除____、____等极少数金属外,绝大多数金属元素以________的形式存在。在地壳中,含量最高的金属元素是____,其次是____。
2.金属冶炼的实质
金属的冶炼是将金属矿石中的金属从其化合物中还原出来,用于生产和制造各种金属材料。也就是说用还原的方法,使金属化合物中的金属阳离子得到电子,变成金属原子。
金
铂
化合物
Al
Fe
即:Mn++ne- M
不活泼的金属
焦炭
一氧化碳
氢气
活泼
【思维拓展】
为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?
[答案] 工业上采用电解法冶炼铝的材料是Al2O3,而不是AlCl3,这是因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不能导电;工业上采用电解法冶炼镁的材料是MgCl2,而不是MgO,这是因为MgO虽是离子化合物,但其熔点太高,熔融时会消耗大量热能,成本较高。
C
【规律小结】
金属的冶炼方法与金属活动性顺序的关系:
金属活动
性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
单质
还原性 强→弱
离子
氧化性 弱→强
冶炼的
一般方法 电解法 热还原法 热分
解法 -
铝和金属氧化物
KClO3
Mg
黑色物质
[答案] 铝热反应为放热反应,但需要高温才能发生,镁条是引燃剂,氯酸钾是助氧剂,镁条燃烧提供热量,促使 KClO3发生分解;KClO3分解放出O2,保证镁条的继续燃烧,镁条燃烧放出热量,引发铝热反应进行。由于该反应为放热反应,反应放出的热量可以维持反应继续进行,因此反应一经引发,就可剧烈进行。纸漏斗用水浸湿,是为了防止滤纸被烧坏;蒸发皿中盛有沙子,是为了防止落下的熔融物炸裂蒸发皿。
Fe2O3
Al
置换
①②③④
使熔融物易于落下
防止溅落物炸裂蒸发皿
引发氯酸钾的分解反应
引发铝热反应
【规律小结】
答案: 2Al2O3(熔融) 4Al+3O2↑
2Al + Cr2O3 Cr + Al2O3
△
利用率
使用量
回收和再利用
其他材料
1.判断正误(正确的打“√”,错误的打“×”)。
(1)自然界中的金属都以化合态存在( )
(2)金属阳离子被还原,一定得到金属单质( )
×
×
(3)将钠加入氯化镁饱和溶液中制取镁( )
×
(4)Al和MgO的混合物是铝热剂( )
×
(5)利用CO冶炼铁的反应是置换反应( )
×
2.由下列物质冶炼相应金属时采用电解法的是( )
A.Fe2O3 B.NaCl C.Cu2S D.AlCl3
3.下列氧化物不能跟铝粉组成铝热剂的是( )
A.WO3 B.MnO2 C.Na2O D.V2O5
B
C
4、在反应Al+YaOb ====== Al2O3+Y中,Y不可能的物质是( )
A.Fe B.Mg C.Cr D.Mn
高温
B
5.用铝热法还原下列化合物,制得金属各1 mol,消耗铝最少的是( )
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
C
6、在熔融状态下,Na与KCl存在可逆反应:Na+KCl
NaCl+K,通过调整温度,可利用金属Na来制取K。
根据上表的熔点和沸点,确定由Na与KCl反应制取K的合适温度为( )
A.770 ℃ B.801 ℃
C.850 ℃ D.770~801 ℃
C
物质 K Na KCl NaCl
熔点(℃) 63.6 97.8 770 801
沸点(℃) 774 883 1 500 1 413
7、古代的“药金”外观与金相似,常误以为是金子。冶炼方法如下:将碳酸锌、赤铜矿(Cu2O)和木炭混合加热至800 ℃得金光闪闪的“药金”。
(1)“药金”的主要成分是 。?
(2)有关的化学方程式是 ?
Cu、Zn
ZnCO3 2Cu+CO↑
Cu2O+C 2Cu+CO↑
ZnO+C Zn+CO↑
