人教版高一化学必修2第一章第二节元素周期律课件 (共65张PPT)
文档属性
| 名称 | 人教版高一化学必修2第一章第二节元素周期律课件 (共65张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-12 00:00:00 | ||
图片预览






文档简介
课件65张PPT。第二节《元素周期律》
第1课时第一章 《物质结构 元素周期律》 【教学目标】知识与技能:
1.以1~20号元素为例,了解元素原子核外电子的排布规律?2.掌握元素原子半径和主要化合价随原子序数的递增而呈现出的周期性变化规律。?
过程与方法:
1.学会归纳法、比较法。?2.培养抽象思维能力。
情感、态度与价值观:
养成勤于思考、勇于探究的科学品质。【教学重点】元素的原子核外电子排布、原子半径和
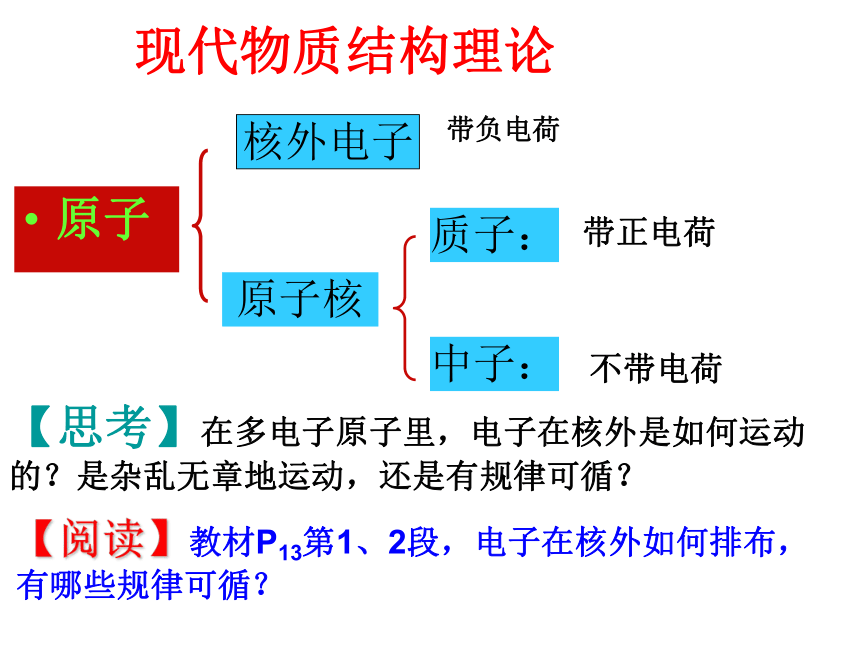
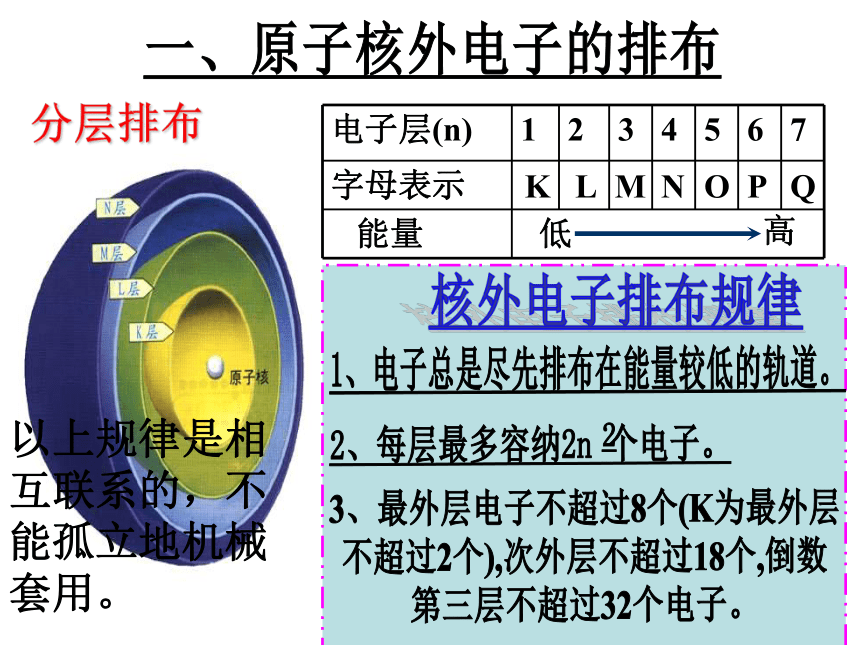
主要化合价随原子序数的递增而变化的规律。 【教学难点】原子核外电子的排布现代物质结构理论原子原子核带负电荷带正电荷不带电荷核外电子质子:中子:【思考】在多电子原子里,电子在核外是如何运动的?是杂乱无章地运动,还是有规律可循?【阅读】教材P13第1、2段,电子在核外如何排布,有哪些规律可循?一、原子核外电子的排布KL
MNOPQ1、电子总是尽先排布在能量较低的轨道。3、最外层电子不超过8个(K为最外层
不超过2个),次外层不超过18个,倒数
第三层不超过32个电子。以上规律是相互联系的,不能孤立地机械套用。 分层排布 【课堂练习】
1、掌握1至20号元素的原子结构示意图.写出O、Mg、Cl的原子结构示意图
2、总结1至18号原子结构的特殊性。
(1)最外层有1个电子的元素:
(2)最外层有2个电子的元素:H、Li、NaHe、Be、Mg(3)最外层电子数是次外层电子数2倍的元素:
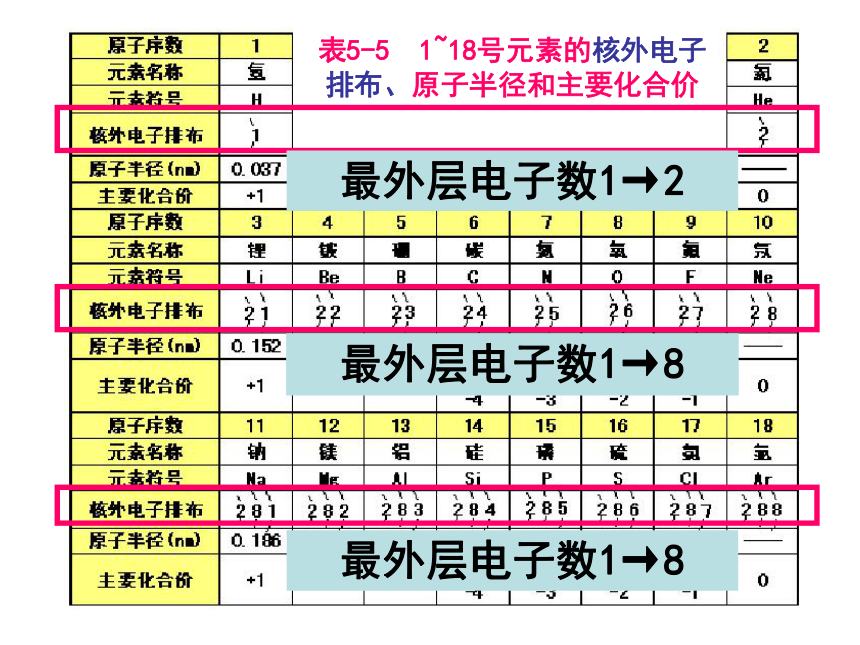
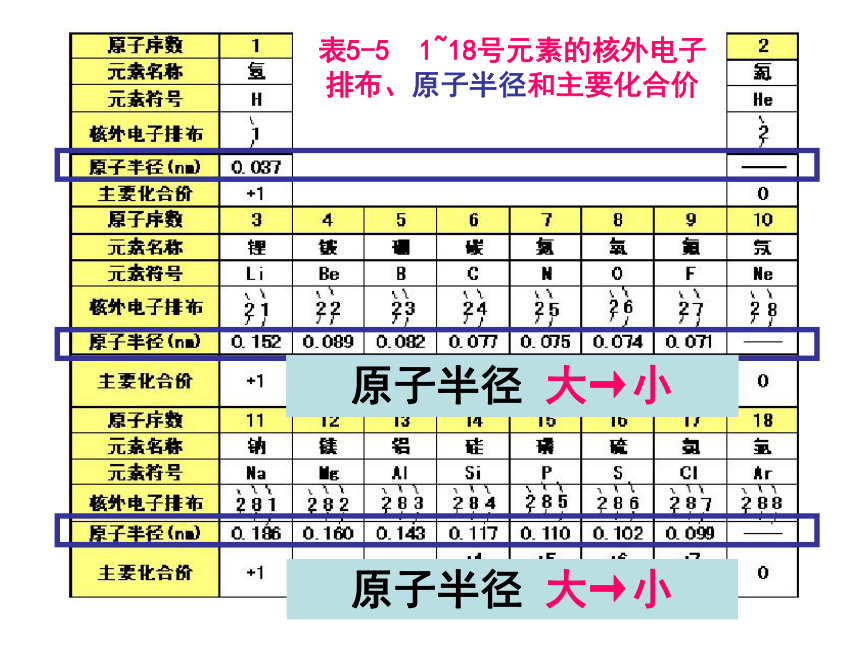
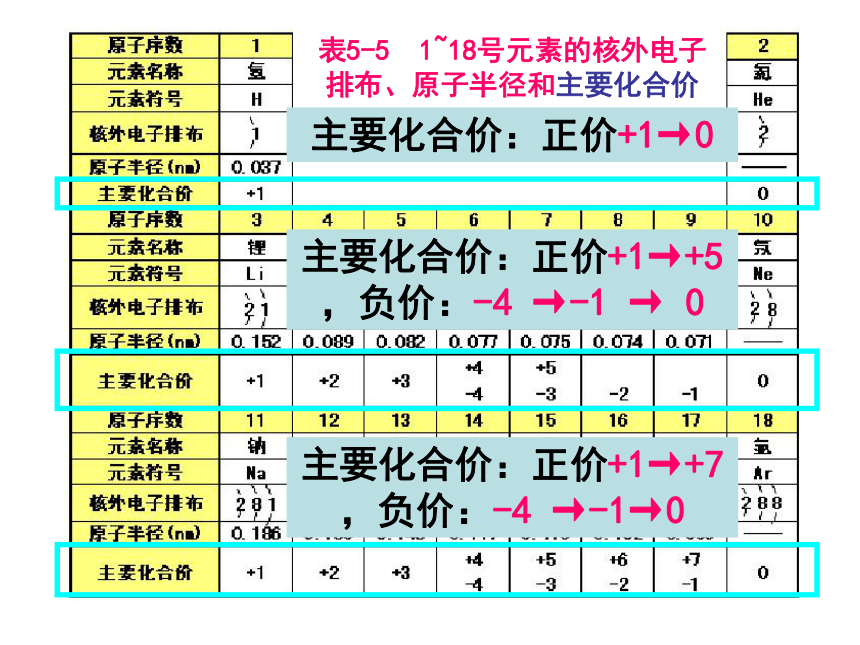
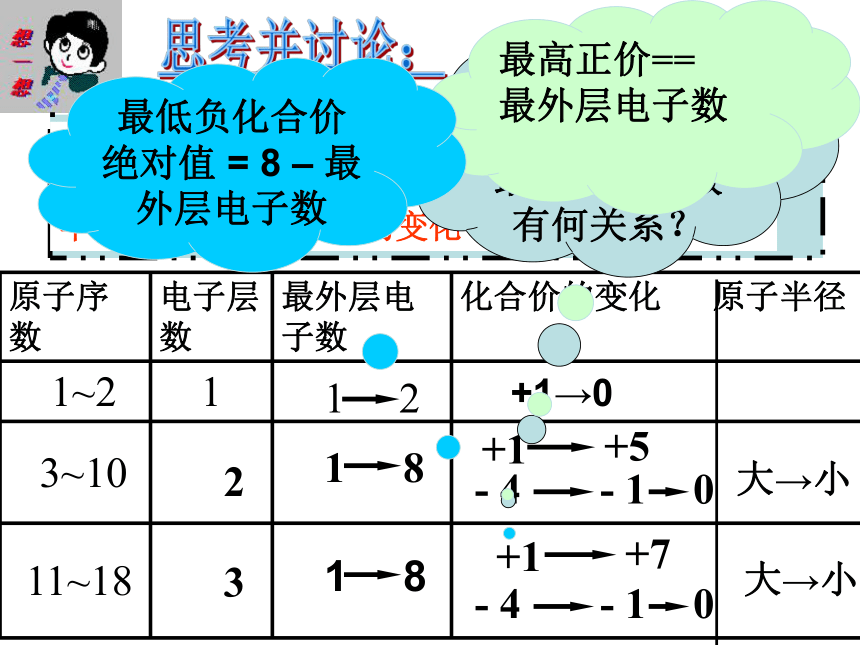
(4)最外层电子数是次外层电子数3倍的元素:CO二、元素周期律 请阅读并比较表1-2中1~18号元素的有关数据,从中能找出什么规律?表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 最外层电子数1→2最外层电子数1→8最外层电子数1→8表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 原子半径 大→小原子半径 大→小表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4 →-1 → 0主要化合价:正价+1→+7,负价:-4 →-1→0思考并讨论:2 3+1→0大→小大→小主族元素的最高正化合价与最外层电子数有何关系?最高正价==
最外层电子数最低负化合价绝对值 = 8 – 最外层电子数 结论: 通过上面的讨论我们知道,随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈周期性的变化。【课堂练习】
3、下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
4.在1~18号元素中,除稀有气体元素外:
(1)原子半径最大的元素是 ,
(2)原子半径最小的元素是 。
BNaH1.下列说法中正确的是 ( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
【巩固训练】A 2.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、PAB3、比较Na、Mg原子半径的大小 ;
比较S、O原子半径的大小 。
4.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第四周期元素
B.R一定是ⅣA族元素
C.R最高正价氧化物化学式为RO2
D.R气态氢化物化学式为H2R
Na>MgS>OD5.下列半径最大的微粒是 ( )
A. F B. Mg 2+ C. Cl- D. Ca2+
6.主族元素X的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
(A)X的原子序数比Y的小
(B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大
(D)X元素的最高正价比Y的小CCD 结论: 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?这是我们下一节课将要探讨的内容。 随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈周期性的变化。下课了!1.根据非金属单质与H2化合生成氢化物的难易或氢化物的稳定性程度。越容易与H2化合,则生成的氢化物越稳定,非金属性越强。
2.根据非金属元素最高价氧化物对应的水化物酸性强弱。酸性越强,则元素的非金属性越强。
3. 根据对应阴离子还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究:列表总结:NaOH
强碱Mg(OH)2
中强碱
Al(OH)3
两性
氢氧化物剧烈 迅速 BC1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na能从MgCl2的溶液中把Mg置换出来;
非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化。2.下列事实能说明非金属性Cl >S的是:
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,
S的最高正价为+6
AB3.下列递变规律不正确的是 ( )
A.Na.Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高C从元素周期律的发现
你想到了些什么? 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
先辈们对真理执着追求的精神是我们人类不尽的财富。
他们的追求除了其优秀的个人素质以外,真理本身那种理性的美,也给了他们人生以巨大的乐趣。
同学们的学习是辛苦的,又是幸福的,每一门学科中都隐含着无穷的美。能引起情感共鸣的诗歌、散文和音乐, 陶冶我们的情操;而化学学科中的新奇、和谐、简约,同样闪耀着美的光辉。结论一:随着原子序数的递增,原 子核外电子排布呈周期性 变化结论二:随着原子序数的递增,元 素的化合价周期性变化结论三:随着原子序数的递增,元 素的原子半径呈周期性变化现象: 镁与冷水反应缓慢,产生少量气泡,滴入酚酞试液后不变色。 反应式:Mg + 2H2O == Mg(OH)2 + H2结论:镁元素的金属性比钠弱△ 加热后镁与沸水反应较剧烈,产生较多气泡,溶液变为红色。讨论第三周期元素的性质递变现象: 镁与铝均能与盐酸反应产生气泡。但镁反应更剧烈。反应:Mg + 2HCl = MgCl2 + H2结论:镁元素的金属性比铝强2Al + 6HCl = 2AlCl3+ 3H2钠(Na)、镁(Mg)、铝(Al)金属性比较冷水、剧烈冷水、缓慢结论金属性:Na>Mg剧烈迅速结论金属性:Mg>Al强碱性中强碱两性氢氧化物结论金属性:Mg>Mg>Al结论:电子层数相同的原子,随着原子序数的增加金属性减弱。NaOHMg(OH)2Al(OH)3强碱中强碱两性氢氧化物与冷水剧烈反应与沸水反应;与酸剧烈反应与酸缓慢反应小结:金属性强弱判断依据:单质与水反应的难易程度
单质与酸反应的剧烈程度
最高价氧化物对应水化物的碱性强弱钠镁铝的金属性逐渐减弱 两性氢氧化物: 既能与酸起反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,叫做两性氢氧化物Al(OH)3制备:AlCl3+3NaOH=Al(OH)3↓+3NaCl与酸:Al(OH)3+3HCl=AlCl3+3H2O与碱:Al(OH)3+NaOH=NaAlO2+2H2O两性氧化物: 既能与酸起反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物(课本99页)与酸:Al2O3+6HCl=2AlCl3+3H2O与碱:Al2O3+2NaOH=2NaAlO2+H2O小结 钠与冷水反应,镁与沸水反应,铝不与水反应。 钠与酸反应很剧烈,镁与酸反应剧烈,铝与酸反应平缓 NaOH 是强碱,Mg(OH)2 是中强碱,Al(OH)3 是两性氢氧化物。金属性强弱顺序:Na > Mg > Al硅(Si)、磷(P)、硫(S)、氯(Cl)
非金属性的比较(课本15页表)SiPSCl高温H4SiO4
弱酸磷蒸气与氢气能反应H3PO4
中强酸须加热H2SO4
强酸光照或点燃爆炸HClO4
最强酸结论:电子层数相同的原子,随着原子序数的增加非金属性增强。
氢化物化学式元素14Si15P16S17Cl 非金属性:Si < P < S < Cl单质与氢气的化合条件氢化物的稳定性SiH4PH3H2SHCl高温下少量反应磷蒸气,困难加热反应光照或点燃很不稳定不稳定较不稳定稳定从氢化物看
最高价氧化物最高价氧化物的水化物元素14Si15P16S17ClSiO2P2O5SO3Cl2O7H2SiO3 H3PO4 H2SO4 HClO4硅 酸磷 酸硫 酸高氯酸极弱酸中强酸强 酸最强酸 非金属性:Si < P < S < Cl从最高价氧化物的水化物看 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释:电子层数相同核电荷数增多原子半径减小原子失电子能力逐渐减弱,得电子能力逐渐增强同周期元素 从左到右原子核对最外层电子的吸引力增强1、当电子层数及核电荷数均不同时,电子层数越多的,半径越大;如Na<K(层不同,层多,径大)
2、当电子层数相同时,核电荷数越大的,半径越小;如Na>Mg;Na+>Mg2+(层相同,核多,径小)
3、阴离子半径大于对应的原子半径;如Cl<Cl-
4、阳离子半径小于对应的原子半径;如Na> Na+原子半径和离子半径与核电荷数、
电子层数以及电子数的关系结论5、电子排布相同的离子,离子半径随着核电荷数的递增而减小。随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(K层电子数 1→2)原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 -4→-1(稀有气体元素为零)决定了归纳出引起了元素化学性质金属性非金属性变化BC1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na能从MgCl2的溶液中把Mg置换出来;
2.下列事实能说明非金属性Cl >S的是:
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,
S的最高正价为+6
AB3.下列有关元素周期律的叙述正确的( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化C 4.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P5.下列递变规律不正确的是 ( )
A.Na.Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高ABC 6.在目前发现的元素中,
除了氢元素以外,半径最小的是何种元素。
7.除了稀有气体元素以外,半径最大的是何种元素?氟元素钫(Fr)元素8.下列化合物中,阳离子与阴离子半径比最小的是( )(A) NaF (B) LiI (C) CsF (D) LiF阳离子半径:Li+ < Na+ F- 思考用一句话概括一下元素性质的变化情况元素周期律的内容随着原子序数的递增,元素性质呈周期性的变化。元素周期律的实质元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。小结:第二节元素周期律方式元素性质变化趋势结论随着原子序数的递增元素原子的最外层电子排布1→8
(H,He)元素原子半径大→小元素化合价+1→+7
-4→-1→0元素金属性
与非金属性金属性减弱
非金属性增强呈现周期性变化 随着原子序数的递增,元素的性质呈现周期性变化 ,这叫做元素周期律。 元素的性质的周期性变化是元素原子的核外电子排布呈周期性变化的必然结果三、元素周期表和元素周期律的应用 1、元素的位、构、性三者之间的关系及其应用结构位置性质(1)结构决定位置:原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱(2)结构决定性质:
最外层电子数=主族元素的最高正价数
=8-负价数(3)位置反映性质:
同周期:从左到右,递变性 (4)同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:
分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图: 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强 ①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第6周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第2周期第ⅦA族(右上角)。 ②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。 2、元素的化合价与位置、结构的关系
(1)最高正价数=主族序数=最外层电子数 (2)最低负价数=主族序数 - 8
=最外层电子数 - 8元素周期律小结: (1)元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。 (2)可预测或推测元素的原子结构和性质 (3)在科学研究和生产上也有广泛的应用
见课本P.17 (4)在哲学方面,元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,有力地论证了事物变化的量变引起质变的规律性。 3、元素周期律的应用和意义练习1.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物是 ( )
A.NaOH B.Al(OH)3
C.Ca(OH)2 D.RbOH
2.下列物质中,既能与强酸又能与强碱反应的是( )
①Na2CO3②NaHCO3 ③Al2O3 ④Al(OH)3
A.①②③④ B.①②③
C.①②④ D.②③④BD3.下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
4. A.B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是 ( )
A.n+4 B.n+6 C.n+8 D.n+10
5.下列叙述中,肯定a金属比b金属活泼性强的是( )
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能BAD6. A、B、C三种元素的原子具有相同的电子层数,它们相同物质的量的原子获得相同物质的量的电子时释放出的能量是A>C>B,则它们原子序数大小顺序是( )
A.B>C>A B.A>B>C
C.BC D.A>C>B
7.下列各组物质的性质变化正确的是 ( )
A.酸性HClO4>HNO3>H3PO4>H2SiO4
B.稳定性H2S>HCl>HBr>HI
C.熔点Pb>K>Na>Li
D.溶解性NaHCO3>Na2CO3>NaOH DA8.原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________;
(2)与水反应最剧烈的非金属单质是___________;
(3)在室温下有颜色的气体单质是_____________;
(4)在空气中容易自燃的单质名称是________;
(5)除稀有气体外,原子半径最大的元素是______;
(6)原子半径最小的元素是_____________;
(7)气态氢化物水溶液呈碱性的元素是_________;
(8)气态氢化物最稳定的化学式是_____________;
(9)最高价氧化物对应水化物的酸性最强的元素是_____________。
9。在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为_________________________________。KF2F2 Ci2白磷NaHNHF ClH11. A、B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,A放出的能量大于B。下列叙述中正确的是( )
A.A的氧化性小于B
B.B-的还原性大于A-
C.A-的还原性大于B-
D.A的氧化性大于B原子序数 周期性 获得电子时,要释放出能量,放出能量的越多,说明其越容易得电子,A的非金属性越强。B D14.下列半径最大的微粒是 ( )
A. F B. Mg2+ C. Cl- D. Ca2+
15.A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是 ( )
A. 原子半径:A>B
B. 原子序数:A>B
C. 离子半径:A2+>B3+
D. 质量数:A>BCA C再见
1.以1~20号元素为例,了解元素原子核外电子的排布规律?2.掌握元素原子半径和主要化合价随原子序数的递增而呈现出的周期性变化规律。?
过程与方法:
1.学会归纳法、比较法。?2.培养抽象思维能力。
情感、态度与价值观:
养成勤于思考、勇于探究的科学品质。【教学重点】元素的原子核外电子排布、原子半径和
主要化合价随原子序数的递增而变化的规律。 【教学难点】原子核外电子的排布现代物质结构理论原子原子核带负电荷带正电荷不带电荷核外电子质子:中子:【思考】在多电子原子里,电子在核外是如何运动的?是杂乱无章地运动,还是有规律可循?【阅读】教材P13第1、2段,电子在核外如何排布,有哪些规律可循?一、原子核外电子的排布KL
MNOPQ1、电子总是尽先排布在能量较低的轨道。3、最外层电子不超过8个(K为最外层
不超过2个),次外层不超过18个,倒数
第三层不超过32个电子。以上规律是相互联系的,不能孤立地机械套用。 分层排布 【课堂练习】
1、掌握1至20号元素的原子结构示意图.写出O、Mg、Cl的原子结构示意图
2、总结1至18号原子结构的特殊性。
(1)最外层有1个电子的元素:
(2)最外层有2个电子的元素:H、Li、NaHe、Be、Mg(3)最外层电子数是次外层电子数2倍的元素:
(4)最外层电子数是次外层电子数3倍的元素:CO二、元素周期律 请阅读并比较表1-2中1~18号元素的有关数据,从中能找出什么规律?表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 最外层电子数1→2最外层电子数1→8最外层电子数1→8表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 原子半径 大→小原子半径 大→小表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4 →-1 → 0主要化合价:正价+1→+7,负价:-4 →-1→0思考并讨论:2 3+1→0大→小大→小主族元素的最高正化合价与最外层电子数有何关系?最高正价==
最外层电子数最低负化合价绝对值 = 8 – 最外层电子数 结论: 通过上面的讨论我们知道,随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈周期性的变化。【课堂练习】
3、下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
4.在1~18号元素中,除稀有气体元素外:
(1)原子半径最大的元素是 ,
(2)原子半径最小的元素是 。
BNaH1.下列说法中正确的是 ( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
【巩固训练】A 2.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、PAB3、比较Na、Mg原子半径的大小 ;
比较S、O原子半径的大小 。
4.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第四周期元素
B.R一定是ⅣA族元素
C.R最高正价氧化物化学式为RO2
D.R气态氢化物化学式为H2R
Na>MgS>OD5.下列半径最大的微粒是 ( )
A. F B. Mg 2+ C. Cl- D. Ca2+
6.主族元素X的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
(A)X的原子序数比Y的小
(B)X原子的最外层电子数比Y的大
(C)X的原子半径比Y的大
(D)X元素的最高正价比Y的小CCD 结论: 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?这是我们下一节课将要探讨的内容。 随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈周期性的变化。下课了!1.根据非金属单质与H2化合生成氢化物的难易或氢化物的稳定性程度。越容易与H2化合,则生成的氢化物越稳定,非金属性越强。
2.根据非金属元素最高价氧化物对应的水化物酸性强弱。酸性越强,则元素的非金属性越强。
3. 根据对应阴离子还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究:列表总结:NaOH
强碱Mg(OH)2
中强碱
Al(OH)3
两性
氢氧化物剧烈 迅速 BC1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na能从MgCl2的溶液中把Mg置换出来;
非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化。2.下列事实能说明非金属性Cl >S的是:
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,
S的最高正价为+6
AB3.下列递变规律不正确的是 ( )
A.Na.Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高C从元素周期律的发现
你想到了些什么? 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
先辈们对真理执着追求的精神是我们人类不尽的财富。
他们的追求除了其优秀的个人素质以外,真理本身那种理性的美,也给了他们人生以巨大的乐趣。
同学们的学习是辛苦的,又是幸福的,每一门学科中都隐含着无穷的美。能引起情感共鸣的诗歌、散文和音乐, 陶冶我们的情操;而化学学科中的新奇、和谐、简约,同样闪耀着美的光辉。结论一:随着原子序数的递增,原 子核外电子排布呈周期性 变化结论二:随着原子序数的递增,元 素的化合价周期性变化结论三:随着原子序数的递增,元 素的原子半径呈周期性变化现象: 镁与冷水反应缓慢,产生少量气泡,滴入酚酞试液后不变色。 反应式:Mg + 2H2O == Mg(OH)2 + H2结论:镁元素的金属性比钠弱△ 加热后镁与沸水反应较剧烈,产生较多气泡,溶液变为红色。讨论第三周期元素的性质递变现象: 镁与铝均能与盐酸反应产生气泡。但镁反应更剧烈。反应:Mg + 2HCl = MgCl2 + H2结论:镁元素的金属性比铝强2Al + 6HCl = 2AlCl3+ 3H2钠(Na)、镁(Mg)、铝(Al)金属性比较冷水、剧烈冷水、缓慢结论金属性:Na>Mg剧烈迅速结论金属性:Mg>Al强碱性中强碱两性氢氧化物结论金属性:Mg>Mg>Al结论:电子层数相同的原子,随着原子序数的增加金属性减弱。NaOHMg(OH)2Al(OH)3强碱中强碱两性氢氧化物与冷水剧烈反应与沸水反应;与酸剧烈反应与酸缓慢反应小结:金属性强弱判断依据:单质与水反应的难易程度
单质与酸反应的剧烈程度
最高价氧化物对应水化物的碱性强弱钠镁铝的金属性逐渐减弱 两性氢氧化物: 既能与酸起反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,叫做两性氢氧化物Al(OH)3制备:AlCl3+3NaOH=Al(OH)3↓+3NaCl与酸:Al(OH)3+3HCl=AlCl3+3H2O与碱:Al(OH)3+NaOH=NaAlO2+2H2O两性氧化物: 既能与酸起反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物(课本99页)与酸:Al2O3+6HCl=2AlCl3+3H2O与碱:Al2O3+2NaOH=2NaAlO2+H2O小结 钠与冷水反应,镁与沸水反应,铝不与水反应。 钠与酸反应很剧烈,镁与酸反应剧烈,铝与酸反应平缓 NaOH 是强碱,Mg(OH)2 是中强碱,Al(OH)3 是两性氢氧化物。金属性强弱顺序:Na > Mg > Al硅(Si)、磷(P)、硫(S)、氯(Cl)
非金属性的比较(课本15页表)SiPSCl高温H4SiO4
弱酸磷蒸气与氢气能反应H3PO4
中强酸须加热H2SO4
强酸光照或点燃爆炸HClO4
最强酸结论:电子层数相同的原子,随着原子序数的增加非金属性增强。
氢化物化学式元素14Si15P16S17Cl 非金属性:Si < P < S < Cl单质与氢气的化合条件氢化物的稳定性SiH4PH3H2SHCl高温下少量反应磷蒸气,困难加热反应光照或点燃很不稳定不稳定较不稳定稳定从氢化物看
最高价氧化物最高价氧化物的水化物元素14Si15P16S17ClSiO2P2O5SO3Cl2O7H2SiO3 H3PO4 H2SO4 HClO4硅 酸磷 酸硫 酸高氯酸极弱酸中强酸强 酸最强酸 非金属性:Si < P < S < Cl从最高价氧化物的水化物看 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释:电子层数相同核电荷数增多原子半径减小原子失电子能力逐渐减弱,得电子能力逐渐增强同周期元素 从左到右原子核对最外层电子的吸引力增强1、当电子层数及核电荷数均不同时,电子层数越多的,半径越大;如Na<K(层不同,层多,径大)
2、当电子层数相同时,核电荷数越大的,半径越小;如Na>Mg;Na+>Mg2+(层相同,核多,径小)
3、阴离子半径大于对应的原子半径;如Cl<Cl-
4、阳离子半径小于对应的原子半径;如Na> Na+原子半径和离子半径与核电荷数、
电子层数以及电子数的关系结论5、电子排布相同的离子,离子半径随着核电荷数的递增而减小。随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(K层电子数 1→2)原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 -4→-1(稀有气体元素为零)决定了归纳出引起了元素化学性质金属性非金属性变化BC1.下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,
Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na能从MgCl2的溶液中把Mg置换出来;
2.下列事实能说明非金属性Cl >S的是:
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,
S的最高正价为+6
AB3.下列有关元素周期律的叙述正确的( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化C 4.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P5.下列递变规律不正确的是 ( )
A.Na.Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高ABC 6.在目前发现的元素中,
除了氢元素以外,半径最小的是何种元素。
7.除了稀有气体元素以外,半径最大的是何种元素?氟元素钫(Fr)元素8.下列化合物中,阳离子与阴离子半径比最小的是( )(A) NaF (B) LiI (C) CsF (D) LiF阳离子半径:Li+ < Na+
(H,He)元素原子半径大→小元素化合价+1→+7
-4→-1→0元素金属性
与非金属性金属性减弱
非金属性增强呈现周期性变化 随着原子序数的递增,元素的性质呈现周期性变化 ,这叫做元素周期律。 元素的性质的周期性变化是元素原子的核外电子排布呈周期性变化的必然结果三、元素周期表和元素周期律的应用 1、元素的位、构、性三者之间的关系及其应用结构位置性质(1)结构决定位置:原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱(2)结构决定性质:
最外层电子数=主族元素的最高正价数
=8-负价数(3)位置反映性质:
同周期:从左到右,递变性 (4)同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:
分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图: 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强 ①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第6周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第2周期第ⅦA族(右上角)。 ②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。 2、元素的化合价与位置、结构的关系
(1)最高正价数=主族序数=最外层电子数 (2)最低负价数=主族序数 - 8
=最外层电子数 - 8元素周期律小结: (1)元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。 (2)可预测或推测元素的原子结构和性质 (3)在科学研究和生产上也有广泛的应用
见课本P.17 (4)在哲学方面,元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,有力地论证了事物变化的量变引起质变的规律性。 3、元素周期律的应用和意义练习1.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物是 ( )
A.NaOH B.Al(OH)3
C.Ca(OH)2 D.RbOH
2.下列物质中,既能与强酸又能与强碱反应的是( )
①Na2CO3②NaHCO3 ③Al2O3 ④Al(OH)3
A.①②③④ B.①②③
C.①②④ D.②③④BD3.下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
4. A.B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是 ( )
A.n+4 B.n+6 C.n+8 D.n+10
5.下列叙述中,肯定a金属比b金属活泼性强的是( )
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能BAD6. A、B、C三种元素的原子具有相同的电子层数,它们相同物质的量的原子获得相同物质的量的电子时释放出的能量是A>C>B,则它们原子序数大小顺序是( )
A.B>C>A B.A>B>C
C.BC D.A>C>B
7.下列各组物质的性质变化正确的是 ( )
A.酸性HClO4>HNO3>H3PO4>H2SiO4
B.稳定性H2S>HCl>HBr>HI
C.熔点Pb>K>Na>Li
D.溶解性NaHCO3>Na2CO3>NaOH DA8.原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________;
(2)与水反应最剧烈的非金属单质是___________;
(3)在室温下有颜色的气体单质是_____________;
(4)在空气中容易自燃的单质名称是________;
(5)除稀有气体外,原子半径最大的元素是______;
(6)原子半径最小的元素是_____________;
(7)气态氢化物水溶液呈碱性的元素是_________;
(8)气态氢化物最稳定的化学式是_____________;
(9)最高价氧化物对应水化物的酸性最强的元素是_____________。
9。在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为_________________________________。KF2F2 Ci2白磷NaHNHF ClH
A.A的氧化性小于B
B.B-的还原性大于A-
C.A-的还原性大于B-
D.A的氧化性大于B原子序数 周期性 获得电子时,要释放出能量,放出能量的越多,说明其越容易得电子,A的非金属性越强。B D14.下列半径最大的微粒是 ( )
A. F B. Mg2+ C. Cl- D. Ca2+
15.A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是 ( )
A. 原子半径:A>B
B. 原子序数:A>B
C. 离子半径:A2+>B3+
D. 质量数:A>BCA C再见
