人教高中化学选修五3.3第一课时羧酸--酯课件(共38张PPT)
文档属性
| 名称 | 人教高中化学选修五3.3第一课时羧酸--酯课件(共38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 997.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-14 00:00:00 | ||
图片预览











文档简介
课件38张PPT。第三章 烃的含氧衍生物第三节 羧酸 酯第一课时 羧酸一、羧酸1、定义:由烃基与羧基相连构成的有机化合物。2、分类:烃基不同羧基数目芳香酸脂肪酸一元羧酸二元羧酸多元羧酸饱和一元羧酸通式:CnH2n+1COOH 、CnH2nO23、自然界和日常生活中的有机酸资料卡片1、乙酸的物理性质【思考与交流】在室温较低时,无水乙酸就会凝结成像 冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。 二、乙酸结构结构式:电子式:分子式:C2H4O2结构简式:CH3COOH官能团:-COOH核磁共振氢谱图如何???日常生活中,为什么可以用醋除去水垢?
(水垢的主要成分包括CaCO3)
说明乙酸什么性质?考考你科
学
探
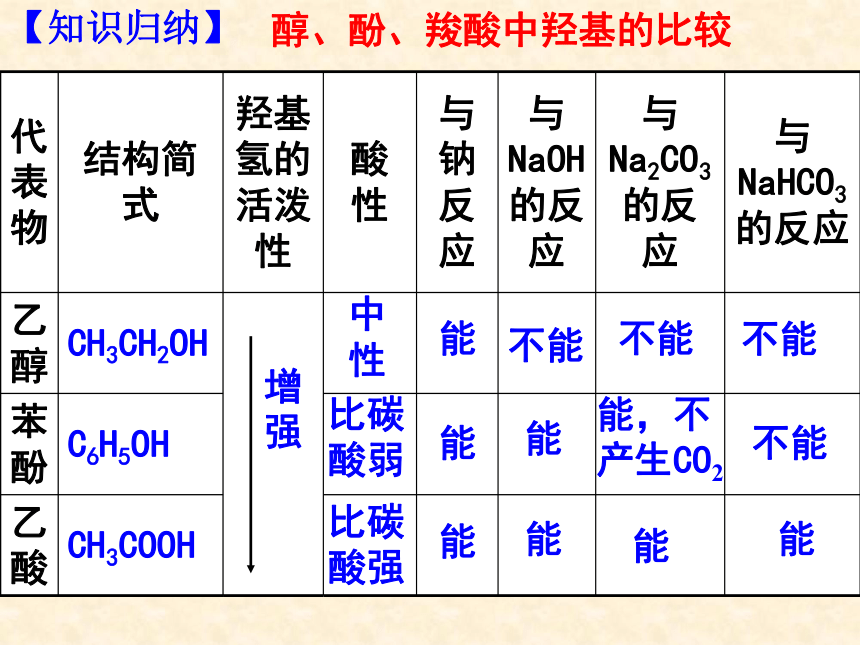
究酸性:乙酸>碳酸>苯酚2CH3COOH + Na2CO3 = 2CH3COONa +H2O+CO2↑2CH3COOH + Mg = (CH3COO)2Mg+H2↑CH3COOH + NaOH = CH3COONa+ H2OE、与某些盐反应: A、使紫色石蕊试液变色:B、与活泼金属反应:D、与碱反应:C、与碱性氧化物反应:2CH3COOH+Na2O=2CH3COONa+2H2O3)乙酸的化学性质(1) 弱酸性(酸的通性)醇、酚、羧酸中羟基的比较比碳酸弱比碳酸强能能能能能不能不能不能能,不
产生CO2不能能 能增 强中性【知识归纳】碎瓷片
乙醇 3mL
浓硫酸 2mL
乙酸 2mL
饱和的Na2CO3溶液(2)乙酸的酯化反应(防止暴沸)反应后饱和Na2CO3溶液上层有什么现象?饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。【知识回顾】1. 试管倾斜加热的目的是什么?
2.浓硫酸的作用是什么?
3.得到的反应产物是否纯净?主要杂质有哪些?
4.饱和Na2CO3溶液有什么作用?
5. 为什么导管不插入饱和Na2CO3溶液中?有无其它防倒吸的方法?催化剂,吸水剂不纯净;乙酸、乙醇① 中和乙酸,消除乙酸气味对酯气味的影响,以便闻到乙酸乙酯的气味. ② 溶解乙醇。
③ 冷凝酯蒸气、降低酯在水中的溶解度,以便使酯分层析出。防止受热不匀发生倒吸增大受热面积其它放倒吸方法思考与交流:课本P631)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。根据化学平衡原理,提高乙酸乙酯产率的措施有:3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。【科学探究2】乙酸乙酯的酯化过程 ——酯化反应的脱水方式可能一可能二同位素示踪法酯化反应:酸和醇起作用,生成酯和水的反应。
酯化反应的本质:酸脱羟基、醇脱羟基氢。 实验验证C2、 若乙酸分子中的氧都是18O,乙醇分
子中的氧都是16O,二者在浓H2SO4作用
下发生反应,一段时间后,分子中含有
18O的物质有( )A 1种 B 2种 C 3 种 D 4种生成物中水的相对分子质量为 。201、 酯化反应属于( ).
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应D【知识应用】C四类重要的羧酸1、甲酸——俗称蚁酸结构特点:既有羧基又有醛基化学性质醛基羧基氧化反应酯化反应还原反应银镜反应、碱性新制Cu(OH)2与H2加成酸性酸的通性与醇发生酯化反应HCOOCH2CH3 + H2O甲酸乙酯HCOOH + Na → 2 2 2 HCOONa + H2↑2、乙二酸——俗称草酸+ 2H2O 结构特点:分子内有两个羧基2 HCOOH + Cu(OH)2 → Cu(HCOO)2 + 2H2O草酸,是最简单的饱和二元羧酸,
是二元羧酸中酸性最强的,它具有一些特殊的
化学性质。
能使酸性高锰酸钾溶液褪色、可作漂白剂。② 饱和一元脂肪酸酸性随烃基碳原子数的增加而逐渐减弱。 酸性: ① 常见羧酸酸性强弱顺序:乙二酸 > 甲酸 > 乙酸 > 丙酸3、高级脂肪酸(1)酸性化学性质(2)酯化反应(3)油酸加成 4.苯甲酸 C6H5COOH (安息香酸)酸性: HOOC-COOH > HCOOH > C6H5COOH > CH3COOH 。二 酯1 定 义: 酸和醇发生反应生成的一类有机化合物。
2 酯的命名——“某酸某酯”
(1) HCOCH2CH3
(2) CH3CH2O—NO2
(3) (4)
甲酸乙酯硝酸乙酯二乙酸乙二酯乙二酸二甲酯酯就是依据水解后生成的酸和醇的名称来命名的请说出下列酯的名称: HCOCH3甲酸甲酯CH3CH2COC2H5丙酸乙酯乙二酸乙二酯CH3CH2OC
CH3CH2OC乙二酸二乙酯 3 分 类:
① 根据酸的不同分为:有机酸酯和无机酸酯。
②或根据分子中酯基的数目,分为:一元酯、二元酯(如乙二酸二乙酯)、多元酯(如油脂)。
③ 根据酯的形状不同分为:链状酯和环状酯;
④ 根据酯中是否含有苯环分为:脂肪酯和芳香酯;
4 饱和一元酸酯
① 通式:相同碳原子数的羧酸、酯、烯二醇、环二醇、羟基酮和羟基醛互为同分异构体 如:CH3COH与HCOCH3 、HOCH2CHO
R-C-O-R’② 物理性质
低级酯是具有芳香气味的液体。密度比水小。难溶于水,易溶于乙醇和乙醚等有机溶剂。
酯广泛存在于自然界中。例如,乙酸乙酯、乙酸异戊酯存在于草莓、香蕉、梨等水果中,乙酸丁酯和异戊酸异戊酯存在于成熟的香蕉中,苯甲酸甲酯存在于丁香油中,等等。
自然界中的有机酯
含有:丁酸乙酯
含有:戊酸戊酯
含有:乙酸异戊酯
③化学性质a 燃烧反应:酯也可以完全氧化生成 CO2 和 H2O ,但不能使 KMnO4 酸性溶液褪色。
CxHyO2 + O2 x CO2+ H2O
b 酯的合成 Ⅰ 有机酸有醇反应生成酯
CH3COH+CH3CH2OH CH3COCH2CH3+ H2O Ⅱ 无机含氧酸与醇
CH3CH2O﹣H+HO﹣NO2→CH3CH2ONO2+H2O
硝酸乙酯
注意:无氧酸与醇之间也能反应,如
CH3CH2OH+HCl CH3CH2Cl + H2O
但它不属于酯化反应,因生成物为卤代烃,并非酯类化合物。所以,只有无机含氧酸才能与醇发生酯化反应,不含氧的酸如HBr不能发生酯化反应,只能和醇发生取代反应。 Ⅲ 有机酸酐与酚
Ⅳ 生成环状酯
HOCH2CH2CH2COOH + H2O
HOCH2CH2CH2CH2COOH + H2O
除了上面可以生成环状酯外,多元醇和多元羧酸也可生成环状酯
COOH HOCH2
COOH HOCH2
注意:环状酯和环烃一样,五元环和六元环最稳定,其他的由于环的张力而不稳定。++2H2O c 水解反应
酸性条件下的水解反应:
RCOOR′+ H2O RCOOH + R′OH
碱性条件下的水解反应:
RCOOR′+NaOH → RCOONa + R′OH△ 注意 酯在酸存在的条件下, 水解生成酸和醇。
在有碱存在时, 酯的水解趋近于完全。 (用化学平衡知识解释) 酯的水解和酸与醇的酯化反应是可逆的。 练习1mol下列物质在NaOH溶液中生成什么物质?
前者生成CH3CHCONa和CH3CHCH2OH
后者生成HCONa和CH3OHCH3 CH3 一般的酯在碱性条件下水解时,NaOH
的量应大于酯物质的量的1倍,这样才能使
酯水解完全 ;但是酚酯水解时由于产生苯
酚, 也能与NaOH 反应,所以, NaOH 的用
量应 大于酯物质的量的2倍,才能使酯水解
完全。 例题 1mol下列有机物在 NaOH 溶液中完全水解,所需 NaOH 的量是多少?
CH3COCH3 水解后生成乙酸和甲醇,只有乙酸和 NaOH 反应,所以需要 1mol NaOH 水解后生成苯酚和丙酸,所以需要 2mol NaOH ; 同理 则可知第三个需要 3mol NaOH
小结
(水垢的主要成分包括CaCO3)
说明乙酸什么性质?考考你科
学
探
究酸性:乙酸>碳酸>苯酚2CH3COOH + Na2CO3 = 2CH3COONa +H2O+CO2↑2CH3COOH + Mg = (CH3COO)2Mg+H2↑CH3COOH + NaOH = CH3COONa+ H2OE、与某些盐反应: A、使紫色石蕊试液变色:B、与活泼金属反应:D、与碱反应:C、与碱性氧化物反应:2CH3COOH+Na2O=2CH3COONa+2H2O3)乙酸的化学性质(1) 弱酸性(酸的通性)醇、酚、羧酸中羟基的比较比碳酸弱比碳酸强能能能能能不能不能不能能,不
产生CO2不能能 能增 强中性【知识归纳】碎瓷片
乙醇 3mL
浓硫酸 2mL
乙酸 2mL
饱和的Na2CO3溶液(2)乙酸的酯化反应(防止暴沸)反应后饱和Na2CO3溶液上层有什么现象?饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。【知识回顾】1. 试管倾斜加热的目的是什么?
2.浓硫酸的作用是什么?
3.得到的反应产物是否纯净?主要杂质有哪些?
4.饱和Na2CO3溶液有什么作用?
5. 为什么导管不插入饱和Na2CO3溶液中?有无其它防倒吸的方法?催化剂,吸水剂不纯净;乙酸、乙醇① 中和乙酸,消除乙酸气味对酯气味的影响,以便闻到乙酸乙酯的气味. ② 溶解乙醇。
③ 冷凝酯蒸气、降低酯在水中的溶解度,以便使酯分层析出。防止受热不匀发生倒吸增大受热面积其它放倒吸方法思考与交流:课本P631)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。根据化学平衡原理,提高乙酸乙酯产率的措施有:3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。【科学探究2】乙酸乙酯的酯化过程 ——酯化反应的脱水方式可能一可能二同位素示踪法酯化反应:酸和醇起作用,生成酯和水的反应。
酯化反应的本质:酸脱羟基、醇脱羟基氢。 实验验证C2、 若乙酸分子中的氧都是18O,乙醇分
子中的氧都是16O,二者在浓H2SO4作用
下发生反应,一段时间后,分子中含有
18O的物质有( )A 1种 B 2种 C 3 种 D 4种生成物中水的相对分子质量为 。201、 酯化反应属于( ).
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应D【知识应用】C四类重要的羧酸1、甲酸——俗称蚁酸结构特点:既有羧基又有醛基化学性质醛基羧基氧化反应酯化反应还原反应银镜反应、碱性新制Cu(OH)2与H2加成酸性酸的通性与醇发生酯化反应HCOOCH2CH3 + H2O甲酸乙酯HCOOH + Na → 2 2 2 HCOONa + H2↑2、乙二酸——俗称草酸+ 2H2O 结构特点:分子内有两个羧基2 HCOOH + Cu(OH)2 → Cu(HCOO)2 + 2H2O草酸,是最简单的饱和二元羧酸,
是二元羧酸中酸性最强的,它具有一些特殊的
化学性质。
能使酸性高锰酸钾溶液褪色、可作漂白剂。② 饱和一元脂肪酸酸性随烃基碳原子数的增加而逐渐减弱。 酸性: ① 常见羧酸酸性强弱顺序:乙二酸 > 甲酸 > 乙酸 > 丙酸3、高级脂肪酸(1)酸性化学性质(2)酯化反应(3)油酸加成 4.苯甲酸 C6H5COOH (安息香酸)酸性: HOOC-COOH > HCOOH > C6H5COOH > CH3COOH 。二 酯1 定 义: 酸和醇发生反应生成的一类有机化合物。
2 酯的命名——“某酸某酯”
(1) HCOCH2CH3
(2) CH3CH2O—NO2
(3) (4)
甲酸乙酯硝酸乙酯二乙酸乙二酯乙二酸二甲酯酯就是依据水解后生成的酸和醇的名称来命名的请说出下列酯的名称: HCOCH3甲酸甲酯CH3CH2COC2H5丙酸乙酯乙二酸乙二酯CH3CH2OC
CH3CH2OC乙二酸二乙酯 3 分 类:
① 根据酸的不同分为:有机酸酯和无机酸酯。
②或根据分子中酯基的数目,分为:一元酯、二元酯(如乙二酸二乙酯)、多元酯(如油脂)。
③ 根据酯的形状不同分为:链状酯和环状酯;
④ 根据酯中是否含有苯环分为:脂肪酯和芳香酯;
4 饱和一元酸酯
① 通式:相同碳原子数的羧酸、酯、烯二醇、环二醇、羟基酮和羟基醛互为同分异构体 如:CH3COH与HCOCH3 、HOCH2CHO
R-C-O-R’② 物理性质
低级酯是具有芳香气味的液体。密度比水小。难溶于水,易溶于乙醇和乙醚等有机溶剂。
酯广泛存在于自然界中。例如,乙酸乙酯、乙酸异戊酯存在于草莓、香蕉、梨等水果中,乙酸丁酯和异戊酸异戊酯存在于成熟的香蕉中,苯甲酸甲酯存在于丁香油中,等等。
自然界中的有机酯
含有:丁酸乙酯
含有:戊酸戊酯
含有:乙酸异戊酯
③化学性质a 燃烧反应:酯也可以完全氧化生成 CO2 和 H2O ,但不能使 KMnO4 酸性溶液褪色。
CxHyO2 + O2 x CO2+ H2O
b 酯的合成 Ⅰ 有机酸有醇反应生成酯
CH3COH+CH3CH2OH CH3COCH2CH3+ H2O Ⅱ 无机含氧酸与醇
CH3CH2O﹣H+HO﹣NO2→CH3CH2ONO2+H2O
硝酸乙酯
注意:无氧酸与醇之间也能反应,如
CH3CH2OH+HCl CH3CH2Cl + H2O
但它不属于酯化反应,因生成物为卤代烃,并非酯类化合物。所以,只有无机含氧酸才能与醇发生酯化反应,不含氧的酸如HBr不能发生酯化反应,只能和醇发生取代反应。 Ⅲ 有机酸酐与酚
Ⅳ 生成环状酯
HOCH2CH2CH2COOH + H2O
HOCH2CH2CH2CH2COOH + H2O
除了上面可以生成环状酯外,多元醇和多元羧酸也可生成环状酯
COOH HOCH2
COOH HOCH2
注意:环状酯和环烃一样,五元环和六元环最稳定,其他的由于环的张力而不稳定。++2H2O c 水解反应
酸性条件下的水解反应:
RCOOR′+ H2O RCOOH + R′OH
碱性条件下的水解反应:
RCOOR′+NaOH → RCOONa + R′OH△ 注意 酯在酸存在的条件下, 水解生成酸和醇。
在有碱存在时, 酯的水解趋近于完全。 (用化学平衡知识解释) 酯的水解和酸与醇的酯化反应是可逆的。 练习1mol下列物质在NaOH溶液中生成什么物质?
前者生成CH3CHCONa和CH3CHCH2OH
后者生成HCONa和CH3OHCH3 CH3 一般的酯在碱性条件下水解时,NaOH
的量应大于酯物质的量的1倍,这样才能使
酯水解完全 ;但是酚酯水解时由于产生苯
酚, 也能与NaOH 反应,所以, NaOH 的用
量应 大于酯物质的量的2倍,才能使酯水解
完全。 例题 1mol下列有机物在 NaOH 溶液中完全水解,所需 NaOH 的量是多少?
CH3COCH3 水解后生成乙酸和甲醇,只有乙酸和 NaOH 反应,所以需要 1mol NaOH 水解后生成苯酚和丙酸,所以需要 2mol NaOH ; 同理 则可知第三个需要 3mol NaOH
小结
