北京课改版九下化学 11.2几种常见的酸 课件(29张ppt)
文档属性
| 名称 | 北京课改版九下化学 11.2几种常见的酸 课件(29张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 614.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-14 00:00:00 | ||
图片预览








文档简介
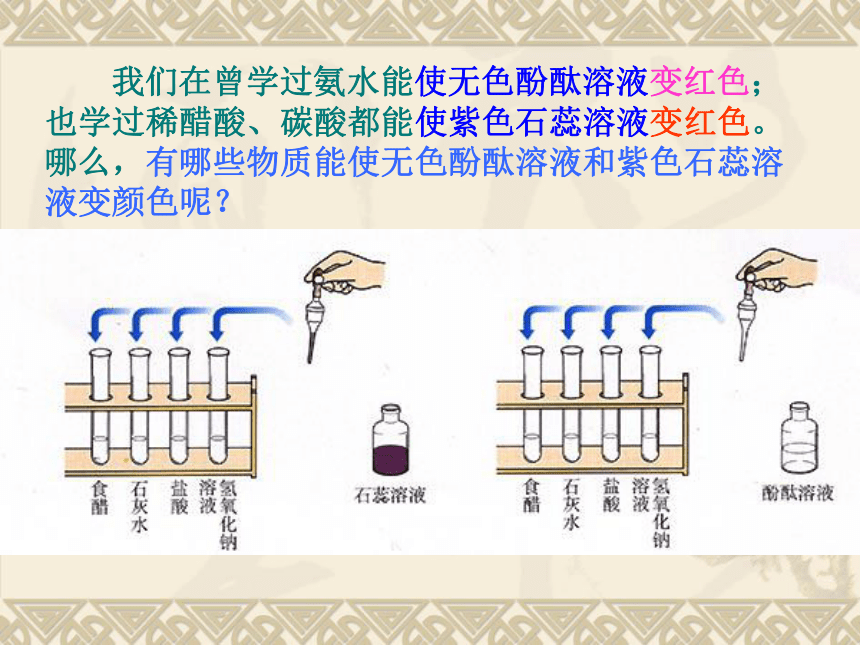
课件29张PPT。 “酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。 几种常见的酸 1.常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、还有磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)等。 2.常见的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氢氧化铜[Cu(OH)2]、氨水(NH3·H2O)等。 从名称上看它们最后一个字都是“酸”,从结构上看都含有氢元素。 从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(OH) 我们在曾学过氨水能使无色酚酞溶液变红色;也学过稀醋酸、碳酸都能使紫色石蕊溶液变红色。哪么,有哪些物质能使无色酚酞溶液和紫色石蕊溶液变颜色呢?探究实验:不变化 无色不变化 无色
石蕊溶液遇酸变红,遇碱变蓝;酚酞溶液遇酸不变色,遇碱变红。
遇到酸和碱溶液,本身可显示①
的物质,叫酸碱指示剂。简称指示剂。常见的酸碱指示剂有② 、 ③ 。
知识点1 酸碱指示剂不同颜色紫色石蕊酚酞2.实验室有蒸馏水和稀硫酸两瓶无色溶液,你怎样区别?拓展训练1.下列物质既能使石蕊试液变蓝色,又能使酚酞变红的是 ( )
A.稀硫酸溶液 B.水
C.盐酸 D.氢氧化钠溶液D分别取少许上述两种试剂,然后分别加入等量的紫色石蕊,如果不变色,则原试剂是蒸馏水;如果变红,则原试剂是稀硫酸。特别说明--------笔记 是指示剂在变色,不是酸溶液和碱溶液在变色。比如说石蕊溶液使盐酸变红色的说法是错误的,而只能说盐酸使紫色石蕊溶液变成红色。
讨论:上述实验结果,哪些不可以作酸碱指示剂?讨论:上述实验结果,哪些可以作酸碱指示剂?金盈菊花瓣汁,因为在酸、碱溶液中没有变色。紫色菊花瓣汁,三角梅花瓣汁、紫色包菜叶汁。知识点2 常见的酸的物理性质和用途浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色;打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法无色液体无色粘稠液体白雾(挥发性)无现象有刺激性气味无气味盐酸和硫酸的物理性质 浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。完成实验得出浓硫酸的性质写过字的地方变黑了蘸有浓硫酸的一端变黑了蘸有浓硫酸的地方变黑了、布烂了。浓硫酸的性质1.我们可以用浓硫酸来干燥某些气体,它体现了浓硫酸的什么性质?2.如何稀释浓硫酸?注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里浓硫酸具有吸收水分的性质,即吸水性。B课堂练习:
下列说法错误的是( )
A.浓盐酸放置一段时间后,溶液的质量会减少
B.浓盐酸在空气中会冒白烟
C.浓硫酸敞口放置一段时间后,溶液的质量会增加
D.浓硫酸溶于水时会放出大量的热应该是冒白雾 酸的化学性质一、酸与酸碱指示剂的反应:变红变红不变色(无色)不变色(无色)结论: 酸能使紫色石蕊试液变红;
无色酚酞试液遇酸不变色(仍为无色)使用点滴板进行实验的优点:①只需要2-3滴液体试剂,可以节约药品②反应现象更明显。二、酸的化学性质—酸与金属的反应Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Mg+H2SO4=MgSO4+H2↑2Al+6HCl=2AlCl3+3H2 ↑2Al+3H2SO4=Al2(S04)3+3H2 ↑金属活动性排在H前面的金属可以和酸反应,但是也有例外:如铁、铝不能和浓硫酸反应,因此可以用铁或铝的容器来盛装浓硫酸;碳酸是一种比较弱的酸,所以它和金属反应的速度非常慢,即使是象镁这样活泼的金属。-----这是高中的知识。探究实验1、将几根生锈的铁钉分别放入到盛有稀盐酸和稀硫酸的试管中,放置一段时间,观察现象。2、向两根试管中分别加入少量的氧化铜粉末,然后分别滴入适量的水和稀硫酸,然后再加热以加快反应的速度。观察现象。三、酸与金属氧化物的反应Fe2O3+6HCl=2FeCl3+3H2O铁钉表面的铁锈被除去,溶液变为黄色铁钉表面的铁锈被除去,溶液变为黄色Fe2O3+3H2SO4=Fe2(SO4)3+3H2O黑色的氧化铜慢慢消失,溶液变成蓝色。CuO+H2SO4=CuSO4+H20酸和金属氧化物反应的本质微观本质:酸中的两个氢原子和氧化物中的一个氧原子结合生成一个水分子,金属离子和酸根离子结合生成盐。酸 + 金属氧化物 === 盐 + 水写出下列化学方程式1、MgO+2HCl=MgCl2+H2O2、ZnO+H2SO4=ZnSO4+H2O3、CaO+2HCl=CaCl2+H204、Na20+H2SO4=Na2SO4+H2O5、K2O+2HCl=2KCl+H206、Al2O3+3H2SO4=Al2(SO4)3+3H2O这样类型的反应有三十多个,我们一定要先掌握它们反应的微观本质,方能熟练书写此类反应的化学方程式。即先按照两根氢原子结合一个氧原子的规则书写水分子,然后再写盐的化学式。思考题1、清除铁锈时,能把能把铁钉长时间浸泡在酸中?为什么?答:不能。如果这样做的话,酸除掉铁锈后,剩余的铁就会和酸继续反应。2、回忆铝片和稀盐酸反应的现象,并解释为什么?答:一开始铝片的表面没有气泡冒出,一段时间后,有少量气泡冒出,后来反应越来越剧烈,放出大量的热,好像金属镁和盐酸反应时的现象差不多。将生锈的铁钉加入稀盐酸或稀硫酸中。Fe2O3+6HCl==2FeCl3+3H2OFe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:铁钉表面锈被除去,溶液由无色变为黄色。现象:又看到铁钉表面产生气泡。Fe+2HCl==FeCl2+H2↑Fe+H2SO4==FeSO4+H2↑解释原因-------笔记 一开始无明显现象是因为铝的表面有一层致密的氧化铝薄膜,里层的铝接触不到盐酸;后来氧化铝慢慢与稀盐酸反应,里层的铝与稀盐酸反应,当氧化铝全部除掉后,反应就非常的剧烈了--------因为铝是一种比较活泼的金属巩固练习:
3.下列物质敞口放一段时间,质量会减少的是 ( )
A.浓硫酸 B.大理石
C.稀硫酸 D.浓盐酸 3.下列物质长期露置在空气中,因发生化学变化而使溶液质量减少的是 ( )
A.浓硫酸 B.稀硫酸
C.浓盐酸 D.石灰水 DD巩固练习:
6.下列实验操作正确的是 ( )
A.把鼻孔凑到容器口闻气体的气味
B.做完实验后,将剩余的试剂倒回原试剂瓶
C.稀释浓硫酸时,将水沿器壁慢慢地倒入浓硫酸中,并不断搅动
D.熄灭酒精灯,用灯帽盖灭
8.下列关于物质的用途的叙述不正确的是( )
A.盐酸可用来除铁锈
B.稀硫酸在实验室里常用作干燥剂
C.硫酸可用于精炼石油和金属除锈
D.盐酸是重要化工产品 ×CB×巩固练习:
10.下列叙述错误的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
11.下列物质可以利用金属和稀盐酸直接制取的是( )
A.MgCl2 B.FeCl2 C.CuCl2 D.FeCl3×A铜与盐酸不反应生成FeCl2AB巩固练习:
12.某同学不慎将浓硫酸沾到皮肤上,正确的做法是 ( )
A.先用较多的水冲洗 B.先用氢氧化钠溶液冲洗
C.后涂上3%~5%的碳酸氢钠溶液
D.不作任何处理 AC13.将锈铁钉放入稀盐酸中看到哪些现象?并写出化学方程式。先看到铁锈被除去,溶液变成黄色;再看到铁钉表面产生气泡。Fe2O3+6HCl==2FeCl3+3H2OFe+2HCl==FeCl2+H2↑【小结】酸的化学性质
1、跟指示剂的反应-----酸是紫色石蕊溶液变红,不使无色酚酞变色。
2、跟金属的反应-------金属 + 酸======== 盐 + 氢气
3、跟金属氧化物的反应:
金属氧化物 + 酸=======盐 + 水
酸的化学性质
石蕊溶液遇酸变红,遇碱变蓝;酚酞溶液遇酸不变色,遇碱变红。
遇到酸和碱溶液,本身可显示①
的物质,叫酸碱指示剂。简称指示剂。常见的酸碱指示剂有② 、 ③ 。
知识点1 酸碱指示剂不同颜色紫色石蕊酚酞2.实验室有蒸馏水和稀硫酸两瓶无色溶液,你怎样区别?拓展训练1.下列物质既能使石蕊试液变蓝色,又能使酚酞变红的是 ( )
A.稀硫酸溶液 B.水
C.盐酸 D.氢氧化钠溶液D分别取少许上述两种试剂,然后分别加入等量的紫色石蕊,如果不变色,则原试剂是蒸馏水;如果变红,则原试剂是稀硫酸。特别说明--------笔记 是指示剂在变色,不是酸溶液和碱溶液在变色。比如说石蕊溶液使盐酸变红色的说法是错误的,而只能说盐酸使紫色石蕊溶液变成红色。
讨论:上述实验结果,哪些不可以作酸碱指示剂?讨论:上述实验结果,哪些可以作酸碱指示剂?金盈菊花瓣汁,因为在酸、碱溶液中没有变色。紫色菊花瓣汁,三角梅花瓣汁、紫色包菜叶汁。知识点2 常见的酸的物理性质和用途浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色;打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法无色液体无色粘稠液体白雾(挥发性)无现象有刺激性气味无气味盐酸和硫酸的物理性质 浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。完成实验得出浓硫酸的性质写过字的地方变黑了蘸有浓硫酸的一端变黑了蘸有浓硫酸的地方变黑了、布烂了。浓硫酸的性质1.我们可以用浓硫酸来干燥某些气体,它体现了浓硫酸的什么性质?2.如何稀释浓硫酸?注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里浓硫酸具有吸收水分的性质,即吸水性。B课堂练习:
下列说法错误的是( )
A.浓盐酸放置一段时间后,溶液的质量会减少
B.浓盐酸在空气中会冒白烟
C.浓硫酸敞口放置一段时间后,溶液的质量会增加
D.浓硫酸溶于水时会放出大量的热应该是冒白雾 酸的化学性质一、酸与酸碱指示剂的反应:变红变红不变色(无色)不变色(无色)结论: 酸能使紫色石蕊试液变红;
无色酚酞试液遇酸不变色(仍为无色)使用点滴板进行实验的优点:①只需要2-3滴液体试剂,可以节约药品②反应现象更明显。二、酸的化学性质—酸与金属的反应Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Mg+H2SO4=MgSO4+H2↑2Al+6HCl=2AlCl3+3H2 ↑2Al+3H2SO4=Al2(S04)3+3H2 ↑金属活动性排在H前面的金属可以和酸反应,但是也有例外:如铁、铝不能和浓硫酸反应,因此可以用铁或铝的容器来盛装浓硫酸;碳酸是一种比较弱的酸,所以它和金属反应的速度非常慢,即使是象镁这样活泼的金属。-----这是高中的知识。探究实验1、将几根生锈的铁钉分别放入到盛有稀盐酸和稀硫酸的试管中,放置一段时间,观察现象。2、向两根试管中分别加入少量的氧化铜粉末,然后分别滴入适量的水和稀硫酸,然后再加热以加快反应的速度。观察现象。三、酸与金属氧化物的反应Fe2O3+6HCl=2FeCl3+3H2O铁钉表面的铁锈被除去,溶液变为黄色铁钉表面的铁锈被除去,溶液变为黄色Fe2O3+3H2SO4=Fe2(SO4)3+3H2O黑色的氧化铜慢慢消失,溶液变成蓝色。CuO+H2SO4=CuSO4+H20酸和金属氧化物反应的本质微观本质:酸中的两个氢原子和氧化物中的一个氧原子结合生成一个水分子,金属离子和酸根离子结合生成盐。酸 + 金属氧化物 === 盐 + 水写出下列化学方程式1、MgO+2HCl=MgCl2+H2O2、ZnO+H2SO4=ZnSO4+H2O3、CaO+2HCl=CaCl2+H204、Na20+H2SO4=Na2SO4+H2O5、K2O+2HCl=2KCl+H206、Al2O3+3H2SO4=Al2(SO4)3+3H2O这样类型的反应有三十多个,我们一定要先掌握它们反应的微观本质,方能熟练书写此类反应的化学方程式。即先按照两根氢原子结合一个氧原子的规则书写水分子,然后再写盐的化学式。思考题1、清除铁锈时,能把能把铁钉长时间浸泡在酸中?为什么?答:不能。如果这样做的话,酸除掉铁锈后,剩余的铁就会和酸继续反应。2、回忆铝片和稀盐酸反应的现象,并解释为什么?答:一开始铝片的表面没有气泡冒出,一段时间后,有少量气泡冒出,后来反应越来越剧烈,放出大量的热,好像金属镁和盐酸反应时的现象差不多。将生锈的铁钉加入稀盐酸或稀硫酸中。Fe2O3+6HCl==2FeCl3+3H2OFe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:铁钉表面锈被除去,溶液由无色变为黄色。现象:又看到铁钉表面产生气泡。Fe+2HCl==FeCl2+H2↑Fe+H2SO4==FeSO4+H2↑解释原因-------笔记 一开始无明显现象是因为铝的表面有一层致密的氧化铝薄膜,里层的铝接触不到盐酸;后来氧化铝慢慢与稀盐酸反应,里层的铝与稀盐酸反应,当氧化铝全部除掉后,反应就非常的剧烈了--------因为铝是一种比较活泼的金属巩固练习:
3.下列物质敞口放一段时间,质量会减少的是 ( )
A.浓硫酸 B.大理石
C.稀硫酸 D.浓盐酸 3.下列物质长期露置在空气中,因发生化学变化而使溶液质量减少的是 ( )
A.浓硫酸 B.稀硫酸
C.浓盐酸 D.石灰水 DD巩固练习:
6.下列实验操作正确的是 ( )
A.把鼻孔凑到容器口闻气体的气味
B.做完实验后,将剩余的试剂倒回原试剂瓶
C.稀释浓硫酸时,将水沿器壁慢慢地倒入浓硫酸中,并不断搅动
D.熄灭酒精灯,用灯帽盖灭
8.下列关于物质的用途的叙述不正确的是( )
A.盐酸可用来除铁锈
B.稀硫酸在实验室里常用作干燥剂
C.硫酸可用于精炼石油和金属除锈
D.盐酸是重要化工产品 ×CB×巩固练习:
10.下列叙述错误的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
11.下列物质可以利用金属和稀盐酸直接制取的是( )
A.MgCl2 B.FeCl2 C.CuCl2 D.FeCl3×A铜与盐酸不反应生成FeCl2AB巩固练习:
12.某同学不慎将浓硫酸沾到皮肤上,正确的做法是 ( )
A.先用较多的水冲洗 B.先用氢氧化钠溶液冲洗
C.后涂上3%~5%的碳酸氢钠溶液
D.不作任何处理 AC13.将锈铁钉放入稀盐酸中看到哪些现象?并写出化学方程式。先看到铁锈被除去,溶液变成黄色;再看到铁钉表面产生气泡。Fe2O3+6HCl==2FeCl3+3H2OFe+2HCl==FeCl2+H2↑【小结】酸的化学性质
1、跟指示剂的反应-----酸是紫色石蕊溶液变红,不使无色酚酞变色。
2、跟金属的反应-------金属 + 酸======== 盐 + 氢气
3、跟金属氧化物的反应:
金属氧化物 + 酸=======盐 + 水
酸的化学性质
