人教版高中化学选修五3.3羧酸 课件 (共69张PPT)
文档属性
| 名称 | 人教版高中化学选修五3.3羧酸 课件 (共69张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-15 19:50:48 | ||
图片预览









文档简介
课件69张PPT。课题: 羧酸普通高中课程标准实验教科书 化学(选修)1、了解羧酸的结构特点、主要化学性质及从羧酸到醇、酯的转化。
2、能举例说明羧基与羰基、羟基性质的区别,并进一步体会官能团之间的相互作用对有机化合物性质的影响。 重点、难点: 羧酸的化学性质教学目标自然界和日常生活中的有机酸资料卡片苹果酸一、羧酸概述
1、定义:分子由烃基(或氢原子)和羧基相
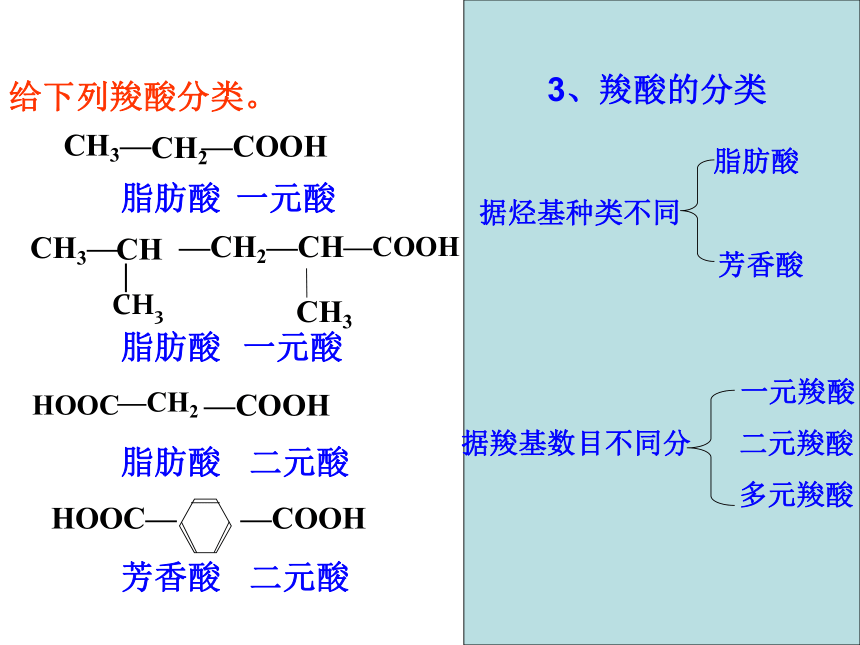
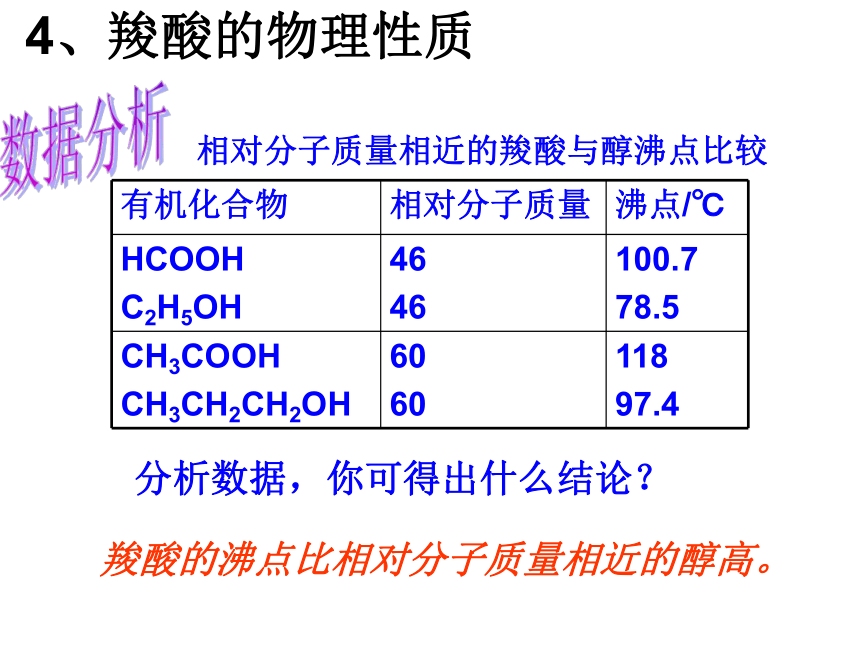
连组成的有机化合物叫羧酸。 官能团:(或—COOH)羧基羧酸通式:RCOOH饱和一元羧酸的通式: CnH2nO22、命名下列羧酸阅读探究丙酸2,4-二甲基戊酸5 4 3 2 1给下列羧酸分类。HOOC 相对分子质量相近的羧酸与醇沸点比较数据分析羧酸的沸点比相对分子质量相近的醇高。分析数据,你可得出什么结论?4、羧酸的物理性质①分子中碳原子数在4以下的羧酸能与水以任意比互溶。随碳链增长,羧酸在水中溶解度逐渐减小,酸性减弱。
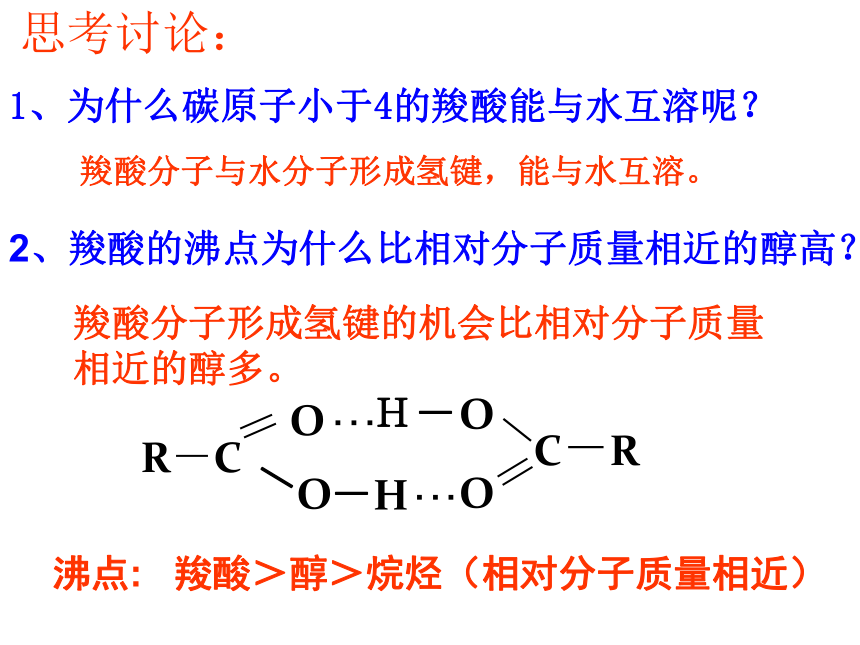
②羧酸的沸点比相对分子质量相近的醇高。4、羧酸的物理性质1、为什么碳原子小于4的羧酸能与水互溶呢?羧酸分子与水分子形成氢键,能与水互溶。2、羧酸的沸点为什么比相对分子质量相近的醇高? 羧酸分子形成氢键的机会比相对分子质量相近的醇多。沸点: 羧酸>醇>烷烃(相对分子质量相近)思考讨论:1、甲酸,结构简式为HCOOH ,又称蚁酸,有刺激性气味的液体,有腐蚀 性,能与水、乙 醇、乙醚、甘油等互溶。工业上用做还原剂,医疗上用做消毒剂。 5、三种重要的羧酸2、苯甲酸,俗称安息香酸,白色针状晶体,易升华,微溶于水,易溶于乙醇、乙醚。苯甲酸及其钠盐或钾盐常用做食品防腐剂。乙二酸(HOOC—COOH),俗称草酸,无色透明晶体,能溶于水或乙醇。以钠盐或钙盐存在于植物中。草酸钙(CaC2O4)难溶于水,是膀胱结石和肾结石的主要成分。 菠菜豆腐汤加成交流.研讨 下式是丙酸分子的结构简式,请在式中标出可能发生化学反应的部位,并推测可能发生什么类型的反应。取代
取代酸性还原反应 回顾乙酸、醇、醛的性质,以及发生反应的部位和发生反应的类型。知识回眸①能跟酸碱指示剂反应。
②能跟多种活泼金属反应,生成盐和H2。 ③能跟碱性氧化物反应,生成盐和水。④跟碱起中和反应,生成盐和水。⑤跟某些盐反应,生成另一种酸和另一种盐。1、具有酸的通性如能使紫色石蕊试液变红。二、化学性质酸性实验探究酸性:CH3COOH>H2CO3>C6H5OH有同学设计了如下方案来证明三者酸性强弱,请你选择合适的药品来完成实验。碳酸钠固体CH3COOH溶液苯酚钠溶液、酸性实验探究乙酸>碳酸>苯酚碎瓷片
乙醇 3mL
浓硫酸 2mL
乙酸 2mL
饱和的Na2CO3溶液回顾酯化反应实验(防止暴沸)反应后饱和Na2CO3溶液上层有什么现象?饱和碳酸钠溶液的液面上有无色透明的油状液体,并可闻到香味。顺序?【知识回顾】1. 试管倾斜加热的目的是什么?
2.浓硫酸的作用是什么?
3.得到的反应产物是否纯净?主要杂质有哪些?
4.饱和Na2CO3溶液有什么作用?
5. 为什么导管不插入饱和Na2CO3溶液中?有无其它防倒吸的方法?催化剂,吸水剂不纯净;乙酸、乙醇① 中和乙酸,消除乙酸气味对酯气味的影响,以便闻到乙酸乙酯的气味. ② 溶解乙醇。
③ 冷凝酯蒸气、降低酯在水中的溶解度,以便使酯分层析出。防止受热不匀发生倒吸增大受热面积怎样除杂质?6.小火均匀加热3-5分钟的目的:防止乙酸、乙醇大量挥发和液体剧烈沸腾。酯2、取代反应(注意断键位置)(制备酯)△酰胺制备酰胺类化合物(1)酯化反应(2)与氨气的取代反应酰基⑶与羧酸反应生成酸酐(脱水剂)
合成卤代酸,进而制得氨基酸、羟基酸等。(4)、α-H被取代3、还原反应实现羧酸转化为醇醇氧化醛羧酸生活中的酯类物质你知道吗?戊
酸
戊
酯自然界中的有机酯丁
酸
乙
酯乙酸异戊酯蛇麻醇酯你学过哪些酯类物质?乙酸乙酯油脂怎样制备乙酸乙酯? 从乙酸乙酯的制备实验中,你能得到哪些有关酯的信息?(从结构、物理性质、化学性质方面去考虑)思考与交流三、酯1.酯的定义:酸与醇作用失水生成的化合物叫酯。或RCOOR′通式:酯基预习点拨R可以是H原子,R’不能是H原子官能团:2.羧酸酯的一般通式为
3.饱和一元羧酸和饱和一元醇反应生成的酯的通式为:CnH2nO2饱和一元羧酸与上述酯互为同分异构体。练习:写出C4H8O2的各种同分异构体的结构简式4.羧酸衍生物:羧酸分子中羧基上的羟基被其它原子或原子团取代的产物。如酰卤、酰胺、酯等
5.酰基:羧酸分子中的羧基去掉羟基后剩余的基团乙酸乙酯的分子结构结构简式:CH3COOCH2CH3 乙酸乙酯是极性分子化学式:C4H8O2核磁共振氢谱4.酯的分类:
⑴根据酸的不同分为:有机酸酯和无机酸酯。
⑵根据羧酸分子中酯基的数目,分为:一元酸酯、二元酸酯(如乙二酸二乙酯)、多元酸酯(如油脂)。羧酸(或无机含氧酸)+ 醇 酯 + 水乙酸乙醇乙酸乙酯某酸某醇某酸某酯4、酯的命名请说出下列酯的名称:HCOOCH3甲酸甲酯CH3COOCH3CH3CH2COOC2H5丙酸乙酯乙酸甲酯乙二酸二乙酯二乙酸乙二酯练习:5. 酯的物理性质:一般密度比水小,难溶于水,易挥发,易溶于乙醇、乙醚等有机溶剂,低级酯是具有芳香气味的液体。6.化学性质——
⑴水解反应+ H—O—R2无机酸科学探究请设计对比实验探究:
乙酸乙酯在中性、酸性、碱性并加热的条件下的水解速率。对比实验6滴乙酸乙酯
+5.5 mL蒸馏水6滴乙酸乙酯
+0.5mL稀硫酸
+5.0mL蒸馏水1试管70~80℃
水浴加热现 象无明显
变化6滴乙酸乙酯
+0.5mLNaOH
+5mL蒸馏水2试管3试管乙酸乙酯的气味变淡乙酸乙酯的气味消失结论:酯在碱性条件下水解程度最大,水解几乎趋于完全。酯在酸性条件下水解程度较小,水解具有可逆性。乙酸乙酯在酸性、碱性条件下的水解方程式:
注
意
※ 酯的水解时的断键位置。※ 无机酸只起催化作用不影响化学平衡。※ 碱除起催化作用外,它能中和生成的酸,使水解程度增大,若碱过量则水解进行到底。※ 酯的水解与酯化反应互为可逆反应。⑵醇解反应
+ H—O—R2无机酸酯化反应与酯水解反应的比较NaOH中和酯水解生成的CH3COOH,提高酯的水解率浓 硫 酸稀H2SO4或NaOH吸水,提高CH3COOH与C2H5OH的转化率酒精灯火焰加热热水浴加热酯化反应
取代反应水解反应
取代反应小 结2、酯在酸(或碱)存在的条件下, 水解生成酸和醇。3、酯的水解和酸与醇的酯化反应是可逆的。4、在有碱存在时, 酯的水解不可逆,趋近于完全。 (用化学平衡知识解释)1、酯的水解规律:酯 + 水酸 + 醇酯 + 水酸 + 醇(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。(2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。 根据化学平衡原理,提
高乙酸乙酯产率的措施有:(3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。思考与交流 HCOOCH3
练习:1.写出甲酸甲酯分别在硫酸溶液、NaOH溶液中发生水解反应的化学方程式2.写出下列酯分别在硫酸溶液、NaOH溶液中发生水解反应的化学方程式油脂属于酯,是一种特殊的酯8.油脂的组成和结构 油脂是由多种高级脂肪酸与甘油生成的酯。醇为丙三醇(甘油)酸为高级脂肪酸*三个R基可以相同,称单甘油酯。
可以不相同,称混甘油酯油脂油脂肪(液态,如植物油脂)(固态,如动物脂肪)如:菜籽油、花生油、豆油如:猪油、牛油属于酯类油和脂的区别:天然的油脂都是混合物注意:
?矿物油(如汽油等)不是油脂属于烃类
?油脂属于酯类,但酯类并不都是油脂
?天然油脂大多是几种混甘油酯的混合物跟酯类的水解反应相同,在适当的条件下(如有酸或碱或高温水蒸气存在),油脂跟水能够发生水解反应,生成甘油和相应的高级脂肪酸。 ?油脂的水解酸性条件的可逆水解油脂的水解碱性条件的完全水解(皂化反应)制取高级脂肪酸和甘油制取肥皂(硬脂酸钠)和甘油油脂在酸性条件下水解利用该反应可制取硬脂酸,甘油硬脂酸丙三醇(甘油)碱性条件下水解-皂化反应利用该反应可制取肥皂(C17H35COONa)和甘油肥皂的制取:
⑴油脂的皂化:
把动物脂肪(牛脂、羊脂等)植物油(棉籽油、豆油等)酒精和氢氧化钠溶液,按一定比例放在皂化锅内,用蒸汽加热同时适当搅拌,因为有过量的碱存在,所以油脂便发生水解反应,生成高级脂肪酸的钠盐和甘油,反应完成后,生成的高级脂肪酸钠、甘油、酒精和水形成混合液。
⑵皂化液的分离:
为了使肥皂和甘油充分分离,继续加热搅拌,并向锅内慢慢加入食盐细粒,高级脂肪酸从混合液中析出,这个加入食盐使肥皂析出的过程就是盐析,此时,停止加热和搅拌,静置一定时间,溶液便分成上下两层,上层是高级脂肪酸钠,下层是甘油和食盐等混合物。
⑶肥皂成型:
取出上层的物质,加入填充剂(如松香和硅酸钠)等进行过滤、干燥、成型制成了成品肥皂从皂化液中分离出的下层溶液经分离提纯后,得到甘油。?油脂的氢化(加成反应,还原反应)
油酸甘油酯(油)生成硬脂酸甘油酯(脂肪)
油酸氢化的工业目的:提高油脂的饱和程度,生成固态油脂,所以油脂的氢化也叫油脂的硬化,所得的油脂叫人造脂肪又称硬化油。硬化油性质稳定,不易变质,便于运输。
迁移·应用日常生活中我们经常使用热的纯碱溶液洗涤餐具上的油污,分析利用了什么原理?
(已知高级脂肪酸钠如硬脂酸钠、软脂酸钠、甘油都能溶解入水)
在碱性条件下油脂完全水解,生成可溶性的高级脂肪酸钠如硬脂酸钠、软脂酸钠和甘油。 油脂提供人体必需不
饱和高级脂肪酸提供热能溶解脂溶性维生素增加饱腹感保护内脏器官细胞膜、神经和脑组织的成分储备热能
保温御寒油脂对人体健康的积极作用1.酯主要发生水解反应
2. 酯水解的条件可以是酸性或碱性,
但水解程度不同
3.油脂属于酯类,含有“酯基”官能团
4.油脂碱性水解又叫皂化反应
5.酯和脂在使用和写法的区别小结CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能能能能能不能不能能能,不产
生CO2醇、酚、羧酸中羟基的比较【知识归纳】思考:NaHCO3能否与上述物质反应?小结 酸性α-H的取代反应还原反应水溶性沸点-OH被取代的反应 1mol有机物
最多能消耗下列各物质多少 mol?(1) Na(2) NaOH(3) NaHCO3思考:问题探究分析甲酸的结构,探究甲酸的性质。1、羧酸的性质2、醛的部分性质练习⑴ 蓝色石蕊试纸;
⑵ 新制Cu(OH)2,加热。练习⑴ 蓝色石蕊试纸;
⑵ 新制Cu(OH)2,加热。写出下列酸和醇的酯化反应CH3COOCH3 + H2O乙酸甲酯二乙酸乙二酯环乙二酸乙二酯2再见
2、能举例说明羧基与羰基、羟基性质的区别,并进一步体会官能团之间的相互作用对有机化合物性质的影响。 重点、难点: 羧酸的化学性质教学目标自然界和日常生活中的有机酸资料卡片苹果酸一、羧酸概述
1、定义:分子由烃基(或氢原子)和羧基相
连组成的有机化合物叫羧酸。 官能团:(或—COOH)羧基羧酸通式:RCOOH饱和一元羧酸的通式: CnH2nO22、命名下列羧酸阅读探究丙酸2,4-二甲基戊酸5 4 3 2 1给下列羧酸分类。HOOC 相对分子质量相近的羧酸与醇沸点比较数据分析羧酸的沸点比相对分子质量相近的醇高。分析数据,你可得出什么结论?4、羧酸的物理性质①分子中碳原子数在4以下的羧酸能与水以任意比互溶。随碳链增长,羧酸在水中溶解度逐渐减小,酸性减弱。
②羧酸的沸点比相对分子质量相近的醇高。4、羧酸的物理性质1、为什么碳原子小于4的羧酸能与水互溶呢?羧酸分子与水分子形成氢键,能与水互溶。2、羧酸的沸点为什么比相对分子质量相近的醇高? 羧酸分子形成氢键的机会比相对分子质量相近的醇多。沸点: 羧酸>醇>烷烃(相对分子质量相近)思考讨论:1、甲酸,结构简式为HCOOH ,又称蚁酸,有刺激性气味的液体,有腐蚀 性,能与水、乙 醇、乙醚、甘油等互溶。工业上用做还原剂,医疗上用做消毒剂。 5、三种重要的羧酸2、苯甲酸,俗称安息香酸,白色针状晶体,易升华,微溶于水,易溶于乙醇、乙醚。苯甲酸及其钠盐或钾盐常用做食品防腐剂。乙二酸(HOOC—COOH),俗称草酸,无色透明晶体,能溶于水或乙醇。以钠盐或钙盐存在于植物中。草酸钙(CaC2O4)难溶于水,是膀胱结石和肾结石的主要成分。 菠菜豆腐汤加成交流.研讨 下式是丙酸分子的结构简式,请在式中标出可能发生化学反应的部位,并推测可能发生什么类型的反应。取代
取代酸性还原反应 回顾乙酸、醇、醛的性质,以及发生反应的部位和发生反应的类型。知识回眸①能跟酸碱指示剂反应。
②能跟多种活泼金属反应,生成盐和H2。 ③能跟碱性氧化物反应,生成盐和水。④跟碱起中和反应,生成盐和水。⑤跟某些盐反应,生成另一种酸和另一种盐。1、具有酸的通性如能使紫色石蕊试液变红。二、化学性质酸性实验探究酸性:CH3COOH>H2CO3>C6H5OH有同学设计了如下方案来证明三者酸性强弱,请你选择合适的药品来完成实验。碳酸钠固体CH3COOH溶液苯酚钠溶液、酸性实验探究乙酸>碳酸>苯酚碎瓷片
乙醇 3mL
浓硫酸 2mL
乙酸 2mL
饱和的Na2CO3溶液回顾酯化反应实验(防止暴沸)反应后饱和Na2CO3溶液上层有什么现象?饱和碳酸钠溶液的液面上有无色透明的油状液体,并可闻到香味。顺序?【知识回顾】1. 试管倾斜加热的目的是什么?
2.浓硫酸的作用是什么?
3.得到的反应产物是否纯净?主要杂质有哪些?
4.饱和Na2CO3溶液有什么作用?
5. 为什么导管不插入饱和Na2CO3溶液中?有无其它防倒吸的方法?催化剂,吸水剂不纯净;乙酸、乙醇① 中和乙酸,消除乙酸气味对酯气味的影响,以便闻到乙酸乙酯的气味. ② 溶解乙醇。
③ 冷凝酯蒸气、降低酯在水中的溶解度,以便使酯分层析出。防止受热不匀发生倒吸增大受热面积怎样除杂质?6.小火均匀加热3-5分钟的目的:防止乙酸、乙醇大量挥发和液体剧烈沸腾。酯2、取代反应(注意断键位置)(制备酯)△酰胺制备酰胺类化合物(1)酯化反应(2)与氨气的取代反应酰基⑶与羧酸反应生成酸酐(脱水剂)
合成卤代酸,进而制得氨基酸、羟基酸等。(4)、α-H被取代3、还原反应实现羧酸转化为醇醇氧化醛羧酸生活中的酯类物质你知道吗?戊
酸
戊
酯自然界中的有机酯丁
酸
乙
酯乙酸异戊酯蛇麻醇酯你学过哪些酯类物质?乙酸乙酯油脂怎样制备乙酸乙酯? 从乙酸乙酯的制备实验中,你能得到哪些有关酯的信息?(从结构、物理性质、化学性质方面去考虑)思考与交流三、酯1.酯的定义:酸与醇作用失水生成的化合物叫酯。或RCOOR′通式:酯基预习点拨R可以是H原子,R’不能是H原子官能团:2.羧酸酯的一般通式为
3.饱和一元羧酸和饱和一元醇反应生成的酯的通式为:CnH2nO2饱和一元羧酸与上述酯互为同分异构体。练习:写出C4H8O2的各种同分异构体的结构简式4.羧酸衍生物:羧酸分子中羧基上的羟基被其它原子或原子团取代的产物。如酰卤、酰胺、酯等
5.酰基:羧酸分子中的羧基去掉羟基后剩余的基团乙酸乙酯的分子结构结构简式:CH3COOCH2CH3 乙酸乙酯是极性分子化学式:C4H8O2核磁共振氢谱4.酯的分类:
⑴根据酸的不同分为:有机酸酯和无机酸酯。
⑵根据羧酸分子中酯基的数目,分为:一元酸酯、二元酸酯(如乙二酸二乙酯)、多元酸酯(如油脂)。羧酸(或无机含氧酸)+ 醇 酯 + 水乙酸乙醇乙酸乙酯某酸某醇某酸某酯4、酯的命名请说出下列酯的名称:HCOOCH3甲酸甲酯CH3COOCH3CH3CH2COOC2H5丙酸乙酯乙酸甲酯乙二酸二乙酯二乙酸乙二酯练习:5. 酯的物理性质:一般密度比水小,难溶于水,易挥发,易溶于乙醇、乙醚等有机溶剂,低级酯是具有芳香气味的液体。6.化学性质——
⑴水解反应+ H—O—R2无机酸科学探究请设计对比实验探究:
乙酸乙酯在中性、酸性、碱性并加热的条件下的水解速率。对比实验6滴乙酸乙酯
+5.5 mL蒸馏水6滴乙酸乙酯
+0.5mL稀硫酸
+5.0mL蒸馏水1试管70~80℃
水浴加热现 象无明显
变化6滴乙酸乙酯
+0.5mLNaOH
+5mL蒸馏水2试管3试管乙酸乙酯的气味变淡乙酸乙酯的气味消失结论:酯在碱性条件下水解程度最大,水解几乎趋于完全。酯在酸性条件下水解程度较小,水解具有可逆性。乙酸乙酯在酸性、碱性条件下的水解方程式:
注
意
※ 酯的水解时的断键位置。※ 无机酸只起催化作用不影响化学平衡。※ 碱除起催化作用外,它能中和生成的酸,使水解程度增大,若碱过量则水解进行到底。※ 酯的水解与酯化反应互为可逆反应。⑵醇解反应
+ H—O—R2无机酸酯化反应与酯水解反应的比较NaOH中和酯水解生成的CH3COOH,提高酯的水解率浓 硫 酸稀H2SO4或NaOH吸水,提高CH3COOH与C2H5OH的转化率酒精灯火焰加热热水浴加热酯化反应
取代反应水解反应
取代反应小 结2、酯在酸(或碱)存在的条件下, 水解生成酸和醇。3、酯的水解和酸与醇的酯化反应是可逆的。4、在有碱存在时, 酯的水解不可逆,趋近于完全。 (用化学平衡知识解释)1、酯的水解规律:酯 + 水酸 + 醇酯 + 水酸 + 醇(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。(2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。 根据化学平衡原理,提
高乙酸乙酯产率的措施有:(3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。思考与交流 HCOOCH3
练习:1.写出甲酸甲酯分别在硫酸溶液、NaOH溶液中发生水解反应的化学方程式2.写出下列酯分别在硫酸溶液、NaOH溶液中发生水解反应的化学方程式油脂属于酯,是一种特殊的酯8.油脂的组成和结构 油脂是由多种高级脂肪酸与甘油生成的酯。醇为丙三醇(甘油)酸为高级脂肪酸*三个R基可以相同,称单甘油酯。
可以不相同,称混甘油酯油脂油脂肪(液态,如植物油脂)(固态,如动物脂肪)如:菜籽油、花生油、豆油如:猪油、牛油属于酯类油和脂的区别:天然的油脂都是混合物注意:
?矿物油(如汽油等)不是油脂属于烃类
?油脂属于酯类,但酯类并不都是油脂
?天然油脂大多是几种混甘油酯的混合物跟酯类的水解反应相同,在适当的条件下(如有酸或碱或高温水蒸气存在),油脂跟水能够发生水解反应,生成甘油和相应的高级脂肪酸。 ?油脂的水解酸性条件的可逆水解油脂的水解碱性条件的完全水解(皂化反应)制取高级脂肪酸和甘油制取肥皂(硬脂酸钠)和甘油油脂在酸性条件下水解利用该反应可制取硬脂酸,甘油硬脂酸丙三醇(甘油)碱性条件下水解-皂化反应利用该反应可制取肥皂(C17H35COONa)和甘油肥皂的制取:
⑴油脂的皂化:
把动物脂肪(牛脂、羊脂等)植物油(棉籽油、豆油等)酒精和氢氧化钠溶液,按一定比例放在皂化锅内,用蒸汽加热同时适当搅拌,因为有过量的碱存在,所以油脂便发生水解反应,生成高级脂肪酸的钠盐和甘油,反应完成后,生成的高级脂肪酸钠、甘油、酒精和水形成混合液。
⑵皂化液的分离:
为了使肥皂和甘油充分分离,继续加热搅拌,并向锅内慢慢加入食盐细粒,高级脂肪酸从混合液中析出,这个加入食盐使肥皂析出的过程就是盐析,此时,停止加热和搅拌,静置一定时间,溶液便分成上下两层,上层是高级脂肪酸钠,下层是甘油和食盐等混合物。
⑶肥皂成型:
取出上层的物质,加入填充剂(如松香和硅酸钠)等进行过滤、干燥、成型制成了成品肥皂从皂化液中分离出的下层溶液经分离提纯后,得到甘油。?油脂的氢化(加成反应,还原反应)
油酸甘油酯(油)生成硬脂酸甘油酯(脂肪)
油酸氢化的工业目的:提高油脂的饱和程度,生成固态油脂,所以油脂的氢化也叫油脂的硬化,所得的油脂叫人造脂肪又称硬化油。硬化油性质稳定,不易变质,便于运输。
迁移·应用日常生活中我们经常使用热的纯碱溶液洗涤餐具上的油污,分析利用了什么原理?
(已知高级脂肪酸钠如硬脂酸钠、软脂酸钠、甘油都能溶解入水)
在碱性条件下油脂完全水解,生成可溶性的高级脂肪酸钠如硬脂酸钠、软脂酸钠和甘油。 油脂提供人体必需不
饱和高级脂肪酸提供热能溶解脂溶性维生素增加饱腹感保护内脏器官细胞膜、神经和脑组织的成分储备热能
保温御寒油脂对人体健康的积极作用1.酯主要发生水解反应
2. 酯水解的条件可以是酸性或碱性,
但水解程度不同
3.油脂属于酯类,含有“酯基”官能团
4.油脂碱性水解又叫皂化反应
5.酯和脂在使用和写法的区别小结CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能能能能能不能不能能能,不产
生CO2醇、酚、羧酸中羟基的比较【知识归纳】思考:NaHCO3能否与上述物质反应?小结 酸性α-H的取代反应还原反应水溶性沸点-OH被取代的反应 1mol有机物
最多能消耗下列各物质多少 mol?(1) Na(2) NaOH(3) NaHCO3思考:问题探究分析甲酸的结构,探究甲酸的性质。1、羧酸的性质2、醛的部分性质练习⑴ 蓝色石蕊试纸;
⑵ 新制Cu(OH)2,加热。练习⑴ 蓝色石蕊试纸;
⑵ 新制Cu(OH)2,加热。写出下列酸和醇的酯化反应CH3COOCH3 + H2O乙酸甲酯二乙酸乙二酯环乙二酸乙二酯2再见
