北京课改版九下化学 12.1几种常见的盐 课件(29张PPT)
文档属性
| 名称 | 北京课改版九下化学 12.1几种常见的盐 课件(29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-15 00:00:00 | ||
图片预览





文档简介
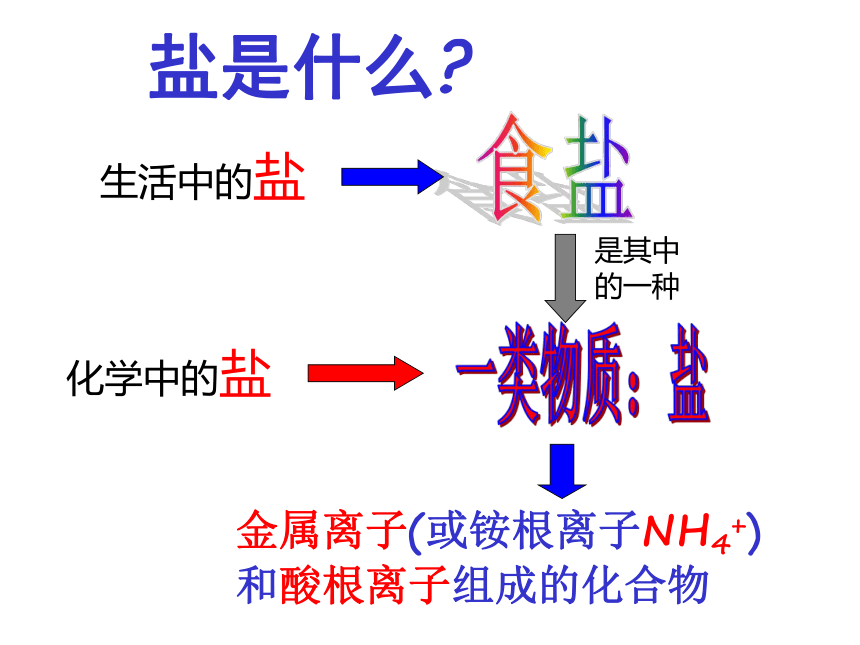
课件29张PPT。几种常见的盐盐是什么?金属离子(或铵根离子NH4+)
和酸根离子组成的化合物食盐生活中的盐化学中的盐一类物质:盐是其中
的一种你能写出这些物质的化学式吗?
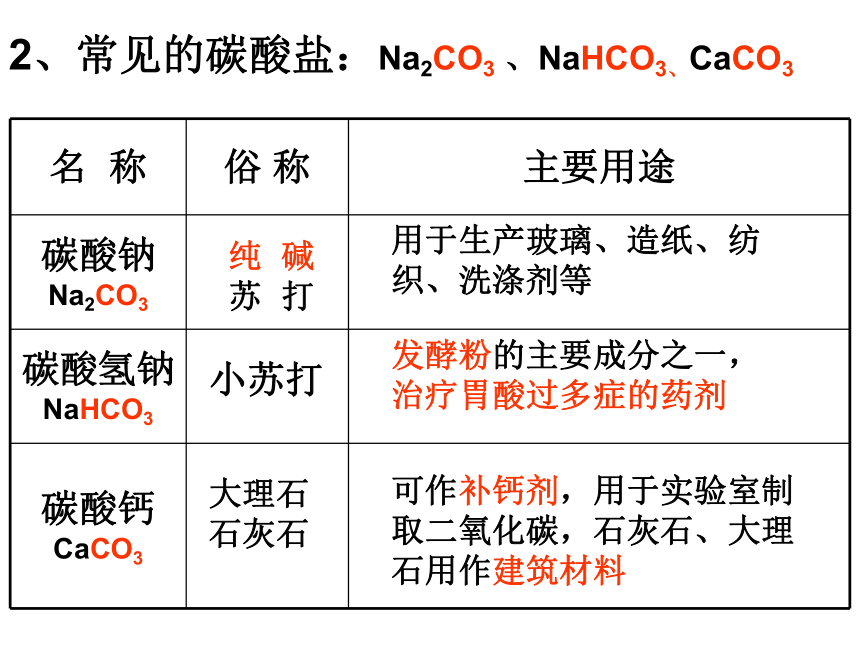
碳酸钙碳酸钠碳酸氢钠CaCO3Na2CO3NaHCO3
华表人民大会堂中南海酒店大厅大理石地面纯 碱
苏 打 小苏打
大理石
石灰石用于生产玻璃、造纸、纺织、洗涤剂等发酵粉的主要成分之一,
治疗胃酸过多症的药剂可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料2、常见的碳酸盐:Na2CO3 、NaHCO3、CaCO3我国制碱工业的先驱——侯德榜侯德榜一生在化工技术上有三大贡献。1、揭开了索尔维法的秘密。
2、创立了中国人自己的制碱
工艺——侯氏制碱法。
3、就是他为发展小化肥工业所做的贡献。 候氏制碱法制出的碱是:—纯碱(Na2CO3)在中国化学工业史上,有
一位杰出的科学家,托起
了中国现代化学工业的大
厦,这位先驱者就是被称
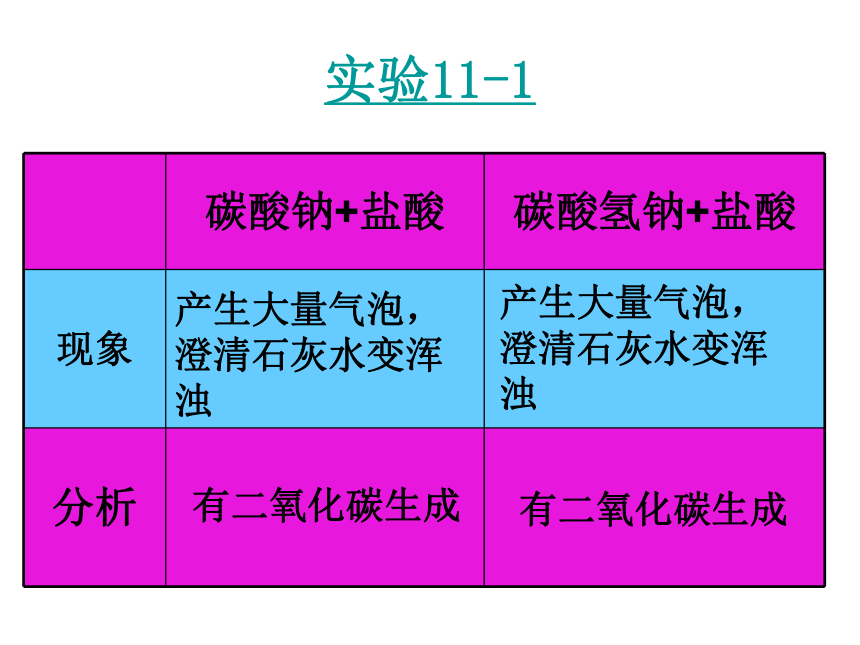
为“国宝”的侯德榜。 【回顾】 请书写出实验室制取CO2的方程式。CaCO3 + 2 HCl === CaCl2 + H2CO3实验11-1产生大量气泡,澄清石灰水变浑浊产生大量气泡,澄清石灰水变浑浊有二氧化碳生成有二氧化碳生成
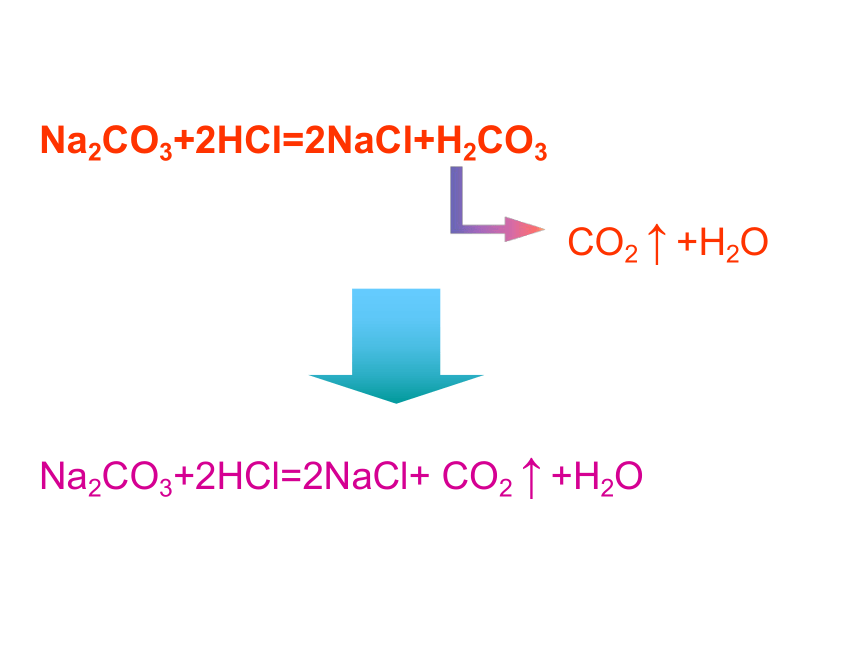
Na2CO3+2HCl=2NaCl+H2CO3
CO2 ↑ +H2O
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O 善思: 碳酸盐(即CO32- 、HCO3-)如何检验?
所用试剂:稀盐酸和澄清石灰水。Na2CO3+Ca(OH)2=CaCO3 +2NaOH出现白色沉淀二者发生反应,生成一种难溶物用途:用于实验室制取氢氧化钠三、盐的化学性质1、盐与金属CuSO4+Fe=FeSO4+Cu2AgNO3+Cu=Cu(NO3)2+2Ag盐+金属=新盐+新金属(置换反应)条件:在金属活动顺序里,金属必须是排在
盐中金属元素的前面。盐可溶2、盐与酸盐+酸=新盐+新酸条件:生成物中有沉淀或气体或水CaCO3+2HCl=CaCl2+CO2↑+H2OH2CO3NaHCO3+HCl=NaCl+ CO2 ↑ +H2O H2CO3AgNO3+HCl=AgCl ↓ + HNO3BaCl2+H2SO4=BaSO4 ↓+ 2HCl3、盐与碱Na2CO3+Ca(OH)2=CaCO3↓+2NaOH盐+碱=新盐+新碱条件:反应物必须都可溶解
生成物中有沉淀或气体或水2NaOH+CuSO4= Cu(OH)2↓+Na2SO43NaOH+FeCl3= Fe(OH)3↓+3NaClNH3·H2ONaOH+NH4Cl=NaCl+NH3↑+H2O4、盐与盐的反应盐+盐=新盐+新盐盐与盐会发生反应?NaCl+AgNO3=AgCl↓+NaNO3CaCl2+Na2CO3=CaCO3↓+2NaClBaCl2+CuSO4=BaSO4↓+CuCl2条件: 反应物:盐都必须可溶
生成物:新盐中至少有一种沉淀盐的化学性质盐金属酸碱盐新盐 + 新酸新盐 + 新碱新盐+新盐总结酸碱盐金属氧化物活泼金属使石蕊
变蓝酚
酞变红非金属氧物 金属 盐使石蕊变红
酚酞无色归纳②酸+盐→新酸+新盐④碱+盐→新碱+新盐 ⑤盐+盐→新盐+新盐①酸+碱→盐+水(中和反应)③酸+金属氧化物→盐+水(分析)下列五类反应有什么共同特点?
属于 三种基本反应类型吗????Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOHNaOH + HCl = NaCl +H2O6HCl+ Fe2O3 =2FeCl3+ 3H2OBaCl2+Na2SO4=BaSO4↓+2NaCl2HCl+CaCO3=CaCl2+ H2CO3? ???H2O+CO2 ↑NH3·H2ONaOH+NH4NO3=NaNO3+NH3↑+H2OHCl+AgNO3= HNO3+ AgCl ↓复分解反应(属于基本反应类型) 两种化合物互相交换成分,
生成另外两种化合物的反应。表达式:AB + CD→特 点:双交换,价不变AD+ CB③酸+盐→新酸+新盐④碱+盐→新碱+新盐 ⑤盐+盐→新盐+新盐复分解反应的类型:①酸+碱→盐+水(中和反应)② 酸+金属氧化物→盐+水复分解反应发生的条件:反应物:无酸参加,必须可溶;
生成物:必须有沉淀、气体、水三者之一。一定发生H2SO4 + NaNO3
Na2SO4 + BaCl2
HNO3 + K2CO3
KNO3 + NaOH
NaOH+HNO3不能BaSO4↓+ 2NaCl2KNO3 + CO2↑+H2O不能 2试一试 你们能行!!NaNO3+H2O判断下列反应是否发生,写出发生反应的方程式1、AgNO3 + HCl ---
2、 K2CO3+ Ca(OH)2---
3、Na2CO3+ CaCl2 ---
4、Na2SO4 + HCl ---5、H2SO4 + BaCl2---
6、Ba(OH)2+ KCl ------
7、CuSO4 + NH4NO3--- AgCl↓+HNO3CaCO3↓+2 KOHCaCO3↓+ 2NaClBaSO4↓+ 2HCl再试一试1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaOH+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑写出下列反应的方程式,并讨论它们是
否属于复分解反应。你们最棒!!下列各组离子在水溶液中能大量共存的是( )思考 你们能行!A、Fe2+ 、Ca2+ 、CO32- 、OH-
B、Na+ 、SO42- 、Cl- 、OH-
C、Ba2+ 、H+ 、Cl-、 OH-
D、Ag+ 、NH4+、 NO3-、 OH-BH+与OH-、CO32- 不共存Cl-只与Ag+不共存SO42-只与Ba2+不共存CO32-只与K+、 Na+、 NH4+共存OH-只与K+ 、 Na+、Ca2+、 Ba2+共存你们收获了吗!!!复分解反应的应用一、除杂质1、KCl溶液(K2CO3)2、NaOH溶液(Na2CO3)3、Na2SO4溶液(H2SO4)酸碱盐间除杂质的实质:把多余的离子转换成气体,或沉淀或水,但是,不能带来其他杂质,不能减少主要成分,生成的新物质易和主要成分分离开二、鉴别溶液1、能将AgNO3 K2CO3 ZnCl2三种无色溶液鉴别出来的是( )
A、稀HNO3 B、Na2SO4
C、HCl D、BaSO42、能区别NaOH溶液和稀HCl的方法有: (1)取样,加入紫色石蕊试液,使石蕊变红得时稀盐酸,变蓝的时NaOH溶液(2)取样,加入活泼金铁属......(3)取样,加入Na2CO3溶液......(4)取样,加入CuCl2溶液.......C
和酸根离子组成的化合物食盐生活中的盐化学中的盐一类物质:盐是其中
的一种你能写出这些物质的化学式吗?
碳酸钙碳酸钠碳酸氢钠CaCO3Na2CO3NaHCO3
华表人民大会堂中南海酒店大厅大理石地面纯 碱
苏 打 小苏打
大理石
石灰石用于生产玻璃、造纸、纺织、洗涤剂等发酵粉的主要成分之一,
治疗胃酸过多症的药剂可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料2、常见的碳酸盐:Na2CO3 、NaHCO3、CaCO3我国制碱工业的先驱——侯德榜侯德榜一生在化工技术上有三大贡献。1、揭开了索尔维法的秘密。
2、创立了中国人自己的制碱
工艺——侯氏制碱法。
3、就是他为发展小化肥工业所做的贡献。 候氏制碱法制出的碱是:—纯碱(Na2CO3)在中国化学工业史上,有
一位杰出的科学家,托起
了中国现代化学工业的大
厦,这位先驱者就是被称
为“国宝”的侯德榜。 【回顾】 请书写出实验室制取CO2的方程式。CaCO3 + 2 HCl === CaCl2 + H2CO3实验11-1产生大量气泡,澄清石灰水变浑浊产生大量气泡,澄清石灰水变浑浊有二氧化碳生成有二氧化碳生成
Na2CO3+2HCl=2NaCl+H2CO3
CO2 ↑ +H2O
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O 善思: 碳酸盐(即CO32- 、HCO3-)如何检验?
所用试剂:稀盐酸和澄清石灰水。Na2CO3+Ca(OH)2=CaCO3 +2NaOH出现白色沉淀二者发生反应,生成一种难溶物用途:用于实验室制取氢氧化钠三、盐的化学性质1、盐与金属CuSO4+Fe=FeSO4+Cu2AgNO3+Cu=Cu(NO3)2+2Ag盐+金属=新盐+新金属(置换反应)条件:在金属活动顺序里,金属必须是排在
盐中金属元素的前面。盐可溶2、盐与酸盐+酸=新盐+新酸条件:生成物中有沉淀或气体或水CaCO3+2HCl=CaCl2+CO2↑+H2OH2CO3NaHCO3+HCl=NaCl+ CO2 ↑ +H2O H2CO3AgNO3+HCl=AgCl ↓ + HNO3BaCl2+H2SO4=BaSO4 ↓+ 2HCl3、盐与碱Na2CO3+Ca(OH)2=CaCO3↓+2NaOH盐+碱=新盐+新碱条件:反应物必须都可溶解
生成物中有沉淀或气体或水2NaOH+CuSO4= Cu(OH)2↓+Na2SO43NaOH+FeCl3= Fe(OH)3↓+3NaClNH3·H2ONaOH+NH4Cl=NaCl+NH3↑+H2O4、盐与盐的反应盐+盐=新盐+新盐盐与盐会发生反应?NaCl+AgNO3=AgCl↓+NaNO3CaCl2+Na2CO3=CaCO3↓+2NaClBaCl2+CuSO4=BaSO4↓+CuCl2条件: 反应物:盐都必须可溶
生成物:新盐中至少有一种沉淀盐的化学性质盐金属酸碱盐新盐 + 新酸新盐 + 新碱新盐+新盐总结酸碱盐金属氧化物活泼金属使石蕊
变蓝酚
酞变红非金属氧物 金属 盐使石蕊变红
酚酞无色归纳②酸+盐→新酸+新盐④碱+盐→新碱+新盐 ⑤盐+盐→新盐+新盐①酸+碱→盐+水(中和反应)③酸+金属氧化物→盐+水(分析)下列五类反应有什么共同特点?
属于 三种基本反应类型吗????Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOHNaOH + HCl = NaCl +H2O6HCl+ Fe2O3 =2FeCl3+ 3H2OBaCl2+Na2SO4=BaSO4↓+2NaCl2HCl+CaCO3=CaCl2+ H2CO3? ???H2O+CO2 ↑NH3·H2ONaOH+NH4NO3=NaNO3+NH3↑+H2OHCl+AgNO3= HNO3+ AgCl ↓复分解反应(属于基本反应类型) 两种化合物互相交换成分,
生成另外两种化合物的反应。表达式:AB + CD→特 点:双交换,价不变AD+ CB③酸+盐→新酸+新盐④碱+盐→新碱+新盐 ⑤盐+盐→新盐+新盐复分解反应的类型:①酸+碱→盐+水(中和反应)② 酸+金属氧化物→盐+水复分解反应发生的条件:反应物:无酸参加,必须可溶;
生成物:必须有沉淀、气体、水三者之一。一定发生H2SO4 + NaNO3
Na2SO4 + BaCl2
HNO3 + K2CO3
KNO3 + NaOH
NaOH+HNO3不能BaSO4↓+ 2NaCl2KNO3 + CO2↑+H2O不能 2试一试 你们能行!!NaNO3+H2O判断下列反应是否发生,写出发生反应的方程式1、AgNO3 + HCl ---
2、 K2CO3+ Ca(OH)2---
3、Na2CO3+ CaCl2 ---
4、Na2SO4 + HCl ---5、H2SO4 + BaCl2---
6、Ba(OH)2+ KCl ------
7、CuSO4 + NH4NO3--- AgCl↓+HNO3CaCO3↓+2 KOHCaCO3↓+ 2NaClBaSO4↓+ 2HCl再试一试1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaOH+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑写出下列反应的方程式,并讨论它们是
否属于复分解反应。你们最棒!!下列各组离子在水溶液中能大量共存的是( )思考 你们能行!A、Fe2+ 、Ca2+ 、CO32- 、OH-
B、Na+ 、SO42- 、Cl- 、OH-
C、Ba2+ 、H+ 、Cl-、 OH-
D、Ag+ 、NH4+、 NO3-、 OH-BH+与OH-、CO32- 不共存Cl-只与Ag+不共存SO42-只与Ba2+不共存CO32-只与K+、 Na+、 NH4+共存OH-只与K+ 、 Na+、Ca2+、 Ba2+共存你们收获了吗!!!复分解反应的应用一、除杂质1、KCl溶液(K2CO3)2、NaOH溶液(Na2CO3)3、Na2SO4溶液(H2SO4)酸碱盐间除杂质的实质:把多余的离子转换成气体,或沉淀或水,但是,不能带来其他杂质,不能减少主要成分,生成的新物质易和主要成分分离开二、鉴别溶液1、能将AgNO3 K2CO3 ZnCl2三种无色溶液鉴别出来的是( )
A、稀HNO3 B、Na2SO4
C、HCl D、BaSO42、能区别NaOH溶液和稀HCl的方法有: (1)取样,加入紫色石蕊试液,使石蕊变红得时稀盐酸,变蓝的时NaOH溶液(2)取样,加入活泼金铁属......(3)取样,加入Na2CO3溶液......(4)取样,加入CuCl2溶液.......C
