人教版高中化学选修五1.4研究有机化合物的一般步骤和方法(共56张PPT)
文档属性
| 名称 | 人教版高中化学选修五1.4研究有机化合物的一般步骤和方法(共56张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-20 08:38:14 | ||
图片预览











文档简介
课件56张PPT。第一章 认识有机化合物2019年7月30日星期二第四节 研究有机化合物的一般步骤和方法第一章认识有机化合物研究有机化合物的一般步骤粗品分离、提纯元素定量分析确定实验式测定相对分子质量确定分子式波谱分析确定结构式(有哪些官能团)【思考与交流】
1、下列物质中的杂质(括号中是杂质)可以用什么方法除去?
(1)酒精(水) (2)壬烷(己烷)
(3)KNO3(NaCl ) (4)乙酸乙酯(乙醇)
(5)甲烷(乙烯) (6)NaCl(泥沙)
(7)溴水(水) (8)CO2(HCl)
分离提纯的基本方法:
过滤法、结晶(重结晶)法、
蒸馏(分馏)法、萃取分液法、洗气法、
加热法、 渗析法、盐析法和离子交换法等。3.分离提纯的原则:
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯物)。
(3)易分离(被提纯物与杂质易分离)。
(4)易复原(被提纯物易复原)。
2.常用的分离、提纯物质的方法有哪些?一、分离、提纯物理方法:
利用有机物与杂质物理性质的差异而将它们分开.有机物分离的常用物理方法蒸馏
重结晶
萃取
分液化学方法:
一般是加入或通过某种试剂进行化学反应。1、蒸馏:(2)蒸馏提纯的条件 液态混合物
有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)(1)蒸馏的原理利用混合物的沸点不同,除去难挥发或
不挥发的杂质(3)蒸馏的注意事项:
温度计水银球的部位(蒸馏烧瓶支管处)
烧瓶中放少量沸石或碎瓷片(防止暴沸)
进出水方向(下进上出)
烧瓶中所盛放液体不能超过1/3
实验:含有杂质的工业乙醇的蒸馏例如:含有杂质的工业乙醇的蒸馏
(乙醇的沸点:78.5°C 水的沸点:100°C)
蒸馏提纯乙醇收集77—79°C的馏分实验步骤:
(1)将50ml工业乙醇倒入250ml蒸馏烧瓶中
(2)在烧瓶中投入2粒碎瓷片
(3)装好蒸馏装置(从下往上、从左往右)
(4)往冷凝管中通入冷却水
(5)加热蒸馏,收集77-79°C的馏分乙醇和水的共沸点混合物:沸点78.15℃,乙醇95.6%,水4.4%练习 欲用95.6%的工业酒精制取无水乙醇时,可选用的方法是( )
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏√2.重结晶法 利用被提纯物质与杂质在同一溶剂中的
溶解度不同而将其杂质除去的方法。 关键:选择适当的溶剂。(1)杂质在溶剂中的溶解度很小或很大,易于除去;
(2)被提纯的有机物在此溶剂中的溶解度受温度的
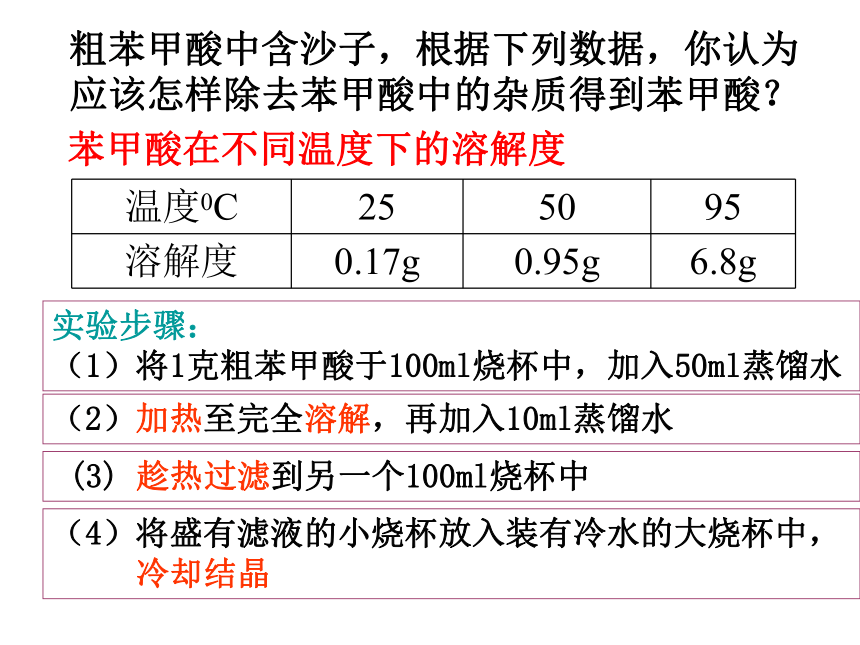
影响较大。该有机物在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出 选择溶剂的条件: 粗苯甲酸中含沙子,根据下列数据,你认为应该怎样除去苯甲酸中的杂质得到苯甲酸? 苯甲酸在不同温度下的溶解度实验步骤:
(1)将1克粗苯甲酸于100ml烧杯中,加入50ml蒸馏水(2)加热至完全溶解,再加入10ml蒸馏水 (3) 趁热过滤到另一个100ml烧杯中(4)将盛有滤液的小烧杯放入装有冷水的大烧杯中,
冷却结晶重结晶观察:
(1)粗苯甲酸的状态:白色固体混有黑色或灰色固体
(2)滤液冷却时的实验现象:
澄清 浑浊 析出晶体
(3)重结晶后苯甲酸的状态:白色片状晶体不纯固体物质残渣
(不溶性杂质)滤液母液
(可溶性杂质和部分被提纯物)晶体
(产品)溶于溶剂,制成饱和溶液,趁热过滤冷却,结晶,
过滤,洗涤洗涤沉淀或晶体的方法:
用胶头滴管往晶体上加蒸馏水直至晶体被浸没,待水完全流出后,重复操作两至三次,直至晶体被洗净。检验洗涤效果:
取最后一次的洗出液,再选择适当的试剂进行检验。3、萃取萃取固—液萃取液—液萃取 用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法. 利用混合物中一种溶质在不同溶剂里的溶解度的不同,将有机物从一种溶剂转移到另一种溶剂中的过程.(1) 萃取(2) 萃取的原理(3)萃取剂选择的条件:① 萃取剂和原溶剂互不相溶和不发生化学反应
溶质在萃取剂中的溶解度大于在原溶剂中的溶
解度
③ 溶质和萃取剂不反应
④ 萃取剂易挥发,与溶质易分离(4)主要仪器:分液漏斗[练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和甲苯
C 汽油和苯 D 硝基苯和水B DD4、色谱法: (阅读P19)
【思考与交流】
1、什么叫色谱法?
2、色谱法常用的吸附剂有哪些?
3、色谱法的种类有哪些?
色谱法
定义:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
吸附剂:碳酸钙、硅胶、氧化铝、活性炭
分类:
(1)薄层色谱法
(2)柱色谱法
有机物(纯净)确定 分子式?首先要确定有机物中含有哪些元素元素分析→确定实验式二、元素分析与相对分子质量的测定1.元素分析:
(1) 定性分析: 主要分析有机物的组成元素
方法:燃烧法 C ---- CO2N------ N2O-----H2OH-----H2O如:产物中只有CO2 和H2O可能2:含C 、 H 、 O三种元素可能1:只含C 、 H 两种元素(2) 定量分析:
测定有机物分子各元素原子的质量分数元素定量分析的原理: 将一定量的有机物燃烧,分解为简单的无机物,并作定
量测定,通过无机物的质量推算出组成该有机物元素原子的
质量分数,然后计算出该有机物分子所含元素原子的最简
整数比,确定其实验式(又称为最简式)李比希分析方法:O ?H2O CO2李比希分析方法: 可以直接测出有机物中各元素的质量分数.现代元素分析仪
---元素定量分析【例题】
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求该未知物A的 实验式。【思路点拨】
(1) 先确定该有机物中各组成元素原子的质量分数(2) 再求各元素原子的个数比 若要确定它的分子式,还需要什么条件? 实验式:C2H6O1、确定相对分子质量的常见方法:(1)根据标况下气体的密度可求:
M = 22.4L/mol ?ρg/L=22.4ρ g/mol
(2)依据气体的相对密度:
M1 = DM2(D:相对密度)
(3)求混合物的平均式量:
(4)运用质谱法来测定相对分子质量三、确定相对分子质量→确定分子式相对分子质量的确定——质谱法测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。质谱仪它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。【思考与交流】
1、质荷比是什么?2、如何通过读谱确
定相对分子质量?质荷比最大的就是分子离子(即横轴最右边的数值!)[练习2].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷 C 丙烷 D 乙烯( )B【讨论】:C2H6O的可能结构?CH3-O- CH3CH3-CH2 - OH测定方法化学方法:看是否与Na反应现代物理实验方法:红外光谱法 当化合物结构比较复杂时,若用化学方法,时间长、浪费试剂,因此科学上常常采用现代物理实验方法,如:红外光谱、核磁共振氢谱等来确定有机化合物分子的结构。三、分子结构的鉴定1.红外光谱原理:
当红外光照射有机物分子时,有机物分子发生振动吸收,不同的化学键或官能团振动频率不同,因而吸收不同频率的红外光,用红外光谱仪能记录相应信息,得到红外光谱图.1.红外光谱用途:
通过红外光谱图可以推知有机物含有哪些化学键、官能团.例.下图是分子式为C2H6O的有机物的红外光谱谱图,则该有机物的结构简式为:O-H 2.74~3.22微米,C-H 3.38~4.49微米,C-O 1000~1200cm-1 CC2H6O的结构中,含: H C O O HCH3-O- CH3CH3-CH2 - OHC2H6O的结构可能是哪一种呢?[例]下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:C—O—CC=O不对称CH3CH3COOCH2CH3原理:
有机物分子中,处于不同化学环境中的氢原子共振频率不同,因而吸收不同频率的电磁波,在谱图中出现的位置不同,各种氢原子的这种差异被称为化学位移△.
氢原子数越多,吸收能量越大,吸收峰面积越大,用核磁共振仪能记录相应信息.2、核磁共振氢谱
用途:通过核磁共振氢谱可知道有机物分子里含有多少种类型的氢原子,不同类型的氢原子的数目之比。
吸收峰数目 = 氢原子类型数不同吸收峰的面积之比(强度之比)=不同类型氢原子的个数之比CH3-O- CH3CH3-CH2 - OHC2H6O 的核磁共振氢谱图(3)、分析方法 a .氢原子类型=吸收峰数目=3b 峰的面积之比=不同类型的 H的数目比=3:2:1C2H6O的结构可能是哪一种呢?CH3—O—CH3的核磁共振氢谱
[练习1]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是
A HCHO B CH3OH
C HCOOH D CH3COOCH3A[练习2] 分子式为C3H6O2的二元混合物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断混合物的组成可能是(写结构简式) 。CH3COOCH3和CH3CH2COOH【小结】研究有机化合物的一般步骤和方法分离、提纯元素定量分析:确定实验式测定相对分子质量: 确定分子式确定结构式(有哪些官能团,化学键)1. 蒸馏2. 重结晶3. 萃取有几种不同类型的H,及不同类型的 H的数目。质谱法红外光谱法分
子
结
构核磁共振氢谱: 现代元素分析仪补充:有机物分子式的其它推算方法例:已知某烃W(H) ==20%W (C)==80%Mr ==30N(C) :N(H)
=1:3实验式:
CH3化学式(分子式):
C2H61. 实验式法:2. 利用分子通式法:例1: 已知某烷烃的相对分子质量为142。求分子式。例2: 已知某饱和二元醇6.2g,与足量的Na反应,产生
2.24L 的H2(标况下),求分子式。CnH2n+2O2 ~ H2
M 22.4L
6.2 g 2.24L
M=62
CnH2n+2O2 = 62
n=2 C2H6O2 3. 利用规律法:例1: 某气态烃CxHy在120℃时完全燃烧(密闭容器中)
反应前后,压强相等。1 + x + y/4 = x + y/2【练习】 两种气态烃以任意比混合,在105℃时,1L 该混合气体
与9LO2混合,充分燃烧,(密闭容器中)恢复到原来的状况,
所得气体的体积仍是10L.下列组合不符合此条件的是 A. CH4 C2H4 C. C3H4 C2H4
D. C2H6 CH4B. CH4 C3H4D4. 燃烧通式法:例:某含C、H、O的有机物相对于H2 的密度为29。
5.8g该有机物完全燃烧,得CO2 13.2g ,H2O
5.4g 。 求分子式? CxHyOz + (x +y/4-z/2)O2 xCO2 + y/2H2O1x相对分子质量 Mr ==29×2=58n( 有机物) = 0.1mol
n(CO2) = 0.3mol
n(H2O) = 0.3mol
0.10.30.3X=3Y=6z =1C3H6O分析:例:在常温、常压下,50ml三种气态烃的混合物在足量的 O2里,
点燃爆炸,恢复到原来的温度和压强,体积共缩小100ml,
则三种烃的可能组合是
①. CH4 ②. C2H4 ③C3H6
④ C3H4 ⑤C3H8 ⑥C4H6
50100分析:y =41025分析:y =6 在同温同压下,10ml的某气态烃在50ml O2里充分燃烧,得到液态水和35ml的混合气体,则该烃的分子式可能是
A. CH4 B. C2H4 C. C3H8 D. C3H6
D5. 平均值法(求平均分子式): 两种气态烃组成的混合物0.1mol完全燃烧,得
0.16molCO2,0.2molH2O. 则该混合物中( ) A.一定有 CH4 C2H4 C.一定有 C2H2
D. 一定有 CH4B. 一定没有 C2H4 D 分析:0.1mol烃0.16molCO2,C:0.16mol0.2molH2O H: 0.4mol平均分子式: C1.6H41mol烃烃的式量除以14,得到的商及余数可确定6. 商余法:例: 已知某烷烃的相对分子质量为142。求分子式。C10H22分析: 一种气态烷烃一种气态烯烃,其分子式中碳原子数相等。1体积的混合气体完全燃烧,生成 CO2 2体积,水蒸气 2.4 体积。
(1)求烷烃、烯烃的分子式
(2)两种烃的体积比
一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱列如下图:②写出该有机物的可能的结构简式:①写出该有机物的分子式:C4H6OCH3CH=CHCHO说明:这四种峰的面积比是:1:1:1:3【练习】有一有机物的相对分子质量为74,确定分子结构,请写出该分子的结构简式
C—O—C对称CH3对称CH2CH3CH2OCH2CH3
1、下列物质中的杂质(括号中是杂质)可以用什么方法除去?
(1)酒精(水) (2)壬烷(己烷)
(3)KNO3(NaCl ) (4)乙酸乙酯(乙醇)
(5)甲烷(乙烯) (6)NaCl(泥沙)
(7)溴水(水) (8)CO2(HCl)
分离提纯的基本方法:
过滤法、结晶(重结晶)法、
蒸馏(分馏)法、萃取分液法、洗气法、
加热法、 渗析法、盐析法和离子交换法等。3.分离提纯的原则:
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯物)。
(3)易分离(被提纯物与杂质易分离)。
(4)易复原(被提纯物易复原)。
2.常用的分离、提纯物质的方法有哪些?一、分离、提纯物理方法:
利用有机物与杂质物理性质的差异而将它们分开.有机物分离的常用物理方法蒸馏
重结晶
萃取
分液化学方法:
一般是加入或通过某种试剂进行化学反应。1、蒸馏:(2)蒸馏提纯的条件 液态混合物
有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)(1)蒸馏的原理利用混合物的沸点不同,除去难挥发或
不挥发的杂质(3)蒸馏的注意事项:
温度计水银球的部位(蒸馏烧瓶支管处)
烧瓶中放少量沸石或碎瓷片(防止暴沸)
进出水方向(下进上出)
烧瓶中所盛放液体不能超过1/3
实验:含有杂质的工业乙醇的蒸馏例如:含有杂质的工业乙醇的蒸馏
(乙醇的沸点:78.5°C 水的沸点:100°C)
蒸馏提纯乙醇收集77—79°C的馏分实验步骤:
(1)将50ml工业乙醇倒入250ml蒸馏烧瓶中
(2)在烧瓶中投入2粒碎瓷片
(3)装好蒸馏装置(从下往上、从左往右)
(4)往冷凝管中通入冷却水
(5)加热蒸馏,收集77-79°C的馏分乙醇和水的共沸点混合物:沸点78.15℃,乙醇95.6%,水4.4%练习 欲用95.6%的工业酒精制取无水乙醇时,可选用的方法是( )
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏√2.重结晶法 利用被提纯物质与杂质在同一溶剂中的
溶解度不同而将其杂质除去的方法。 关键:选择适当的溶剂。(1)杂质在溶剂中的溶解度很小或很大,易于除去;
(2)被提纯的有机物在此溶剂中的溶解度受温度的
影响较大。该有机物在热溶液中的溶解度较大,冷溶液中的溶解度较小,冷却后易于结晶析出 选择溶剂的条件: 粗苯甲酸中含沙子,根据下列数据,你认为应该怎样除去苯甲酸中的杂质得到苯甲酸? 苯甲酸在不同温度下的溶解度实验步骤:
(1)将1克粗苯甲酸于100ml烧杯中,加入50ml蒸馏水(2)加热至完全溶解,再加入10ml蒸馏水 (3) 趁热过滤到另一个100ml烧杯中(4)将盛有滤液的小烧杯放入装有冷水的大烧杯中,
冷却结晶重结晶观察:
(1)粗苯甲酸的状态:白色固体混有黑色或灰色固体
(2)滤液冷却时的实验现象:
澄清 浑浊 析出晶体
(3)重结晶后苯甲酸的状态:白色片状晶体不纯固体物质残渣
(不溶性杂质)滤液母液
(可溶性杂质和部分被提纯物)晶体
(产品)溶于溶剂,制成饱和溶液,趁热过滤冷却,结晶,
过滤,洗涤洗涤沉淀或晶体的方法:
用胶头滴管往晶体上加蒸馏水直至晶体被浸没,待水完全流出后,重复操作两至三次,直至晶体被洗净。检验洗涤效果:
取最后一次的洗出液,再选择适当的试剂进行检验。3、萃取萃取固—液萃取液—液萃取 用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法. 利用混合物中一种溶质在不同溶剂里的溶解度的不同,将有机物从一种溶剂转移到另一种溶剂中的过程.(1) 萃取(2) 萃取的原理(3)萃取剂选择的条件:① 萃取剂和原溶剂互不相溶和不发生化学反应
溶质在萃取剂中的溶解度大于在原溶剂中的溶
解度
③ 溶质和萃取剂不反应
④ 萃取剂易挥发,与溶质易分离(4)主要仪器:分液漏斗[练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和甲苯
C 汽油和苯 D 硝基苯和水B DD4、色谱法: (阅读P19)
【思考与交流】
1、什么叫色谱法?
2、色谱法常用的吸附剂有哪些?
3、色谱法的种类有哪些?
色谱法
定义:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
吸附剂:碳酸钙、硅胶、氧化铝、活性炭
分类:
(1)薄层色谱法
(2)柱色谱法
有机物(纯净)确定 分子式?首先要确定有机物中含有哪些元素元素分析→确定实验式二、元素分析与相对分子质量的测定1.元素分析:
(1) 定性分析: 主要分析有机物的组成元素
方法:燃烧法 C ---- CO2N------ N2O-----H2OH-----H2O如:产物中只有CO2 和H2O可能2:含C 、 H 、 O三种元素可能1:只含C 、 H 两种元素(2) 定量分析:
测定有机物分子各元素原子的质量分数元素定量分析的原理: 将一定量的有机物燃烧,分解为简单的无机物,并作定
量测定,通过无机物的质量推算出组成该有机物元素原子的
质量分数,然后计算出该有机物分子所含元素原子的最简
整数比,确定其实验式(又称为最简式)李比希分析方法:O ?H2O CO2李比希分析方法: 可以直接测出有机物中各元素的质量分数.现代元素分析仪
---元素定量分析【例题】
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求该未知物A的 实验式。【思路点拨】
(1) 先确定该有机物中各组成元素原子的质量分数(2) 再求各元素原子的个数比 若要确定它的分子式,还需要什么条件? 实验式:C2H6O1、确定相对分子质量的常见方法:(1)根据标况下气体的密度可求:
M = 22.4L/mol ?ρg/L=22.4ρ g/mol
(2)依据气体的相对密度:
M1 = DM2(D:相对密度)
(3)求混合物的平均式量:
(4)运用质谱法来测定相对分子质量三、确定相对分子质量→确定分子式相对分子质量的确定——质谱法测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。质谱仪它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。【思考与交流】
1、质荷比是什么?2、如何通过读谱确
定相对分子质量?质荷比最大的就是分子离子(即横轴最右边的数值!)[练习2].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷 C 丙烷 D 乙烯( )B【讨论】:C2H6O的可能结构?CH3-O- CH3CH3-CH2 - OH测定方法化学方法:看是否与Na反应现代物理实验方法:红外光谱法 当化合物结构比较复杂时,若用化学方法,时间长、浪费试剂,因此科学上常常采用现代物理实验方法,如:红外光谱、核磁共振氢谱等来确定有机化合物分子的结构。三、分子结构的鉴定1.红外光谱原理:
当红外光照射有机物分子时,有机物分子发生振动吸收,不同的化学键或官能团振动频率不同,因而吸收不同频率的红外光,用红外光谱仪能记录相应信息,得到红外光谱图.1.红外光谱用途:
通过红外光谱图可以推知有机物含有哪些化学键、官能团.例.下图是分子式为C2H6O的有机物的红外光谱谱图,则该有机物的结构简式为:O-H 2.74~3.22微米,C-H 3.38~4.49微米,C-O 1000~1200cm-1 CC2H6O的结构中,含: H C O O HCH3-O- CH3CH3-CH2 - OHC2H6O的结构可能是哪一种呢?[例]下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:C—O—CC=O不对称CH3CH3COOCH2CH3原理:
有机物分子中,处于不同化学环境中的氢原子共振频率不同,因而吸收不同频率的电磁波,在谱图中出现的位置不同,各种氢原子的这种差异被称为化学位移△.
氢原子数越多,吸收能量越大,吸收峰面积越大,用核磁共振仪能记录相应信息.2、核磁共振氢谱
用途:通过核磁共振氢谱可知道有机物分子里含有多少种类型的氢原子,不同类型的氢原子的数目之比。
吸收峰数目 = 氢原子类型数不同吸收峰的面积之比(强度之比)=不同类型氢原子的个数之比CH3-O- CH3CH3-CH2 - OHC2H6O 的核磁共振氢谱图(3)、分析方法 a .氢原子类型=吸收峰数目=3b 峰的面积之比=不同类型的 H的数目比=3:2:1C2H6O的结构可能是哪一种呢?CH3—O—CH3的核磁共振氢谱
[练习1]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是
A HCHO B CH3OH
C HCOOH D CH3COOCH3A[练习2] 分子式为C3H6O2的二元混合物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断混合物的组成可能是(写结构简式) 。CH3COOCH3和CH3CH2COOH【小结】研究有机化合物的一般步骤和方法分离、提纯元素定量分析:确定实验式测定相对分子质量: 确定分子式确定结构式(有哪些官能团,化学键)1. 蒸馏2. 重结晶3. 萃取有几种不同类型的H,及不同类型的 H的数目。质谱法红外光谱法分
子
结
构核磁共振氢谱: 现代元素分析仪补充:有机物分子式的其它推算方法例:已知某烃W(H) ==20%W (C)==80%Mr ==30N(C) :N(H)
=1:3实验式:
CH3化学式(分子式):
C2H61. 实验式法:2. 利用分子通式法:例1: 已知某烷烃的相对分子质量为142。求分子式。例2: 已知某饱和二元醇6.2g,与足量的Na反应,产生
2.24L 的H2(标况下),求分子式。CnH2n+2O2 ~ H2
M 22.4L
6.2 g 2.24L
M=62
CnH2n+2O2 = 62
n=2 C2H6O2 3. 利用规律法:例1: 某气态烃CxHy在120℃时完全燃烧(密闭容器中)
反应前后,压强相等。1 + x + y/4 = x + y/2【练习】 两种气态烃以任意比混合,在105℃时,1L 该混合气体
与9LO2混合,充分燃烧,(密闭容器中)恢复到原来的状况,
所得气体的体积仍是10L.下列组合不符合此条件的是 A. CH4 C2H4 C. C3H4 C2H4
D. C2H6 CH4B. CH4 C3H4D4. 燃烧通式法:例:某含C、H、O的有机物相对于H2 的密度为29。
5.8g该有机物完全燃烧,得CO2 13.2g ,H2O
5.4g 。 求分子式? CxHyOz + (x +y/4-z/2)O2 xCO2 + y/2H2O1x相对分子质量 Mr ==29×2=58n( 有机物) = 0.1mol
n(CO2) = 0.3mol
n(H2O) = 0.3mol
0.10.30.3X=3Y=6z =1C3H6O分析:例:在常温、常压下,50ml三种气态烃的混合物在足量的 O2里,
点燃爆炸,恢复到原来的温度和压强,体积共缩小100ml,
则三种烃的可能组合是
①. CH4 ②. C2H4 ③C3H6
④ C3H4 ⑤C3H8 ⑥C4H6
50100分析:y =41025分析:y =6 在同温同压下,10ml的某气态烃在50ml O2里充分燃烧,得到液态水和35ml的混合气体,则该烃的分子式可能是
A. CH4 B. C2H4 C. C3H8 D. C3H6
D5. 平均值法(求平均分子式): 两种气态烃组成的混合物0.1mol完全燃烧,得
0.16molCO2,0.2molH2O. 则该混合物中( ) A.一定有 CH4 C2H4 C.一定有 C2H2
D. 一定有 CH4B. 一定没有 C2H4 D 分析:0.1mol烃0.16molCO2,C:0.16mol0.2molH2O H: 0.4mol平均分子式: C1.6H41mol烃烃的式量除以14,得到的商及余数可确定6. 商余法:例: 已知某烷烃的相对分子质量为142。求分子式。C10H22分析: 一种气态烷烃一种气态烯烃,其分子式中碳原子数相等。1体积的混合气体完全燃烧,生成 CO2 2体积,水蒸气 2.4 体积。
(1)求烷烃、烯烃的分子式
(2)两种烃的体积比
一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱列如下图:②写出该有机物的可能的结构简式:①写出该有机物的分子式:C4H6OCH3CH=CHCHO说明:这四种峰的面积比是:1:1:1:3【练习】有一有机物的相对分子质量为74,确定分子结构,请写出该分子的结构简式
C—O—C对称CH3对称CH2CH3CH2OCH2CH3
