苏教版高中化学选修六实验化学专题4化学反应条件的控制课题3反应条件对化学平衡的影响(共28张PPT)
文档属性
| 名称 | 苏教版高中化学选修六实验化学专题4化学反应条件的控制课题3反应条件对化学平衡的影响(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 225.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-21 17:35:18 | ||
图片预览








文档简介
课件28张PPT。 化学平衡状态的定义:(化学反应的限度)化学平衡的特征:
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
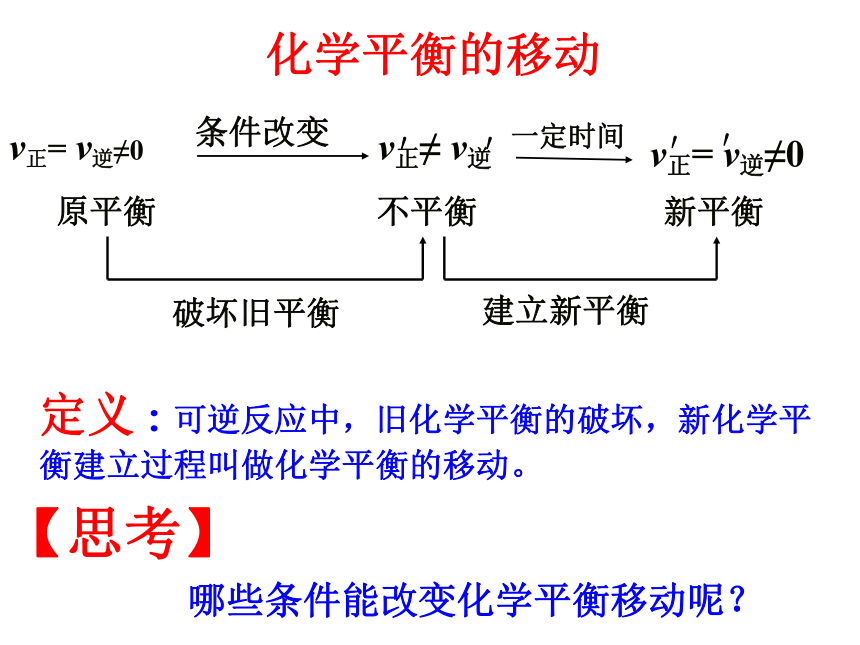
逆等动定变知识回顾v正≠ v逆v正= v逆≠0条件改变 原平衡 不平衡 新平衡
建立新平衡破坏旧平衡v正= v逆≠0′′一定时间′′【思考】哪些条件能改变化学平衡移动呢?定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。化学平衡的移动 反应条件对化学平衡的影响 【学习目标】 1、掌握浓度、温度、压强等条件对化学平衡移动的影响; 2、能够画出简单的化学反应速率和平衡移动的图形; 3、理解勒沙特勒原理的涵义。溶液橙色加深溶液黄色加深合作探究一重铬酸钾溶液中加入酸、碱的颜色变化?Cr2O72-+H2O 2CrO42-+2H+橙色 黄色 增大c(H+)C(Cr2O72-)增大平衡逆向移动减小c(H+)C(CrO42-)增大平衡正向移动⑴浓度的影响
其它条件不变的情况下,增大反应物浓度或减小生成物浓度,平衡均向 方向移动;增大生成物浓度或减小反应物浓度,平衡均向 方向移动。正反应逆反应2. 外界条件影响化学平衡的规律问题一其他条件不变时,如果增大反应物浓度,正、逆反应速率如何变化?平衡如何移动?正、逆反应速率变化与平衡移动有何关系 ?新平衡t2t3t2~t3 : V’正 > V’逆,平衡正向移动t2时刻:随着反应的进行:t3时刻: V’正 =V’逆,建立新的平衡V’正减小, V’逆增大V’正突然增大,V’逆不变c(反)突然增大,讨论:以增大反应物浓度为例增加反应物一定可以改变化学平衡移动? 问题二可逆反应C(s) + H2O(g) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度
②加入更多的碳
③增加H2浓度平衡正向移动,CO浓度增大平衡不移动,CO浓度不变平衡逆向移动,CO浓度减小强调:气体或溶液浓度的改变会引起反应速率的变化,纯固体或纯液体用量的变化不会引起反应速率改变,化学平衡不移动特别强调1、已知在氨水中存在下列平衡:NH3 + H2O NH3· H2O NH4+ + OH- (1)向氨水中加入MgCl2固体,平衡向 移动,
OH-浓度 ,NH4+浓度 。(2)向氨水中加入少量NaOH固体,平衡向 .移动,此时发生的现象是 。正反应方向减小增大逆反应方向有气体放出即学即用 实验现象:温度升高,混合气体颜色————————— , 平衡向———————————— 方向移动;温度降低,混合气体颜色————————————————————— ,平衡向 ———————————— 方向移动NO2浓度增大逆反应(吸热)变浅,正反应(放热)合作探究二NO2浓度减小加深,⑵温度的影响
其它条件不变的情况下,升高温度,平衡向 方向移动,降低温度,平衡向 方向移动。2. 外界条件影响化学平衡的规律吸热反应放热反应新平衡t2t3旧平衡t1(升高温度)增大压强, SO3的分解率 ,平衡向 移动增大压强,氨气含量 ,平衡向 移动450℃时N2与H2反应生成NH3的实验数据 N2 + 3H2 2NH3 6000C, 反应2SO3(g) 2SO2(g)+O2(g)的实验数据结论:增加右减小左资料分析⑶压强的影响
在其它条件不变的情况下,对于反应前后气体总分子数不相等的可逆反应,增大压强(压缩容器容积),平衡向 方向移动;减小压强,平衡向 方向移动。气体总分子数减小气体总分子数增大2. 外界条件影响化学平衡的规律压强一定可以改变化学平衡的移动? 问题 对于反应前后气体总分子数相等的可逆反应(如2HI H2+I2、A(g) + B (g) 2C (g) + D (s) 等),改变压强,化学平衡
各气态物质浓度增大相同倍数各气态物质浓度减小相同倍数不移动, ,但会影响物质浓度。特别强调2NO2(g) N2O4(g)(2体积,红棕色)(1体积,无色)①当加压气体体积缩小时,混合气体颜色先变深是由于 , 后又逐渐变浅是由于 ;
②当减压气体体积增大时,混合气体颜色先变浅是由于 , 后又逐渐变深是由于 。NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动自我评价⑷催化剂的影响2. 外界条件影响化学平衡的规律加入催化剂能缩短达到平衡的时间。加催化剂 加入催化剂能同等程度的加快正、逆反应
速率,化学平衡不移动。向减弱这种改变的方向移动减弱这种改变规
律改变一个条件改变反应条件时平衡移动的方向催化剂对化学平衡无影响,能缩短平衡到达的时间。成果展示正逆缩小增大吸放减小增大增大增大减小减小 如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。这就是勒沙特列原理。 勒夏特列原理(平衡移动原理)①原理的适用范围是:②平衡移动的结果只能减弱(不可能抵消)外界条件的变化。已达平衡的可逆反应且只有一项条件发生变化。学习感悟
通过这节课你有哪些收获?C 2、向平衡体系中3H2 (g) +N2 (g) 2NH3 (g)
恒容时,充入Ne ,则平衡__________;
恒压时,充入Ne ,则平衡__________。 不移动逆向移动1、对任何一个平衡体系,采取下列措施一定引起平衡移动的是( )A、加入一种反应物 B、增加体系的压强
C、升高温度 D、使用催化剂评价反馈3、一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )A、m + n > p
B、A 的转化率降低
C、平衡向正反应方向移动
D、C的体积分数增加 B 4、下列不能用勒夏特列原理解释的是( ) ①棕红色NO2加压后颜色先变深后变浅
②Fe(SCN)3溶液中加入固体KSCN后颜色变深
③氯水宜保存在低温、避光条件下
④SO2催化氧化成SO3的反应,往往加入过量的空气
⑤打开易拉罐有大量气泡冒出
⑥加催化剂,使氮气和氢气在一定条件下转化为氨气 √谢谢大家指导!
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
逆等动定变知识回顾v正≠ v逆v正= v逆≠0条件改变 原平衡 不平衡 新平衡
建立新平衡破坏旧平衡v正= v逆≠0′′一定时间′′【思考】哪些条件能改变化学平衡移动呢?定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。化学平衡的移动 反应条件对化学平衡的影响 【学习目标】 1、掌握浓度、温度、压强等条件对化学平衡移动的影响; 2、能够画出简单的化学反应速率和平衡移动的图形; 3、理解勒沙特勒原理的涵义。溶液橙色加深溶液黄色加深合作探究一重铬酸钾溶液中加入酸、碱的颜色变化?Cr2O72-+H2O 2CrO42-+2H+橙色 黄色 增大c(H+)C(Cr2O72-)增大平衡逆向移动减小c(H+)C(CrO42-)增大平衡正向移动⑴浓度的影响
其它条件不变的情况下,增大反应物浓度或减小生成物浓度,平衡均向 方向移动;增大生成物浓度或减小反应物浓度,平衡均向 方向移动。正反应逆反应2. 外界条件影响化学平衡的规律问题一其他条件不变时,如果增大反应物浓度,正、逆反应速率如何变化?平衡如何移动?正、逆反应速率变化与平衡移动有何关系 ?新平衡t2t3t2~t3 : V’正 > V’逆,平衡正向移动t2时刻:随着反应的进行:t3时刻: V’正 =V’逆,建立新的平衡V’正减小, V’逆增大V’正突然增大,V’逆不变c(反)突然增大,讨论:以增大反应物浓度为例增加反应物一定可以改变化学平衡移动? 问题二可逆反应C(s) + H2O(g) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度
②加入更多的碳
③增加H2浓度平衡正向移动,CO浓度增大平衡不移动,CO浓度不变平衡逆向移动,CO浓度减小强调:气体或溶液浓度的改变会引起反应速率的变化,纯固体或纯液体用量的变化不会引起反应速率改变,化学平衡不移动特别强调1、已知在氨水中存在下列平衡:NH3 + H2O NH3· H2O NH4+ + OH- (1)向氨水中加入MgCl2固体,平衡向 移动,
OH-浓度 ,NH4+浓度 。(2)向氨水中加入少量NaOH固体,平衡向 .移动,此时发生的现象是 。正反应方向减小增大逆反应方向有气体放出即学即用 实验现象:温度升高,混合气体颜色————————— , 平衡向———————————— 方向移动;温度降低,混合气体颜色————————————————————— ,平衡向 ———————————— 方向移动NO2浓度增大逆反应(吸热)变浅,正反应(放热)合作探究二NO2浓度减小加深,⑵温度的影响
其它条件不变的情况下,升高温度,平衡向 方向移动,降低温度,平衡向 方向移动。2. 外界条件影响化学平衡的规律吸热反应放热反应新平衡t2t3旧平衡t1(升高温度)增大压强, SO3的分解率 ,平衡向 移动增大压强,氨气含量 ,平衡向 移动450℃时N2与H2反应生成NH3的实验数据 N2 + 3H2 2NH3 6000C, 反应2SO3(g) 2SO2(g)+O2(g)的实验数据结论:增加右减小左资料分析⑶压强的影响
在其它条件不变的情况下,对于反应前后气体总分子数不相等的可逆反应,增大压强(压缩容器容积),平衡向 方向移动;减小压强,平衡向 方向移动。气体总分子数减小气体总分子数增大2. 外界条件影响化学平衡的规律压强一定可以改变化学平衡的移动? 问题 对于反应前后气体总分子数相等的可逆反应(如2HI H2+I2、A(g) + B (g) 2C (g) + D (s) 等),改变压强,化学平衡
各气态物质浓度增大相同倍数各气态物质浓度减小相同倍数不移动, ,但会影响物质浓度。特别强调2NO2(g) N2O4(g)(2体积,红棕色)(1体积,无色)①当加压气体体积缩小时,混合气体颜色先变深是由于 , 后又逐渐变浅是由于 ;
②当减压气体体积增大时,混合气体颜色先变浅是由于 , 后又逐渐变深是由于 。NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动自我评价⑷催化剂的影响2. 外界条件影响化学平衡的规律加入催化剂能缩短达到平衡的时间。加催化剂 加入催化剂能同等程度的加快正、逆反应
速率,化学平衡不移动。向减弱这种改变的方向移动减弱这种改变规
律改变一个条件改变反应条件时平衡移动的方向催化剂对化学平衡无影响,能缩短平衡到达的时间。成果展示正逆缩小增大吸放减小增大增大增大减小减小 如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。这就是勒沙特列原理。 勒夏特列原理(平衡移动原理)①原理的适用范围是:②平衡移动的结果只能减弱(不可能抵消)外界条件的变化。已达平衡的可逆反应且只有一项条件发生变化。学习感悟
通过这节课你有哪些收获?C 2、向平衡体系中3H2 (g) +N2 (g) 2NH3 (g)
恒容时,充入Ne ,则平衡__________;
恒压时,充入Ne ,则平衡__________。 不移动逆向移动1、对任何一个平衡体系,采取下列措施一定引起平衡移动的是( )A、加入一种反应物 B、增加体系的压强
C、升高温度 D、使用催化剂评价反馈3、一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )A、m + n > p
B、A 的转化率降低
C、平衡向正反应方向移动
D、C的体积分数增加 B 4、下列不能用勒夏特列原理解释的是( ) ①棕红色NO2加压后颜色先变深后变浅
②Fe(SCN)3溶液中加入固体KSCN后颜色变深
③氯水宜保存在低温、避光条件下
④SO2催化氧化成SO3的反应,往往加入过量的空气
⑤打开易拉罐有大量气泡冒出
⑥加催化剂,使氮气和氢气在一定条件下转化为氨气 √谢谢大家指导!
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
