苏教版高中化学选修六实验化学专题6课题1食醋总酸含量的测定--物质的量浓度配制(共24张PPT)
文档属性
| 名称 | 苏教版高中化学选修六实验化学专题6课题1食醋总酸含量的测定--物质的量浓度配制(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 560.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-21 17:22:45 | ||
图片预览







文档简介
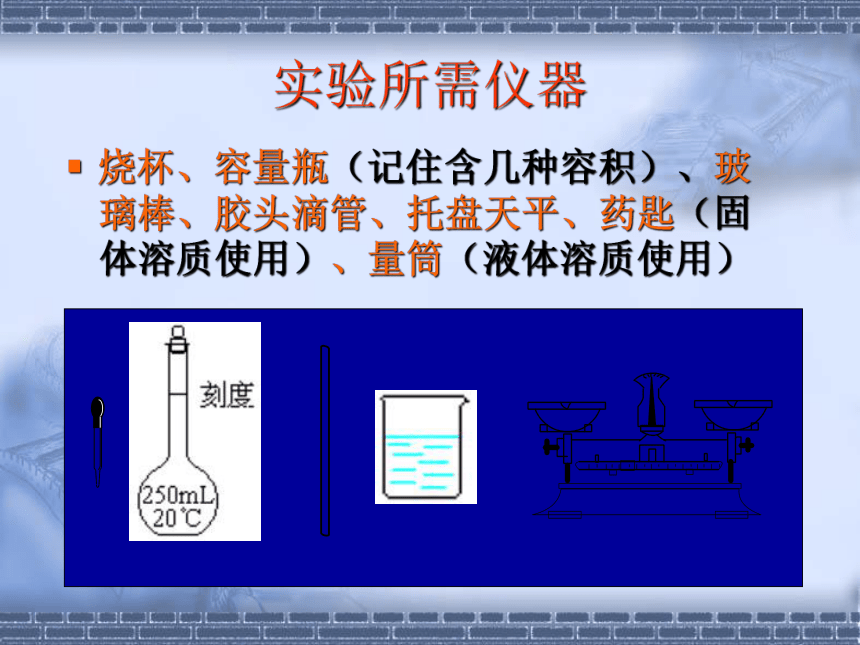
课件24张PPT。物质的量浓度配置实验所需仪器 烧杯、容量瓶(记住含几种容积)、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用) 容量瓶有不同的规格,常用的有:
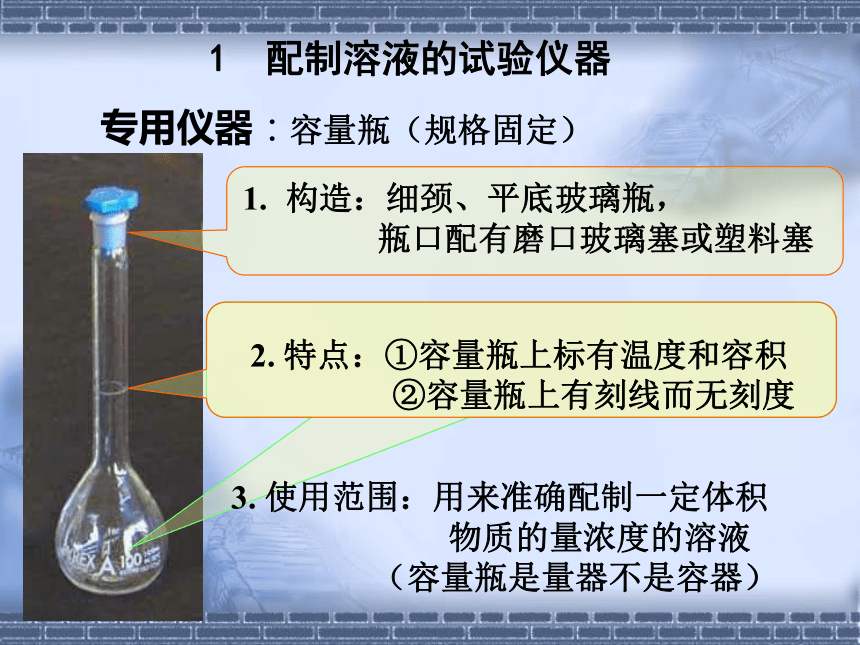
50mL、100mL、250mL、500mL和1000mL 1 配制溶液的试验仪器3. 使用范围:用来准确配制一定体积
物质的量浓度的溶液
(容量瓶是量器不是容器)①使用前要检查是否漏水②溶解或稀释的操作
不能在容量瓶中进行③不能长期存放溶液或进行化学反应注意事项:(1)使用前要调零
(2)两个托盘上各放一张大小相同
的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零3. 溶解注意事项:应在烧杯中溶解,不能在容量瓶中溶解思考:溶解时除了烧杯外还需要哪些仪器?
使用中应注意什么?答:还需要玻璃棒。应当注意搅拌时沿着一定的方 向,玻璃棒不要碰烧杯底和烧杯壁,不要把玻璃棒放在实验台上,以免引入其他杂质。思考:若浓硫酸需要稀释,应如何
操作才是正确的?4. 转移 注意事项:由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。思考:将烧杯中的碳酸钠溶液转移到容量瓶中,
此时溶质是否完全被转移到容量瓶中?
应如何处理?答:还有残留在烧杯壁和玻璃棒上的
碳酸钠未被转移。因此要用蒸馏
水洗涤用过的烧杯和玻璃棒。1两靠一不靠引流4.洗涤用少量蒸馏水洗涤烧杯2~3次,
洗涤液要全部转移到容量瓶中。如果用量筒量取液体药品,量筒不必洗涤。
因为这是量筒的“自然残留液”,若洗涤
后转移到容量瓶中会导致所配溶液浓度偏
高。但是使用量筒时应注意选择的量筒与
量取液体的体积相匹配。5.定容向容量瓶中加入蒸馏水,在距离刻度1~2cm时,
改用胶头滴管滴加蒸馏水至刻度线。思考:若定容时不小心液面超过了刻度线,
能用胶头滴管把多余的液体取出吗?答:必须重新配制定容时应该平视:使得溶液的凹液面的正好与刻度线相切。6. 摇匀将容量瓶盖好塞子,如图示,把容量瓶倒转和摇
动多次,使得溶液混合均匀。思考:摇匀后发现液面低于刻线,能否补充水?答:不能。液面低于刻线是因为还有
水挂壁,当静置后就会恢复原状.7. 装瓶贴签容量瓶中不能存放溶液,因此要把配制好的溶液转移
到试剂瓶中,贴好标签,注明溶液的名称和浓度。步骤 计算:n (Na2CO3) =0.1mol/L×0.1L=0.01mol 则m =0.01mol×106g/mol=1.06g
称量:(复习天平的使用)调零和左物右码及托盘的防腐。根据计算结果,称量Na2CO31.1g固体。
溶解:在烧杯中用适量蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
转移:移入100mL容量瓶,洗涤烧杯2~3次,洗液也加入容量瓶,轻轻晃动容量瓶,使溶液混合均匀
定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度。
摇匀:塞好瓶塞,反复上下颠倒,摇匀,装瓶。误差分析在配制溶液中哪些操作可能引起溶液浓度的误差? ?3 溶液配制的误差分析
1.天平的砝码上沾有其它物质或已锈蚀( )
2.试剂与砝码的左右位置搞错( )
偏高可能偏低下列操作对溶液浓度造成的误差是3. 转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转
入容量瓶( ) 4. 溶解、转移、洗涤时有溶液流出容器外,使溶质
减小( )5.容量瓶在使用前,用蒸馏水洗净,在瓶内有少
量水残留( )
6.定匀摇匀后,静止时发现液面低于刻度线,再加
水到刻度线( )
7. 定容时加水过量越过刻度线,又取出部分溶液,
使液面降至刻度线( )
偏低偏低偏低偏低无影响讨论定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯视仰视俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。小结:容量瓶的使用六忌 一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器) 【问题研讨】:
在用容量瓶配制溶液时,如果加水超过了刻度线,倒出一些溶液,再重新加水到刻度线。这种做法对吗?如果不对,会引起什么误差?
50mL、100mL、250mL、500mL和1000mL 1 配制溶液的试验仪器3. 使用范围:用来准确配制一定体积
物质的量浓度的溶液
(容量瓶是量器不是容器)①使用前要检查是否漏水②溶解或稀释的操作
不能在容量瓶中进行③不能长期存放溶液或进行化学反应注意事项:(1)使用前要调零
(2)两个托盘上各放一张大小相同
的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零3. 溶解注意事项:应在烧杯中溶解,不能在容量瓶中溶解思考:溶解时除了烧杯外还需要哪些仪器?
使用中应注意什么?答:还需要玻璃棒。应当注意搅拌时沿着一定的方 向,玻璃棒不要碰烧杯底和烧杯壁,不要把玻璃棒放在实验台上,以免引入其他杂质。思考:若浓硫酸需要稀释,应如何
操作才是正确的?4. 转移 注意事项:由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。思考:将烧杯中的碳酸钠溶液转移到容量瓶中,
此时溶质是否完全被转移到容量瓶中?
应如何处理?答:还有残留在烧杯壁和玻璃棒上的
碳酸钠未被转移。因此要用蒸馏
水洗涤用过的烧杯和玻璃棒。1两靠一不靠引流4.洗涤用少量蒸馏水洗涤烧杯2~3次,
洗涤液要全部转移到容量瓶中。如果用量筒量取液体药品,量筒不必洗涤。
因为这是量筒的“自然残留液”,若洗涤
后转移到容量瓶中会导致所配溶液浓度偏
高。但是使用量筒时应注意选择的量筒与
量取液体的体积相匹配。5.定容向容量瓶中加入蒸馏水,在距离刻度1~2cm时,
改用胶头滴管滴加蒸馏水至刻度线。思考:若定容时不小心液面超过了刻度线,
能用胶头滴管把多余的液体取出吗?答:必须重新配制定容时应该平视:使得溶液的凹液面的正好与刻度线相切。6. 摇匀将容量瓶盖好塞子,如图示,把容量瓶倒转和摇
动多次,使得溶液混合均匀。思考:摇匀后发现液面低于刻线,能否补充水?答:不能。液面低于刻线是因为还有
水挂壁,当静置后就会恢复原状.7. 装瓶贴签容量瓶中不能存放溶液,因此要把配制好的溶液转移
到试剂瓶中,贴好标签,注明溶液的名称和浓度。步骤 计算:n (Na2CO3) =0.1mol/L×0.1L=0.01mol 则m =0.01mol×106g/mol=1.06g
称量:(复习天平的使用)调零和左物右码及托盘的防腐。根据计算结果,称量Na2CO31.1g固体。
溶解:在烧杯中用适量蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
转移:移入100mL容量瓶,洗涤烧杯2~3次,洗液也加入容量瓶,轻轻晃动容量瓶,使溶液混合均匀
定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度。
摇匀:塞好瓶塞,反复上下颠倒,摇匀,装瓶。误差分析在配制溶液中哪些操作可能引起溶液浓度的误差? ?3 溶液配制的误差分析
1.天平的砝码上沾有其它物质或已锈蚀( )
2.试剂与砝码的左右位置搞错( )
偏高可能偏低下列操作对溶液浓度造成的误差是3. 转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转
入容量瓶( ) 4. 溶解、转移、洗涤时有溶液流出容器外,使溶质
减小( )5.容量瓶在使用前,用蒸馏水洗净,在瓶内有少
量水残留( )
6.定匀摇匀后,静止时发现液面低于刻度线,再加
水到刻度线( )
7. 定容时加水过量越过刻度线,又取出部分溶液,
使液面降至刻度线( )
偏低偏低偏低偏低无影响讨论定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯视仰视俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。小结:容量瓶的使用六忌 一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器) 【问题研讨】:
在用容量瓶配制溶液时,如果加水超过了刻度线,倒出一些溶液,再重新加水到刻度线。这种做法对吗?如果不对,会引起什么误差?
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
