第四单元课题4 化学式和化合价课件(49张PPT)
文档属性
| 名称 | 第四单元课题4 化学式和化合价课件(49张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-22 00:00:00 | ||
图片预览








文档简介
第一课时
第二课时
九年级化学上册
第四单元 自然界的水
课题4 化学式与化合价
Water
H2O
水
?
化学用语
导入新知
第一课时
3. 了解相对分子质量的含义,并能利用相对原子质量进行有关简单计算。
1. 掌握化学式及其含义,能用化学式表示某些常见物质的组成。
2. 了解化合价的含义,并熟记常见元素及原子团的化合价,并能利用化合价推求化学式。
素养目标
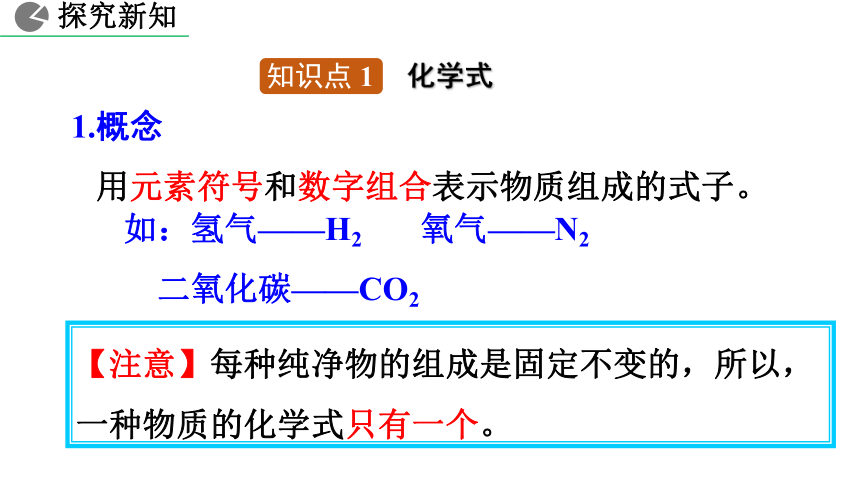
1.概念
用元素符号和数字组合表示物质组成的式子。
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
如:氢气——H2 氧气——N2
二氧化碳——CO2
知识点 1
化学式
探究新知
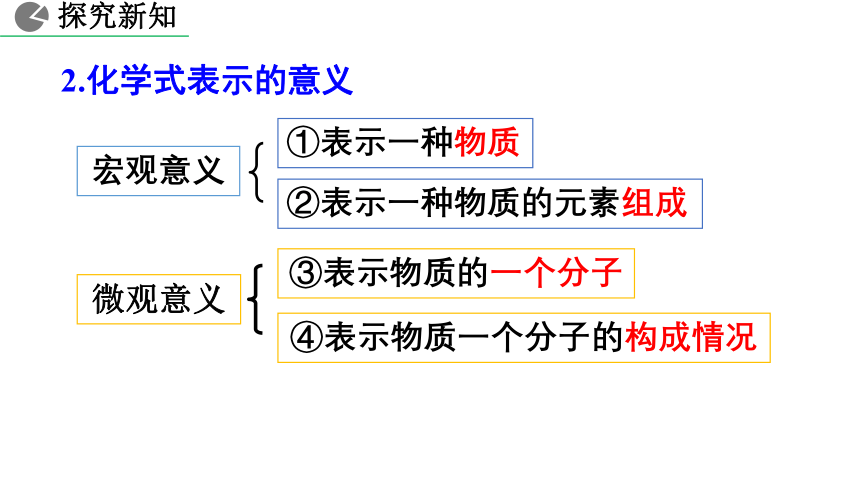
2.化学式表示的意义
微观意义
③表示物质的一个分子
④表示物质一个分子的构成情况
①表示一种物质
②表示一种物质的元素组成
宏观意义
探究新知
表示水这种物质
表示一个水分子
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
宏观意义
探究新知
【思考】“H2O”表示的意义。
微观意义
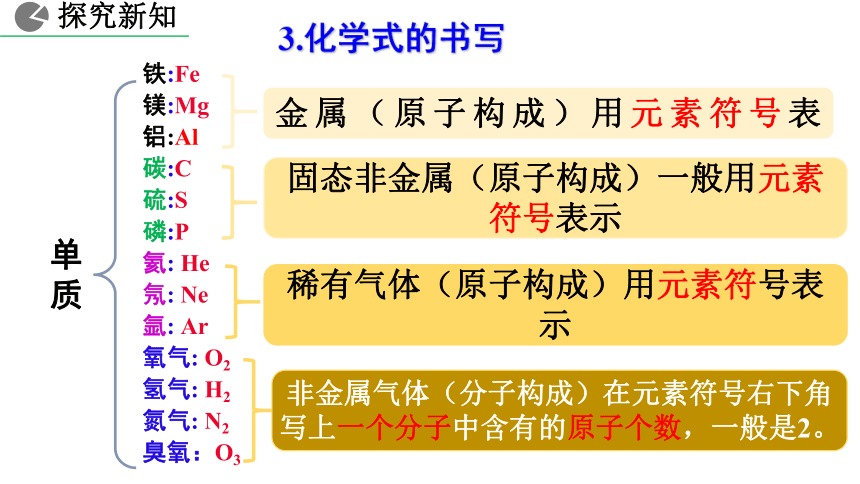
铁:Fe
镁:Mg
铝:Al
碳:C
硫:S
磷:P
氦: He
氖: Ne
氩: Ar
氧气: O2
氢气: H2
氮气: N2
臭氧:O3
3.化学式的书写
单质
探究新知
金属(原子构成)用元素符号表
固态非金属(原子构成)一般用元素符号表示
稀有气体(原子构成)用元素符号表示
非金属气体(分子构成)在元素符号右下角写上一个分子中含有的原子个数,一般是2。
讨论符号H、2H、H2、2H2各具有什么意义?
H 表示氢元素或一个氢原子。
2H 表示2个氢原子。
H2 表示氢气这种物质;氢气是由氢元素组成;一个氢分子;每个氢分子由2个氢原子构成。
2H2 表示2个氢分子
探究新知
2H2O
表示2个水分子
表示每个水分子
中有2个氢原子
探究新知
当化学用语(元素符号、化学式)前面加上数字时,只能表示有几个粒子。
用元素符号或化学式填空。
(1)4个二氧化碳分子
(2)7个铁原子
(3)1个氧分子
(4)5个硫原子
4CO2
7Fe
O2
5S
探究新知
【练一练】
化合物
氧化物的化学式:
如:CO2 SO2 P2O5 Fe3O4 MnO2
写法:氧元素在后,另一种元素在前
读法:氧化某或几氧化几某(几代表数字)
金属元素和非金属组成的化合物:
如:NaCl KCl HgO MgO
写法:金属元素在前,非金属元素在后
读法:某(非金属)化某(金属)或几某化几某
化合物化学式书写原则:顺写反读 读作:某化某
注:原子个数为1省略不写
探究新知
例(2018?兰州)化学式 H2O2 能表示多种意义,下列说法错误的是( )
A.表示双氧水这种物质
B.表示双氧水由氢元素和氧元素组成
C.表示1个双氧水分子
D.表示双氧水由2个H 原子和2个O原子构成
连接中考
巩固练习
化学式
D
分析 双氧水是由双氧水分子构成的,每个双氧水分子是由2个氢原子和2个氧原子构成的。
素养考点 1
知识点 2
化合价
【写一写】写出氯化氢、水、氯化钠及三氧化二铁的化学式,并写出各化合物原子的个数比。
物质 HCl H2O NaCl Fe2O3
原子个数比 1:1 2:1 1:1 2:3
通过观察我们可以得出:物质不同,原子个数比可能不同。
探究新知
【思考】化学式中的各原子个数比为何都是固定且唯一的?
【提示】因为在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
探究新知
化合物均有固定的组成,即形成化合物的元素有固定的原子个数比。元素的化合价是元素的原子在形成化合物时表现出来的一种性质,同时我们要注意一点,化合价是元素的性质,因此,通常称为元素的化合价而不应称为原子的化合价。
探究新知
化合价定义
一种或多种元素的原子结合在一起形成带电的离子,作为一个整体参加化学反应,这样的原子集合称为原子团。化学上常用“根”来命名。如氢氧根(OH-) 、碳酸根(CO32-) 、硫酸根(SO42-) 、硝酸根(NO3-) 、 铵根(NH4+)。
原子团
探究新知
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2、+4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2、+4、+6
镁 Mg +2 氮 N -3、+2、+4、+5
铝 Al +3 磷 P -3、+3、+5
锌 Zn +2 氢氧根 OH- -1
铁 Fe +2、+3 碳酸根 CO32- -2
铜 Cu +2 硝酸根 NO3- -1
氢 H +1 硫酸根 SO42- -2
氧 O -2 铵 根 NH4+ +1
常见元素和原子团的主要化合价
探究新知
钾 钠 银 氢 正一价,
钙 镁 钡 锌 正二价,
铜正一 二 铝正三,
铁正二 三 硅正四,
氟 氯负一 氧负二,
氢氧 硝酸为负一,
碳酸 硫酸为负二,
只有铵根为正一。
探究新知
常见元素化合价的记忆口诀
(氧化亚铁)
(氧化铁、三氧化二铁)
+3
例:FeO Fe2O3
+2
探究新知
化合价的一般规律
1
通常,金属元素显正价,非金属元素显负价;
2
一些元素在不同物质中可显不同的化合价,
例: NH4NO3
-3
+5
探究新知
3
一些元素在同一物质中可显不同的化合价
4
化合物中各种元素化合价的代数和为零;
5
单质中元素的化合价为零。
化合价 离子符号
区别
联系
⑴元素符号的正上方标注化合价
⑵符号在前,数字在后
⑶“1”不能省
⑴元素符号的右上角标注所带电荷
⑵数字在前,符号在后
⑶“1”必须省
同种元素(或原子团)的化合价和对应离子的电荷,通常数值相等,位置相反
探究新知
化合价的标注与离子符号的书写的比较
例1:确定下列化学式中各元素的化合价
MgO Fe2O3 Na2O Al2O3
1. 已知化学式求化合价
+3
+1
+3
+2
-2
-2
-2
-2
探究新知
化合价的应用
例2:写出氧化铝的化学式。
(1)写出组成该物质的元素符号,正价在前、负价在后。
Al O
(2)标上元素的化合价 Al O
(3)计算元素化合价的最小公倍数 2×3=6
(4)求出原子的个数 Al:6÷3=2,O: 6÷2=3
(5)将原子个数分别写在元素符号的右下方 Al2O3
(6)检验: (+3)×2 +(-2)×3=0
2. 已知化合价求化学式
+3
-2
探究新知
例(2018?铁岭)冶炼金属钨常用到白钨矿石,其主要成分是钨酸钙(CaWO4)。钨酸钙中钨(W)的化合价为( )
A.+6 B.﹣6 C.﹣7 D.+7
连接中考
巩固练习
化合价
A
分析 根据化合物中正负化合价代数和为零,钙元素化合价为+2,氧元素的化合价为﹣2,设钨酸钙中钨(W)元素的化合价为x,则:(+2)+x+(﹣2)×4=0,解得x=+6。
素养考点 2
知识点 3
简单化合物的命名
探究新知
元素的原子个数在该元素之前先读出。如:一氧化碳、二氧化碳、五氧化二磷、四氧化三铁。
化学式中元素的名称从右向左读,中间用“化”字连接,读作“某化某”,与书写顺序恰好相反,如:氯化钠、氧化铜。
01
02
3.含有复杂原子团的化合物,要根据其特征来称呼,不需要读出原子或原子团的个数,如:氢氧化钙[Ca(OH)2]、碳酸钙(CaCO3)、硫酸钠(Na2SO4)等。
探究新知
03
含有复杂原子团的化合物,要根据其特征来称呼,不需要读出原子或原子团的个数,如:氢氧化钙[Ca(OH)2]、碳酸钙(CaCO3)、硫酸钠(Na2SO4)等。
探究新知
例 读出以下化学式的名称。
巩固练习
MnO2 CuO SO3
KI Na2CO3 NaNO3
二氧化锰
氧化铜
三氧化硫
碘化钾
硝酸钠
碳酸钠
【思考】化学式能告诉我们有关组成元素之间的质量关系的信息吗?
农业人员在研究氮肥的肥效时首先必须知道所施氮肥的含氮量;化工生产中某些产品质量的分析,也要设法测出其中某种元素的含量。在这些实践活动中,人们常常根据物质化学式来确定组成物质元素之间的质量关系。
第二课时
知识点 4
有关相对分子质量的计算
探究新知
相对分子质量
H2O的意义:
真实质量:
相对分子质量:1个水分子的相对分子质量=2个氢原子的
相对原子质量+1个氧原子的相对原子质量
H2O的相对分子质量=1×2+16×1=18
1个水分子是由2个氢原子和1个氧原子构成的。
1个水分子的质量=2个氢原子的质量+1个氧原子的质量。
定义:化学式中各原子的相对原子质量的总和。
例1:计算O2和CO2的相对分子质量。
O2的相对分子质量=16×2=32
CO2的相对分子质量=12+16×2=44
探究新知
计算相对分子质量
例2:计算CO2中各元素的质量比。
在化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量乘积之间的比值。
m(C)﹕m(O) =
(12×1)∶
= 3∶8
(16×2)
探究新知
计算物质组成元素的质量比
如:硝酸铵(NH4NO3 )中,氮、氢、氧三种元素的比是:
m(N)∶m(H)∶ m(O)
=(14×2)∶(1×4)∶(16×3)
= 7 ∶ 1 ∶ 12
注意某些物质的化学式中,同种元素并不写在一起的,这时要注意原子个数。
探究新知
某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
该元素的相对原子质量(Ar) × 原子个数
化合物的相对分子质量(Mr)
探究新知
计算物质中某元素的质量分数
某元素的
质量分数
ω(某元素)
× 100﹪
=
例3:计算NH4NO3中氮元素的质量分数。
ω(N) =
————
Ar(N)×2
———————
Mr(NH4NO3)
×100%
=
14×2
80
×100%
=
35%
探究新知
例4:求60gNH4NO3中含有的氮的质量。
解:m(N)= m(NH4NO3)×ω(N)
= 60g×35%
= 21g
答:60gNH4NO3中含有的氮的质量为21g。
计算一定质量的物质中某元素的质量
探究新知
例(2018?西藏)花青素(化学式为C15H11O6)具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
(1)一个花青素分子中共有 个原子;
(2)花青素分子中碳、氧元素的质量比为 ;
(3)花青素的相对分子质量为 ;
(4)花青素中氧元素的质量分数为 。(计算结果精确到0.1%)
连接中考
巩固练习
有关相对分子质量的计算
32
分析 花青素中碳、氧元素的质量比为(12×15):(16×6)=180:96=15:8;花青素的相对分子质量为12×15+1×11+16×6=287;花青素中氧元素的质量分数33.4%。
15:8
287
33.4%
素养考点 3
课堂检测
基础巩固题
1. (2018?衡阳)下列符号,既能表示一种元素,又能表示这种元素的一个原子,还能表示一种单质的是( )
A.S B.C60
C.H D.Fe2O3
A
课堂检测
基础巩固题
2. (2018?湘西州)下列物质化学式书写错误的是( )
A.大理石(CaCO3) B.水(H2O)
C.硫酸钠(NaSO4) D.氧化镁(MgO)
C
A
课堂检测
3.(2018?怀化)高铁酸钠(Na2FeO4)是高铁车厢内常用的一种“绿色环保高效”消毒剂,请判断其中铁元素的化合价( )
A.+6 B.+2
C.+3 D.﹣1
基础巩固题
D
课堂检测
基础巩固题
4.(2018?徐州)下列对几种有机化合物的叙述正确的是( )
A.甲烷(CH4)中含有1个碳原子和4个氢原子
B.乙醇(C2H6O)中碳、氢、氧元素的质量比为2:
6:1
C.尿素[CO(NH2)2]的相对分子质量为60g
D.葡萄糖(C6H12O6)中碳元素的质量分数为40%
4
课堂检测
基础巩固题
5.赖氨酸(C6H14N2O2)是人体必需氨基酸之一,能促进人体发育、增强免疫功能,并有提高中枢神经组织功能的作用。
赖氨酸含有 种元素,其中碳、氧元素的质量比是 ,元素质量分数最小的是 元素。
9:4
氢
课堂检测
基础巩固题
6. (2018?抚顺)水杨酸甲酯(化学式C8H8O3)常用作牙膏、化妆品的香料,也用于制止痛药。
请计算:
(1)水杨酸甲酯中碳、氧原子个数比 。
(2)水杨酸甲酯的相对分子质量为 。
8﹕3
152
课堂检测
7.已知X元素的氧化物的化学式为X2O3,则X的氯化物的化学式为 ,X与硫酸根结合的化合物的化学式为 (X元素的化合价不变)。
XCl3
X2(SO4)3
基础巩固题
D
课堂检测
能力提升题
1.对化学用语中“2”的意义,理解正确的是( )
A. 中的“2”表示钙原子的化合价为+2价
B.H2中的“2”表示两个氢原子
C.2Mg中的“2”表示两个镁元素
D.2CO中的“2”表示2个一氧化碳分子
3K
课堂检测
能力提升题
2.元素符号、化学式能简洁地表示物质的组成。请用化学用语填写下列空白。
(1)3个钾原子 ;
(2)6个氯离子 ;
(3)8个五氧化二氮分子 ;
(4)+2价铁的氧化物 。
6Cl-
8N2O5
FeO
282
课堂检测
能力提升题
3.(2018?益阳)我国科学家屠呦呦由于成功提取出青蒿素,获得了 2015年诺贝尔生理学或医学奖。青蒿素的化学式为 C15H22O5。试计算:
(1)青蒿素的相对分子质量为 。
(2)青蒿素中,各元素质量的最简整数比为 m(C):m(H):m(O)=
90:11:40
课堂检测
能力提升题
4. (2018?天津)蛋白质是由丙氨酸(C3H7NO2) 等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)丙氨酸由 种元素组成(写数值);
(2)一个丙氨酸分子中含有 个原子;
(3)丙氨酸的相对分子质量为 ;
(4)丙氨酸中氮、氢元素的质量比为 (写最简比)。
四
13
89
2:1
课堂小结
作业
内容
教材作业
完成课后“练习与应用”题目
自主安排
配套练习册练习题
课后作业
第二课时
九年级化学上册
第四单元 自然界的水
课题4 化学式与化合价
Water
H2O
水
?
化学用语
导入新知
第一课时
3. 了解相对分子质量的含义,并能利用相对原子质量进行有关简单计算。
1. 掌握化学式及其含义,能用化学式表示某些常见物质的组成。
2. 了解化合价的含义,并熟记常见元素及原子团的化合价,并能利用化合价推求化学式。
素养目标
1.概念
用元素符号和数字组合表示物质组成的式子。
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
如:氢气——H2 氧气——N2
二氧化碳——CO2
知识点 1
化学式
探究新知
2.化学式表示的意义
微观意义
③表示物质的一个分子
④表示物质一个分子的构成情况
①表示一种物质
②表示一种物质的元素组成
宏观意义
探究新知
表示水这种物质
表示一个水分子
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
宏观意义
探究新知
【思考】“H2O”表示的意义。
微观意义
铁:Fe
镁:Mg
铝:Al
碳:C
硫:S
磷:P
氦: He
氖: Ne
氩: Ar
氧气: O2
氢气: H2
氮气: N2
臭氧:O3
3.化学式的书写
单质
探究新知
金属(原子构成)用元素符号表
固态非金属(原子构成)一般用元素符号表示
稀有气体(原子构成)用元素符号表示
非金属气体(分子构成)在元素符号右下角写上一个分子中含有的原子个数,一般是2。
讨论符号H、2H、H2、2H2各具有什么意义?
H 表示氢元素或一个氢原子。
2H 表示2个氢原子。
H2 表示氢气这种物质;氢气是由氢元素组成;一个氢分子;每个氢分子由2个氢原子构成。
2H2 表示2个氢分子
探究新知
2H2O
表示2个水分子
表示每个水分子
中有2个氢原子
探究新知
当化学用语(元素符号、化学式)前面加上数字时,只能表示有几个粒子。
用元素符号或化学式填空。
(1)4个二氧化碳分子
(2)7个铁原子
(3)1个氧分子
(4)5个硫原子
4CO2
7Fe
O2
5S
探究新知
【练一练】
化合物
氧化物的化学式:
如:CO2 SO2 P2O5 Fe3O4 MnO2
写法:氧元素在后,另一种元素在前
读法:氧化某或几氧化几某(几代表数字)
金属元素和非金属组成的化合物:
如:NaCl KCl HgO MgO
写法:金属元素在前,非金属元素在后
读法:某(非金属)化某(金属)或几某化几某
化合物化学式书写原则:顺写反读 读作:某化某
注:原子个数为1省略不写
探究新知
例(2018?兰州)化学式 H2O2 能表示多种意义,下列说法错误的是( )
A.表示双氧水这种物质
B.表示双氧水由氢元素和氧元素组成
C.表示1个双氧水分子
D.表示双氧水由2个H 原子和2个O原子构成
连接中考
巩固练习
化学式
D
分析 双氧水是由双氧水分子构成的,每个双氧水分子是由2个氢原子和2个氧原子构成的。
素养考点 1
知识点 2
化合价
【写一写】写出氯化氢、水、氯化钠及三氧化二铁的化学式,并写出各化合物原子的个数比。
物质 HCl H2O NaCl Fe2O3
原子个数比 1:1 2:1 1:1 2:3
通过观察我们可以得出:物质不同,原子个数比可能不同。
探究新知
【思考】化学式中的各原子个数比为何都是固定且唯一的?
【提示】因为在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
探究新知
化合物均有固定的组成,即形成化合物的元素有固定的原子个数比。元素的化合价是元素的原子在形成化合物时表现出来的一种性质,同时我们要注意一点,化合价是元素的性质,因此,通常称为元素的化合价而不应称为原子的化合价。
探究新知
化合价定义
一种或多种元素的原子结合在一起形成带电的离子,作为一个整体参加化学反应,这样的原子集合称为原子团。化学上常用“根”来命名。如氢氧根(OH-) 、碳酸根(CO32-) 、硫酸根(SO42-) 、硝酸根(NO3-) 、 铵根(NH4+)。
原子团
探究新知
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2、+4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2、+4、+6
镁 Mg +2 氮 N -3、+2、+4、+5
铝 Al +3 磷 P -3、+3、+5
锌 Zn +2 氢氧根 OH- -1
铁 Fe +2、+3 碳酸根 CO32- -2
铜 Cu +2 硝酸根 NO3- -1
氢 H +1 硫酸根 SO42- -2
氧 O -2 铵 根 NH4+ +1
常见元素和原子团的主要化合价
探究新知
钾 钠 银 氢 正一价,
钙 镁 钡 锌 正二价,
铜正一 二 铝正三,
铁正二 三 硅正四,
氟 氯负一 氧负二,
氢氧 硝酸为负一,
碳酸 硫酸为负二,
只有铵根为正一。
探究新知
常见元素化合价的记忆口诀
(氧化亚铁)
(氧化铁、三氧化二铁)
+3
例:FeO Fe2O3
+2
探究新知
化合价的一般规律
1
通常,金属元素显正价,非金属元素显负价;
2
一些元素在不同物质中可显不同的化合价,
例: NH4NO3
-3
+5
探究新知
3
一些元素在同一物质中可显不同的化合价
4
化合物中各种元素化合价的代数和为零;
5
单质中元素的化合价为零。
化合价 离子符号
区别
联系
⑴元素符号的正上方标注化合价
⑵符号在前,数字在后
⑶“1”不能省
⑴元素符号的右上角标注所带电荷
⑵数字在前,符号在后
⑶“1”必须省
同种元素(或原子团)的化合价和对应离子的电荷,通常数值相等,位置相反
探究新知
化合价的标注与离子符号的书写的比较
例1:确定下列化学式中各元素的化合价
MgO Fe2O3 Na2O Al2O3
1. 已知化学式求化合价
+3
+1
+3
+2
-2
-2
-2
-2
探究新知
化合价的应用
例2:写出氧化铝的化学式。
(1)写出组成该物质的元素符号,正价在前、负价在后。
Al O
(2)标上元素的化合价 Al O
(3)计算元素化合价的最小公倍数 2×3=6
(4)求出原子的个数 Al:6÷3=2,O: 6÷2=3
(5)将原子个数分别写在元素符号的右下方 Al2O3
(6)检验: (+3)×2 +(-2)×3=0
2. 已知化合价求化学式
+3
-2
探究新知
例(2018?铁岭)冶炼金属钨常用到白钨矿石,其主要成分是钨酸钙(CaWO4)。钨酸钙中钨(W)的化合价为( )
A.+6 B.﹣6 C.﹣7 D.+7
连接中考
巩固练习
化合价
A
分析 根据化合物中正负化合价代数和为零,钙元素化合价为+2,氧元素的化合价为﹣2,设钨酸钙中钨(W)元素的化合价为x,则:(+2)+x+(﹣2)×4=0,解得x=+6。
素养考点 2
知识点 3
简单化合物的命名
探究新知
元素的原子个数在该元素之前先读出。如:一氧化碳、二氧化碳、五氧化二磷、四氧化三铁。
化学式中元素的名称从右向左读,中间用“化”字连接,读作“某化某”,与书写顺序恰好相反,如:氯化钠、氧化铜。
01
02
3.含有复杂原子团的化合物,要根据其特征来称呼,不需要读出原子或原子团的个数,如:氢氧化钙[Ca(OH)2]、碳酸钙(CaCO3)、硫酸钠(Na2SO4)等。
探究新知
03
含有复杂原子团的化合物,要根据其特征来称呼,不需要读出原子或原子团的个数,如:氢氧化钙[Ca(OH)2]、碳酸钙(CaCO3)、硫酸钠(Na2SO4)等。
探究新知
例 读出以下化学式的名称。
巩固练习
MnO2 CuO SO3
KI Na2CO3 NaNO3
二氧化锰
氧化铜
三氧化硫
碘化钾
硝酸钠
碳酸钠
【思考】化学式能告诉我们有关组成元素之间的质量关系的信息吗?
农业人员在研究氮肥的肥效时首先必须知道所施氮肥的含氮量;化工生产中某些产品质量的分析,也要设法测出其中某种元素的含量。在这些实践活动中,人们常常根据物质化学式来确定组成物质元素之间的质量关系。
第二课时
知识点 4
有关相对分子质量的计算
探究新知
相对分子质量
H2O的意义:
真实质量:
相对分子质量:1个水分子的相对分子质量=2个氢原子的
相对原子质量+1个氧原子的相对原子质量
H2O的相对分子质量=1×2+16×1=18
1个水分子是由2个氢原子和1个氧原子构成的。
1个水分子的质量=2个氢原子的质量+1个氧原子的质量。
定义:化学式中各原子的相对原子质量的总和。
例1:计算O2和CO2的相对分子质量。
O2的相对分子质量=16×2=32
CO2的相对分子质量=12+16×2=44
探究新知
计算相对分子质量
例2:计算CO2中各元素的质量比。
在化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量乘积之间的比值。
m(C)﹕m(O) =
(12×1)∶
= 3∶8
(16×2)
探究新知
计算物质组成元素的质量比
如:硝酸铵(NH4NO3 )中,氮、氢、氧三种元素的比是:
m(N)∶m(H)∶ m(O)
=(14×2)∶(1×4)∶(16×3)
= 7 ∶ 1 ∶ 12
注意某些物质的化学式中,同种元素并不写在一起的,这时要注意原子个数。
探究新知
某元素的质量分数,就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
该元素的相对原子质量(Ar) × 原子个数
化合物的相对分子质量(Mr)
探究新知
计算物质中某元素的质量分数
某元素的
质量分数
ω(某元素)
× 100﹪
=
例3:计算NH4NO3中氮元素的质量分数。
ω(N) =
————
Ar(N)×2
———————
Mr(NH4NO3)
×100%
=
14×2
80
×100%
=
35%
探究新知
例4:求60gNH4NO3中含有的氮的质量。
解:m(N)= m(NH4NO3)×ω(N)
= 60g×35%
= 21g
答:60gNH4NO3中含有的氮的质量为21g。
计算一定质量的物质中某元素的质量
探究新知
例(2018?西藏)花青素(化学式为C15H11O6)具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
(1)一个花青素分子中共有 个原子;
(2)花青素分子中碳、氧元素的质量比为 ;
(3)花青素的相对分子质量为 ;
(4)花青素中氧元素的质量分数为 。(计算结果精确到0.1%)
连接中考
巩固练习
有关相对分子质量的计算
32
分析 花青素中碳、氧元素的质量比为(12×15):(16×6)=180:96=15:8;花青素的相对分子质量为12×15+1×11+16×6=287;花青素中氧元素的质量分数33.4%。
15:8
287
33.4%
素养考点 3
课堂检测
基础巩固题
1. (2018?衡阳)下列符号,既能表示一种元素,又能表示这种元素的一个原子,还能表示一种单质的是( )
A.S B.C60
C.H D.Fe2O3
A
课堂检测
基础巩固题
2. (2018?湘西州)下列物质化学式书写错误的是( )
A.大理石(CaCO3) B.水(H2O)
C.硫酸钠(NaSO4) D.氧化镁(MgO)
C
A
课堂检测
3.(2018?怀化)高铁酸钠(Na2FeO4)是高铁车厢内常用的一种“绿色环保高效”消毒剂,请判断其中铁元素的化合价( )
A.+6 B.+2
C.+3 D.﹣1
基础巩固题
D
课堂检测
基础巩固题
4.(2018?徐州)下列对几种有机化合物的叙述正确的是( )
A.甲烷(CH4)中含有1个碳原子和4个氢原子
B.乙醇(C2H6O)中碳、氢、氧元素的质量比为2:
6:1
C.尿素[CO(NH2)2]的相对分子质量为60g
D.葡萄糖(C6H12O6)中碳元素的质量分数为40%
4
课堂检测
基础巩固题
5.赖氨酸(C6H14N2O2)是人体必需氨基酸之一,能促进人体发育、增强免疫功能,并有提高中枢神经组织功能的作用。
赖氨酸含有 种元素,其中碳、氧元素的质量比是 ,元素质量分数最小的是 元素。
9:4
氢
课堂检测
基础巩固题
6. (2018?抚顺)水杨酸甲酯(化学式C8H8O3)常用作牙膏、化妆品的香料,也用于制止痛药。
请计算:
(1)水杨酸甲酯中碳、氧原子个数比 。
(2)水杨酸甲酯的相对分子质量为 。
8﹕3
152
课堂检测
7.已知X元素的氧化物的化学式为X2O3,则X的氯化物的化学式为 ,X与硫酸根结合的化合物的化学式为 (X元素的化合价不变)。
XCl3
X2(SO4)3
基础巩固题
D
课堂检测
能力提升题
1.对化学用语中“2”的意义,理解正确的是( )
A. 中的“2”表示钙原子的化合价为+2价
B.H2中的“2”表示两个氢原子
C.2Mg中的“2”表示两个镁元素
D.2CO中的“2”表示2个一氧化碳分子
3K
课堂检测
能力提升题
2.元素符号、化学式能简洁地表示物质的组成。请用化学用语填写下列空白。
(1)3个钾原子 ;
(2)6个氯离子 ;
(3)8个五氧化二氮分子 ;
(4)+2价铁的氧化物 。
6Cl-
8N2O5
FeO
282
课堂检测
能力提升题
3.(2018?益阳)我国科学家屠呦呦由于成功提取出青蒿素,获得了 2015年诺贝尔生理学或医学奖。青蒿素的化学式为 C15H22O5。试计算:
(1)青蒿素的相对分子质量为 。
(2)青蒿素中,各元素质量的最简整数比为 m(C):m(H):m(O)=
90:11:40
课堂检测
能力提升题
4. (2018?天津)蛋白质是由丙氨酸(C3H7NO2) 等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)丙氨酸由 种元素组成(写数值);
(2)一个丙氨酸分子中含有 个原子;
(3)丙氨酸的相对分子质量为 ;
(4)丙氨酸中氮、氢元素的质量比为 (写最简比)。
四
13
89
2:1
课堂小结
作业
内容
教材作业
完成课后“练习与应用”题目
自主安排
配套练习册练习题
课后作业
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
