苏教版高中化学选修四1.1化学反应中的热效应(共38张PPT)
文档属性
| 名称 | 苏教版高中化学选修四1.1化学反应中的热效应(共38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-23 09:23:59 | ||
图片预览










文档简介
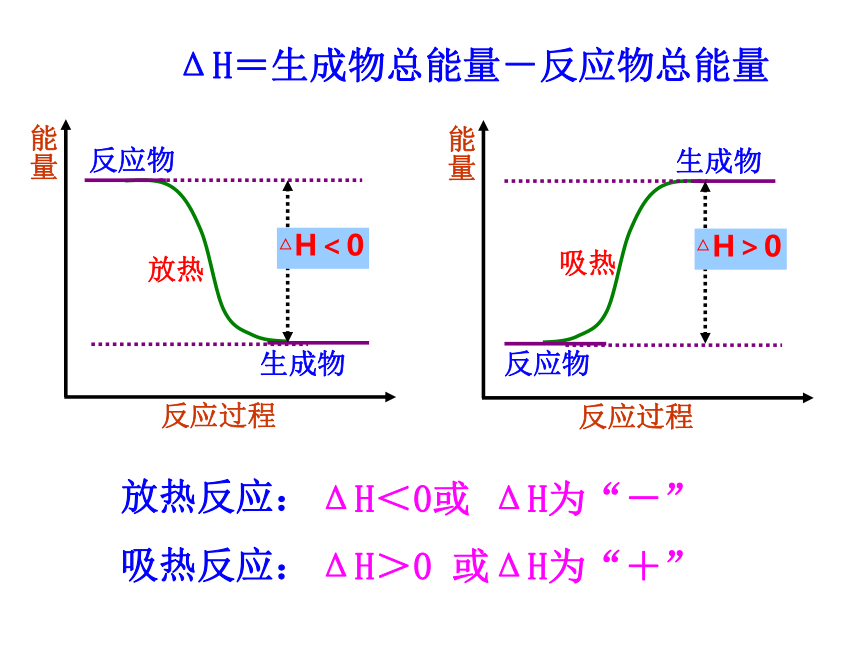
课件38张PPT。庆典时的烟火神七发射钢铁的炼制专题一 化学反应与能量变化第一单元 化学反应中的热效应第一课时【复习回顾】: 化学反应过程中既有物质变化,同时又总是伴随着能量的变化.在我们以前所学的化学反应中有哪些是放热反应?有哪些是吸热反应?活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应.吸热反应:放热反应:多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳.一、反应热和焓变1.反应热:2.焓变:在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变.符号:?H单位:kJ/mol在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量.【交流与讨论】:化学反应中为什么会有能量的变化?放热反应:
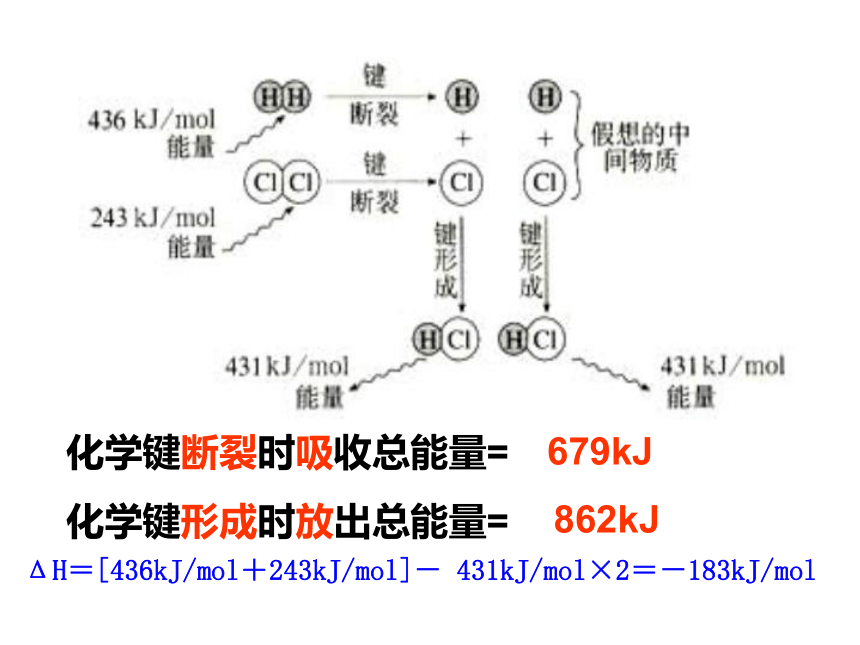
吸热反应:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”放热△H<0ΔH=生成物总能量-反应物总能量吸热△H>0一、反应热和焓变1.反应热:2.焓变:在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变.符号:?H单位:kJ/mol规定:当?H为“-”( ?H<0)时,为放热反应;当?H为“+”( ?H>0)时,为吸热反应.在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量.【交流与讨论】:化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的总能量不同.ΔH=[436kJ/mol+243kJ/mol]- 431kJ/mol×2=-183kJ/mol化学键断裂时吸收总能量=
化学键形成时放出总能量=679kJ862kJ反应物分子断键时吸收的能量反应物分子断键时吸收的能量〈生成物分子成键时释放的能量>生成物分子成键时释放的能量放热反应吸热反应从键能角度看:ΔH=反应物总键能-生成物总键能【交流与讨论】:化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的能量不同.微观: 旧的化学键断裂时所吸收的能量与新的化学键形成时所放出的能量不同.2、下列变化中,属于吸热反应的是( )
A.反应物的总能量大于生成物的总能量 的反应
B.酸碱中和
C.反应物总键能小于 生成物总键能
D.焦炭与高温水蒸气反应
D[练习]
1、下列变化中,属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.ΔH>0的反应B1、概念:能够表示反应热的化学方程式叫做热化学方程式。热化学方程式与化学方程式有什么不同?
如何正确书写热化学方程式?
热化学方程式有什么意义?第2页的交流与讨论二、热化学方程式: 热化学方程式与化学方程式的差别:
1、△H只用在热化学方程式中,并写在右边4、热化学方程式中的化学计量数可以是整数,也可以是分数。它表示的是物质的量2、热化学方程式中必须注明物质的聚集状态
气态(g)、液态(l)、固态(s)、溶液(aq)3、书写热化学方程式时应注明反应的温度和压强。如果不注明温度和压强,则表示是在250C、101KPa条件下的反应热。第3页的交流与讨论5、△H与参加反应的物质的物质的量有关。同一化学反应中,热化学方程式中物质的化学计量数不同, △H也不同。化学计量数加倍,△H也要加倍。第二课时4、已知键能:
N≡N 946KJ/mol, H-H 436KJ/mol,
H-N 391KJ/mol,写出合成氨反应的热化学方程式。N2(g)+3H2(g)==2NH3(g) △H=-92kJ·mol-11、氢气在氯气燃烧生成1摩氯化氢气体,放出92.3kJ的热量练习:1、写出下列反应的热化学方程式(25℃,101kPa时).
2、氢氧化钠溶液与硫酸溶液反应生成2摩液态水,放出114.6KJ的热量3、1摩石墨转化为金刚石固体需吸收1.5KJ的热量3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或吸收的热量。质→量→能H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+b kJ/mol 例1. 已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是A一、热化学方程式的书写及正误判断2、正误判断高考怎么考?1、热化学方程式的书写课本P4A练1、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1 例2 已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B二、有关热化学方程式的计算例4、在一定条件下,CO和CH4燃烧的热化学方程式
分别为:
2CO(g)+O2(g)=2CO2(g) △H=-566KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧
时,释放的热量为( )
A.2912KJ B.2953KJ C.3236KJ D.3867KJB2.(06·江苏)下列各组热化学方程式中,化学反应的△H前者大于后者的是
①.C(s)+O2(g)===CO2(g) △H1 C(s)+ O2(g)===CO(g) △H2
②.S(s)+O2(g)===SO2(g) △H3 S(g)+O2(g)===SO2(g) △H4
③.H2(g)+ O2(g)===H2O(l) △H5 2H2(g)+ O2(g)===2H2O(l) △H6
④.CaCO3(s)= CaO(s)+CO2(g) △H7
CaO(s)+H2O(l) =Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③c三、反应热大小的比较课堂练习B2、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol?1):P—P:198 P—O:360 O=O:498则反应P4(白磷)+3O2= P4O6的反应热△H为 ( )
A.-1638 kJ·mol?1
B.+1638 kJ·mol?1
C.-126 kJ·mol?1
D.+126 kJ·mol?1A若干化学键的键能( kJ/mol,25 ℃ )H2 + F2 = 2HF H2 + Cl2 = 2HCl
3、预测当生成2 mol HF和2 mol HCl时,哪个反应放出的热量多?
石墨能否自动转化为金刚石?总结:反应热数据的用途1、 判断反应发生的难易2、反应C(石墨) → C(金刚石)是吸热反应,由此可知
A、石墨比金刚石更稳定
B、金刚石和石墨可以相互转化
C、金刚石比石墨稳定
D、金刚石和石墨不能相互转化AB2、计算燃料的用量反应热可以由实验测得,也可以用其他办法得到。
第三课时标准燃烧热定义:在101kPa时,l mol物质完全燃烧的反应热.衡量燃料燃烧放出热量大小的物理量是?热值定义:在101kPa时,l g物质完全燃烧的反应热.能源的充分利用.2、注意:
① 燃烧的条件是在101kPa;
② 标准燃烧热:燃料是以1mol作为标准,因此书写热化学方程式时,其它物质的化学计量数可用分数表示;
③ 物质燃烧都是放热反应,所以表达物质燃烧时的△H均为负值;
④ 燃烧要完全:C元素转化为CO2,而不是CO;H元素转化为H2O(l),而不是H2O(g), N元素转化为N2。
如:H2(g)+ 1/2 O2(g) = H2O(l); △H =-285.8 kJ/mol【思考】燃烧放出的热量与标准燃烧热有什么不同?答:① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而标准燃烧热规定是1 mol的可燃物;
② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究标准燃烧热必须是生成稳定的氧化物。
所以,不同量的同一物质完全燃烧,放出的热量可能不同,但标准燃烧热是一定的。概念辨析:1.下列各组物质的标准燃烧热相等的是:( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素B285.8 kJ/mol由于传统能源逐渐枯竭,因此,开发新能源显得十分重要。氢能是一种重要的新能源,请讨论下列问题;
1、根据第9页表1—3计算H2、CH4及C2H2的热值
2、讨论H2作为能源有何优点,目前在利用氢能
方面主要存在什么问题? H2、CH4及C2H2的热值分别为142.9kJ·g-1、
55.6kJ·g-1、50kJ·g-1。
说明H2作为能源具有热值高的特点。另外,
用H2作为能源还具有无污染的特点。目前在应用氢能方面最重要的问题是H2的制取。 能源的充分利用.1、什么是能源?能源的作用?
就是能提供能量的自然资源,包括化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平。
[议一议]城市家用燃料使用气体燃料比使用煤、煤球等固体燃料有什么好处?答案:1.首先,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率。
其次,气体燃料便于管道运输、使用方便(易点燃、易熄灭)、无渣无尘、清洁卫生。
第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物(NOx)、粉尘,造成大气污染,住宅环境、居室空气的污染则更严重。
推广使用天然气(相对于管道煤气和液化气)为什么是城市燃气的发展方向? 管道煤气是一种清洁燃料,然而这是相对于住宅、居室环境而言的,从城市大环境看,并没有改善城市大气的污染程度。原因很简单,制造煤气要燃煤,使用煤气没有降低城市的煤炭消耗量,原来一家一户煤球炉的废气仅仅变成由数家煤气厂排放而已。液化气是发热量最高的优质清洁燃料,但液化气使用不便,且要消耗宝贵的石油资源,天然气则是一种既有管道煤气的方便,又有液化气无毒、发热量高的优点且不易爆的燃料。
吸热反应:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”放热△H<0ΔH=生成物总能量-反应物总能量吸热△H>0一、反应热和焓变1.反应热:2.焓变:在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变.符号:?H单位:kJ/mol规定:当?H为“-”( ?H<0)时,为放热反应;当?H为“+”( ?H>0)时,为吸热反应.在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量.【交流与讨论】:化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的总能量不同.ΔH=[436kJ/mol+243kJ/mol]- 431kJ/mol×2=-183kJ/mol化学键断裂时吸收总能量=
化学键形成时放出总能量=679kJ862kJ反应物分子断键时吸收的能量反应物分子断键时吸收的能量〈生成物分子成键时释放的能量>生成物分子成键时释放的能量放热反应吸热反应从键能角度看:ΔH=反应物总键能-生成物总键能【交流与讨论】:化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的能量不同.微观: 旧的化学键断裂时所吸收的能量与新的化学键形成时所放出的能量不同.2、下列变化中,属于吸热反应的是( )
A.反应物的总能量大于生成物的总能量 的反应
B.酸碱中和
C.反应物总键能小于 生成物总键能
D.焦炭与高温水蒸气反应
D[练习]
1、下列变化中,属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.ΔH>0的反应B1、概念:能够表示反应热的化学方程式叫做热化学方程式。热化学方程式与化学方程式有什么不同?
如何正确书写热化学方程式?
热化学方程式有什么意义?第2页的交流与讨论二、热化学方程式: 热化学方程式与化学方程式的差别:
1、△H只用在热化学方程式中,并写在右边4、热化学方程式中的化学计量数可以是整数,也可以是分数。它表示的是物质的量2、热化学方程式中必须注明物质的聚集状态
气态(g)、液态(l)、固态(s)、溶液(aq)3、书写热化学方程式时应注明反应的温度和压强。如果不注明温度和压强,则表示是在250C、101KPa条件下的反应热。第3页的交流与讨论5、△H与参加反应的物质的物质的量有关。同一化学反应中,热化学方程式中物质的化学计量数不同, △H也不同。化学计量数加倍,△H也要加倍。第二课时4、已知键能:
N≡N 946KJ/mol, H-H 436KJ/mol,
H-N 391KJ/mol,写出合成氨反应的热化学方程式。N2(g)+3H2(g)==2NH3(g) △H=-92kJ·mol-11、氢气在氯气燃烧生成1摩氯化氢气体,放出92.3kJ的热量练习:1、写出下列反应的热化学方程式(25℃,101kPa时).
2、氢氧化钠溶液与硫酸溶液反应生成2摩液态水,放出114.6KJ的热量3、1摩石墨转化为金刚石固体需吸收1.5KJ的热量3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或吸收的热量。质→量→能H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+b kJ/mol 例1. 已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是A一、热化学方程式的书写及正误判断2、正误判断高考怎么考?1、热化学方程式的书写课本P4A练1、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1 例2 已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B二、有关热化学方程式的计算例4、在一定条件下,CO和CH4燃烧的热化学方程式
分别为:
2CO(g)+O2(g)=2CO2(g) △H=-566KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧
时,释放的热量为( )
A.2912KJ B.2953KJ C.3236KJ D.3867KJB2.(06·江苏)下列各组热化学方程式中,化学反应的△H前者大于后者的是
①.C(s)+O2(g)===CO2(g) △H1 C(s)+ O2(g)===CO(g) △H2
②.S(s)+O2(g)===SO2(g) △H3 S(g)+O2(g)===SO2(g) △H4
③.H2(g)+ O2(g)===H2O(l) △H5 2H2(g)+ O2(g)===2H2O(l) △H6
④.CaCO3(s)= CaO(s)+CO2(g) △H7
CaO(s)+H2O(l) =Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③c三、反应热大小的比较课堂练习B2、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol?1):P—P:198 P—O:360 O=O:498则反应P4(白磷)+3O2= P4O6的反应热△H为 ( )
A.-1638 kJ·mol?1
B.+1638 kJ·mol?1
C.-126 kJ·mol?1
D.+126 kJ·mol?1A若干化学键的键能( kJ/mol,25 ℃ )H2 + F2 = 2HF H2 + Cl2 = 2HCl
3、预测当生成2 mol HF和2 mol HCl时,哪个反应放出的热量多?
石墨能否自动转化为金刚石?总结:反应热数据的用途1、 判断反应发生的难易2、反应C(石墨) → C(金刚石)是吸热反应,由此可知
A、石墨比金刚石更稳定
B、金刚石和石墨可以相互转化
C、金刚石比石墨稳定
D、金刚石和石墨不能相互转化AB2、计算燃料的用量反应热可以由实验测得,也可以用其他办法得到。
第三课时标准燃烧热定义:在101kPa时,l mol物质完全燃烧的反应热.衡量燃料燃烧放出热量大小的物理量是?热值定义:在101kPa时,l g物质完全燃烧的反应热.能源的充分利用.2、注意:
① 燃烧的条件是在101kPa;
② 标准燃烧热:燃料是以1mol作为标准,因此书写热化学方程式时,其它物质的化学计量数可用分数表示;
③ 物质燃烧都是放热反应,所以表达物质燃烧时的△H均为负值;
④ 燃烧要完全:C元素转化为CO2,而不是CO;H元素转化为H2O(l),而不是H2O(g), N元素转化为N2。
如:H2(g)+ 1/2 O2(g) = H2O(l); △H =-285.8 kJ/mol【思考】燃烧放出的热量与标准燃烧热有什么不同?答:① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而标准燃烧热规定是1 mol的可燃物;
② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究标准燃烧热必须是生成稳定的氧化物。
所以,不同量的同一物质完全燃烧,放出的热量可能不同,但标准燃烧热是一定的。概念辨析:1.下列各组物质的标准燃烧热相等的是:( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素B285.8 kJ/mol由于传统能源逐渐枯竭,因此,开发新能源显得十分重要。氢能是一种重要的新能源,请讨论下列问题;
1、根据第9页表1—3计算H2、CH4及C2H2的热值
2、讨论H2作为能源有何优点,目前在利用氢能
方面主要存在什么问题? H2、CH4及C2H2的热值分别为142.9kJ·g-1、
55.6kJ·g-1、50kJ·g-1。
说明H2作为能源具有热值高的特点。另外,
用H2作为能源还具有无污染的特点。目前在应用氢能方面最重要的问题是H2的制取。 能源的充分利用.1、什么是能源?能源的作用?
就是能提供能量的自然资源,包括化石燃料(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平。
[议一议]城市家用燃料使用气体燃料比使用煤、煤球等固体燃料有什么好处?答案:1.首先,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率。
其次,气体燃料便于管道运输、使用方便(易点燃、易熄灭)、无渣无尘、清洁卫生。
第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物(NOx)、粉尘,造成大气污染,住宅环境、居室空气的污染则更严重。
推广使用天然气(相对于管道煤气和液化气)为什么是城市燃气的发展方向? 管道煤气是一种清洁燃料,然而这是相对于住宅、居室环境而言的,从城市大环境看,并没有改善城市大气的污染程度。原因很简单,制造煤气要燃煤,使用煤气没有降低城市的煤炭消耗量,原来一家一户煤球炉的废气仅仅变成由数家煤气厂排放而已。液化气是发热量最高的优质清洁燃料,但液化气使用不便,且要消耗宝贵的石油资源,天然气则是一种既有管道煤气的方便,又有液化气无毒、发热量高的优点且不易爆的燃料。
