化学人教版选修3课件:第2章第2节分子的立体结构(40张)
文档属性
| 名称 | 化学人教版选修3课件:第2章第2节分子的立体结构(40张) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-25 00:00:00 | ||
图片预览









文档简介
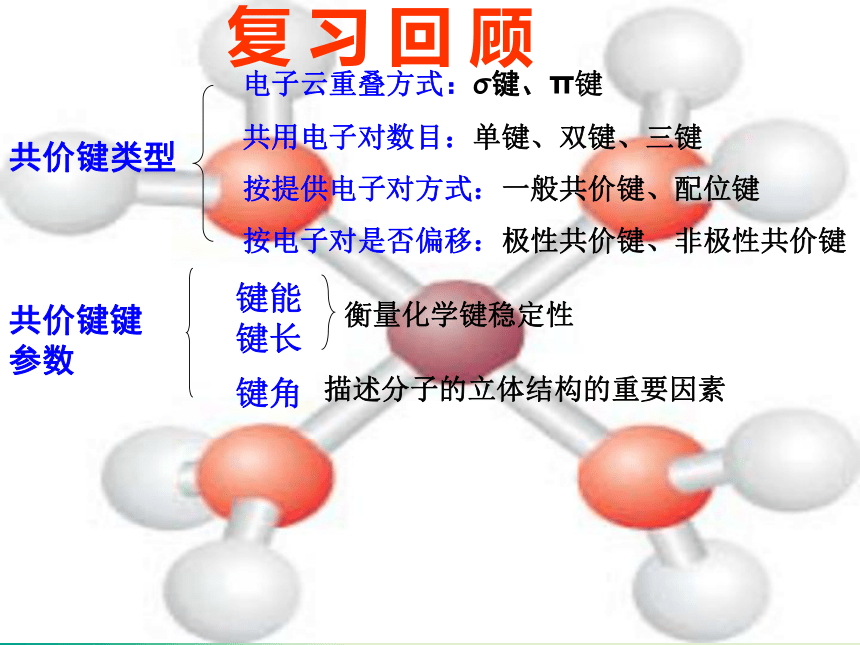
课件40张PPT。分子的立体构型复 习 回 顾共价键类型电子云重叠方式:σ键、π键
共用电子对数目:单键、双键、三键
按提供电子对方式:一般共价键、配位键
按电子对是否偏移:极性共价键、非极性共价键
共价键键参数
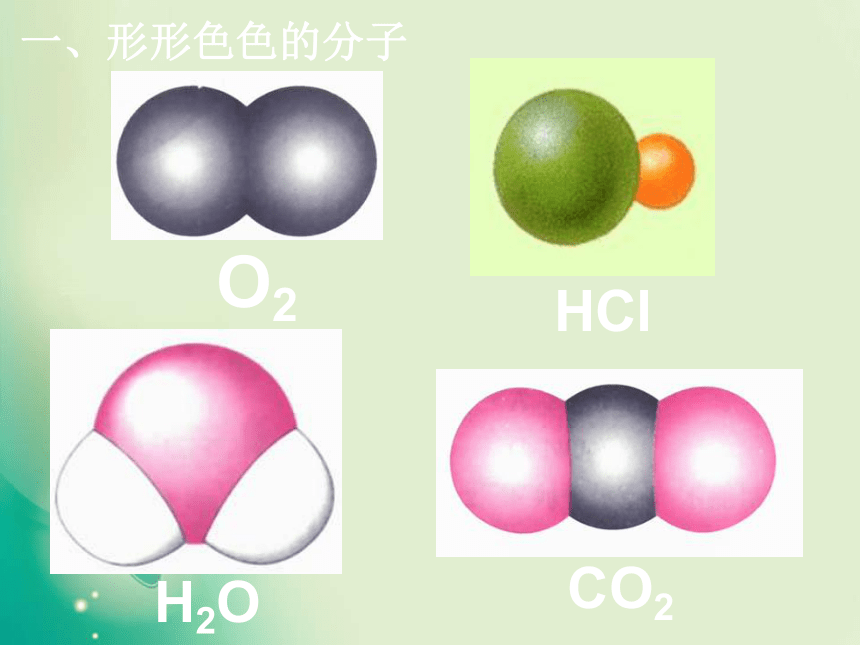
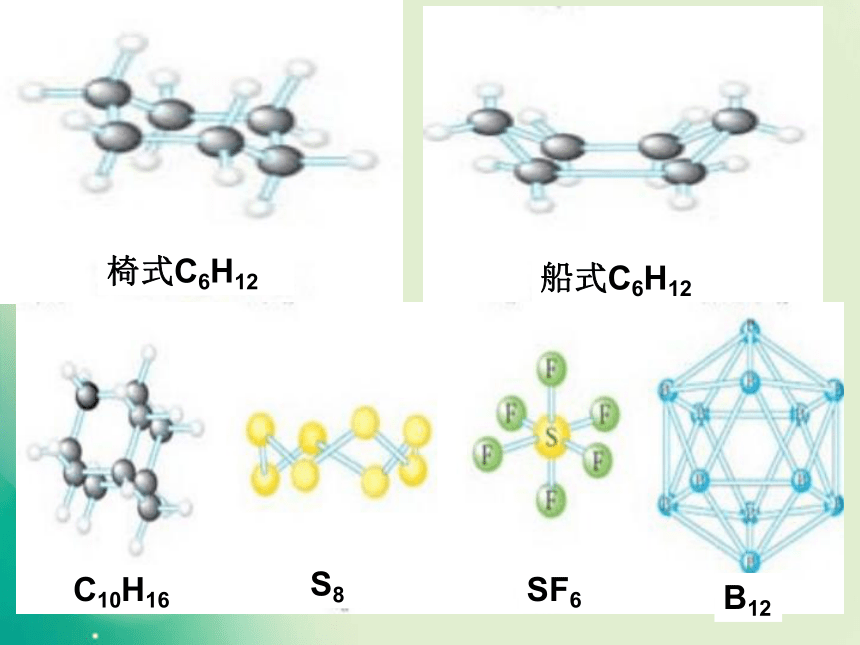
键能键长键角衡量化学键稳定性描述分子的立体结构的重要因素一、形形色色的分子O2HClH2OCO2C2H2CH2OCOCl2NH3P4CH4CH3CH2OHCH3COOHC6H6C8H8CH3OHC60C20C40C70P4O6P4O10椅式C6H12船式C6H12C10H16S8SF6B12思考: 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因? 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间结构:O=C=OH-O-H无有有无无直线形V 形三角
锥 形 平面
三角形 正
四面体 基本要点
ABn 型分子(离子)中的中心原子A周围的价层电子对的几何构型,主要取决于价层电子对数(n),价电子对尽量远离,使它们之间斥力最小,能量最低,物质才能最稳定。 二、价层电子对互斥模型(VSEPR)价电子对的空间构型电子对数目:2 3 4
空间构型:直线 平面三角形 正四面体
180o 1200 109.50
价电子对的空间构型电子对数目:5 6
空间构型:三角双锥 正八面体
1200 900 900
价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子直线型平面三角型四面体BeCl2 BF3 BCl3 CH2OCH4 CCl4 NH4+ 中心原子上的价电子都用于形成共价键,它们的立体结构可用中心原子周围的原子数 n 来预测,概括如下:
ABn 立体结构 范例
n=2
n=3
n=4直线形平面三角形正四面体形BeCl2 BF3 BCl3 CH2OCH4 CCl4 NH4+2、另一类是中心原子上有孤对电子(未 用于形成共价键的电子对)的分子,如 :
H2O和NH3,中心原子上的孤对电子也 占据中心原子周围的空间,并与成键电 子对互相排斥。
例如,H2O和NH3的中心原子分别有2 对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。三角锥V型H2O H2SNH3 H3O+中心原子有孤对电子 利用价层电子对互斥理论预测分子或离子
的空间构型的步骤如下:
(1)确定中心原子的价层电子对数:
价层电子对数=(中心原子的价电子数+
配位原子提供的电子总数±离子电荷数 )/2
①中心原子的价电子数=主族序数
例如:B:3, C: 4,N:5,O:6,
X:7,稀有气体:8
②配位原子提供的价电子数:
H与卤素:1,O与S为0 。
③当中心原子的价电子数为奇数时,单电子当作电子对看待。
④ 对于含有双键或叁键的分子,价电子对互斥理论仍能使用,但双键、叁键都作为一个电子对计算。在定性推测分子构型时,可以忽略孤对电子和成键电子、单键和多重键的区别,但在考虑键角等一些问题时,应考虑这些差别。(2)确定电子对的空间构型:根据中心原子A周围的电子对数,从图中找出电子对的空间构型。
(3)确定中心原子的孤对电子对数,推断分子的空间构型:把配位原子排布在中心原子周围,每一电子对连接一配位原子,未结合的电子对就是孤电子对。
(4) 根据电子对间排斥力大小,确定排斥力最小的稳定结构。中心原子价层电子对排布和ABn 型共价分子构型2平面
三角
形
2 0 AB2直线形 BeCl23 0 AB32 1 AB2价层电子对数平面三角形 BF3
角形
PbCl2
布四
面
体
4 0 AB4 3 1 AB3 2 2 AB2正四面体 CH4三角锥形 NH3
角形
H2O
直线形平面三角形正四面体V 形三角锥形小结:二、价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V 型平面三角形三角锥形四面体正四面体正四面体SO42-04正四面体三、 杂化轨道理论简介CH4分子的结构:杂化轨道概念:原子形成分子时,同一原子中能量
相近的不同类型的原子轨在成键过
程中混合组成新的原子轨道
CH4分子形成C: 2s22px12py13pz2s2p1ssp32s2p激发杂化H: 1s1sp3-s键合 能量相近:ns,np ns,np,ns (n-1)d,ns,np 成键能力变大:轨道形状发生了变化sp3 杂化 同一个原子的一个 ns 轨道与三个 np 轨道进行杂化组合
为 sp3 杂化轨道。sp3 杂化轨道间的夹角是 109?28’,分子的几
何构型为正四面体形。CH4分子形成2s2pC的基态2s2p激发态109°28’外层电子结构: 2s 2px 2py 2pz 2s 2px 2py 2pz
(a)碳的sp3 杂化轨道(b)甲烷正四
面体模型sp 杂化
同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。BeCl2分子形成激发2s2pBe基态2s2p激发态碳的sp杂化轨道sp杂化:夹角为180°的直线形杂化轨道。sp2 杂化 同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合
为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120度,分子的几何
构型为平面正三角形2s2pB的基态BF3分子形成碳的sp2杂化轨道sp2杂化:三个夹角为120°的平面三角形杂化轨道。sp2杂化1下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4B2.对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D课后思考:
1.CH4、H2O、NH3分子中的中心原子均采用SP3杂化,但为何键角存在差异?
2.用VSEPR理论预测ClO-、ClO2-、ClO3-、ClO4-空间构型、中心原子杂化类型。
再见
祝同学们学习进步
共用电子对数目:单键、双键、三键
按提供电子对方式:一般共价键、配位键
按电子对是否偏移:极性共价键、非极性共价键
共价键键参数
键能键长键角衡量化学键稳定性描述分子的立体结构的重要因素一、形形色色的分子O2HClH2OCO2C2H2CH2OCOCl2NH3P4CH4CH3CH2OHCH3COOHC6H6C8H8CH3OHC60C20C40C70P4O6P4O10椅式C6H12船式C6H12C10H16S8SF6B12思考: 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因? 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间结构:O=C=OH-O-H无有有无无直线形V 形三角
锥 形 平面
三角形 正
四面体 基本要点
ABn 型分子(离子)中的中心原子A周围的价层电子对的几何构型,主要取决于价层电子对数(n),价电子对尽量远离,使它们之间斥力最小,能量最低,物质才能最稳定。 二、价层电子对互斥模型(VSEPR)价电子对的空间构型电子对数目:2 3 4
空间构型:直线 平面三角形 正四面体
180o 1200 109.50
价电子对的空间构型电子对数目:5 6
空间构型:三角双锥 正八面体
1200 900 900
价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子直线型平面三角型四面体BeCl2 BF3 BCl3 CH2OCH4 CCl4 NH4+ 中心原子上的价电子都用于形成共价键,它们的立体结构可用中心原子周围的原子数 n 来预测,概括如下:
ABn 立体结构 范例
n=2
n=3
n=4直线形平面三角形正四面体形BeCl2 BF3 BCl3 CH2OCH4 CCl4 NH4+2、另一类是中心原子上有孤对电子(未 用于形成共价键的电子对)的分子,如 :
H2O和NH3,中心原子上的孤对电子也 占据中心原子周围的空间,并与成键电 子对互相排斥。
例如,H2O和NH3的中心原子分别有2 对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。三角锥V型H2O H2SNH3 H3O+中心原子有孤对电子 利用价层电子对互斥理论预测分子或离子
的空间构型的步骤如下:
(1)确定中心原子的价层电子对数:
价层电子对数=(中心原子的价电子数+
配位原子提供的电子总数±离子电荷数 )/2
①中心原子的价电子数=主族序数
例如:B:3, C: 4,N:5,O:6,
X:7,稀有气体:8
②配位原子提供的价电子数:
H与卤素:1,O与S为0 。
③当中心原子的价电子数为奇数时,单电子当作电子对看待。
④ 对于含有双键或叁键的分子,价电子对互斥理论仍能使用,但双键、叁键都作为一个电子对计算。在定性推测分子构型时,可以忽略孤对电子和成键电子、单键和多重键的区别,但在考虑键角等一些问题时,应考虑这些差别。(2)确定电子对的空间构型:根据中心原子A周围的电子对数,从图中找出电子对的空间构型。
(3)确定中心原子的孤对电子对数,推断分子的空间构型:把配位原子排布在中心原子周围,每一电子对连接一配位原子,未结合的电子对就是孤电子对。
(4) 根据电子对间排斥力大小,确定排斥力最小的稳定结构。中心原子价层电子对排布和ABn 型共价分子构型2平面
三角
形
2 0 AB2直线形 BeCl23 0 AB32 1 AB2价层电子对数平面三角形 BF3
角形
PbCl2
布四
面
体
4 0 AB4 3 1 AB3 2 2 AB2正四面体 CH4三角锥形 NH3
角形
H2O
直线形平面三角形正四面体V 形三角锥形小结:二、价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V 型平面三角形三角锥形四面体正四面体正四面体SO42-04正四面体三、 杂化轨道理论简介CH4分子的结构:杂化轨道概念:原子形成分子时,同一原子中能量
相近的不同类型的原子轨在成键过
程中混合组成新的原子轨道
CH4分子形成C: 2s22px12py13pz2s2p1ssp32s2p激发杂化H: 1s1sp3-s键合 能量相近:ns,np ns,np,ns (n-1)d,ns,np 成键能力变大:轨道形状发生了变化sp3 杂化 同一个原子的一个 ns 轨道与三个 np 轨道进行杂化组合
为 sp3 杂化轨道。sp3 杂化轨道间的夹角是 109?28’,分子的几
何构型为正四面体形。CH4分子形成2s2pC的基态2s2p激发态109°28’外层电子结构: 2s 2px 2py 2pz 2s 2px 2py 2pz
(a)碳的sp3 杂化轨道(b)甲烷正四
面体模型sp 杂化
同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。BeCl2分子形成激发2s2pBe基态2s2p激发态碳的sp杂化轨道sp杂化:夹角为180°的直线形杂化轨道。sp2 杂化 同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合
为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120度,分子的几何
构型为平面正三角形2s2pB的基态BF3分子形成碳的sp2杂化轨道sp2杂化:三个夹角为120°的平面三角形杂化轨道。sp2杂化1下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4B2.对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D课后思考:
1.CH4、H2O、NH3分子中的中心原子均采用SP3杂化,但为何键角存在差异?
2.用VSEPR理论预测ClO-、ClO2-、ClO3-、ClO4-空间构型、中心原子杂化类型。
再见
祝同学们学习进步
