3.3.1 乙醇(课件)
图片预览







文档简介
新人教版 必修二
中国的酒文化博大精深,源远流长!
关于酒的诗词名句有很多,同学们知道哪些?说说看。
中国的酒文化博大精深,源远流长!
关于酒的诗词名句有很多,同学们知道哪些?说说看。
当歌,人生几何?
(曹操)
明月几时有, 问青天。(苏轼)
借问 何处有,牧童遥指杏花村( 杜牧)
把酒
酒家
对酒
白日放歌需 ,青春作伴好还乡。(杜甫)
纵酒
含酒精:3% ~5%
含酒精:38% ~ 65%
75%
95%
身边的乙醇
生活中的乙醇
观察生活中含乙醇的物质,了解乙醇
的色、态、味、挥发性、溶解性,归
纳乙醇的物理性质。
气 味 :
无色透明
特殊香味
液体
比水小,20℃时,0.7893g/cm3
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发
颜 色 :
溶解性:
密 度:
挥发性:
状 态:
一、乙醇的物理性质
78.5℃
—117.3℃
熔 点:
沸 点:
俗 称:
酒精
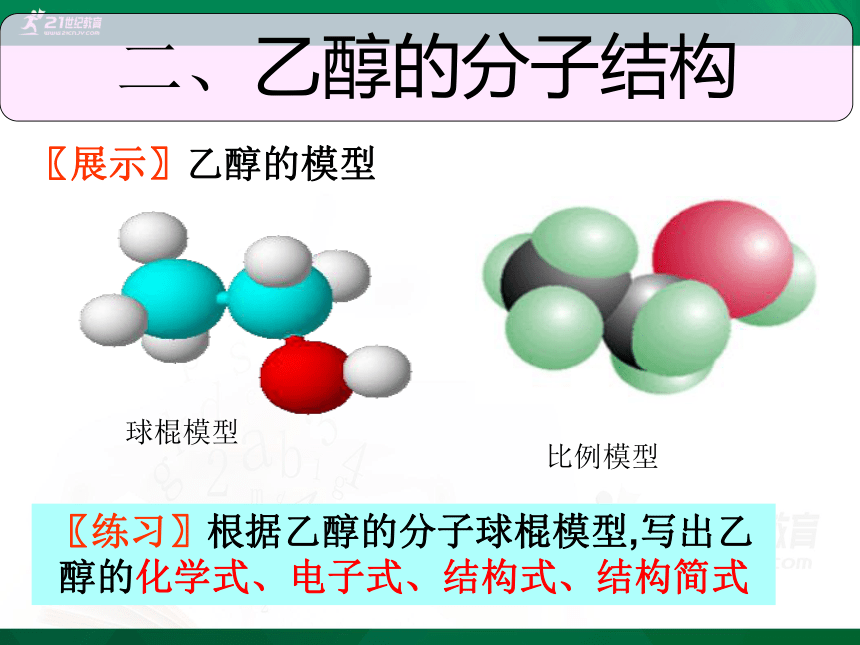
球棍模型
比例模型
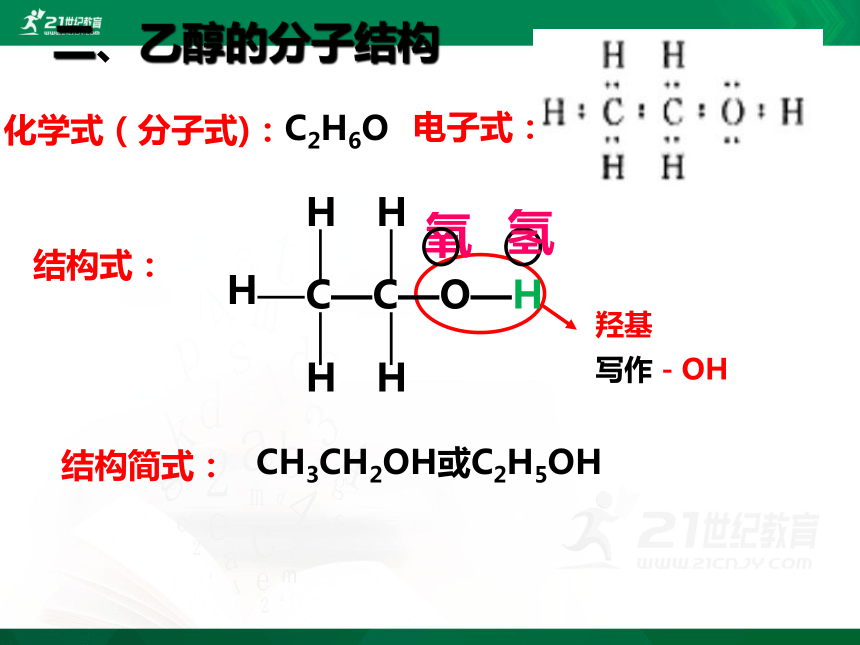
二、乙醇的分子结构
〖展示〗乙醇的模型
〖练习〗根据乙醇的分子球棍模型,写出乙醇的化学式、电子式、结构式、结构简式
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
结构简式:
化学式(分子式):
C2H6O
电子式:
二、乙醇的分子结构
羟基
写作-OH
氢
氧
H—C—C—O—H
H H
H H
H—C—C—H
H H
H H
乙醇
乙烷
观察比较:
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
官能团 :决定有机化合物的化学特性的原子或原子团。
-X卤原子 -OH羟基 -NO2硝基 -COOH羧基
C=C
—C≡C—
练 习
下列几种物质是否属于烃的衍生物?
如果是烃的衍生物,请指出它们的官能团。
A. B. C.CH3CH3 D.CH3CH2OH
—NO2 NH2
E. F. G. CH2COOH
1.乙醇中有几种类型的化学键,是极性键还是非极性键?
思考
1
2
3
4
四种类型,碳碳单键是非极性的,其余均为极性的
不同种原子构成
同种原子构成
2.乙醇结构可以分为两部分:乙基-CH2CH3 羟基-OH
乙醇分子可看作是:
乙烷分子里的一个氢原子被羟基所取代的产物
水分子里一个氢原子被烷基所取代的产物
C—C—O—H
H
H
H
H
H
-OH基团:羟基
陶 丽琼:
思考:乙醇同时具有烷烃和水的部分结构,那么乙醇的性质是和烷烃类似还是和水类似?
煤油是烷烃的混合物,钠保存在煤油中说明钠不与烷烃反应
水与金属钠在常温下反应
乙醇能否与钠反应呢?
实验:乙醇与金属钠的反应
金属钠的变化 气体燃烧现象 检验产物
水
乙
醇
沉入底部
不熔成小球
不发出响声
燃烧时发出淡蓝色火焰
浮在水面上
熔成小球
四处游动
发出响声
燃烧时发出淡蓝色火焰
加入酚酞,变红,说明有氢气和碱性物质生成
干燥小烧杯有水珠,澄清石灰水无明显变化,说明生成的气体是氢气
想一想:实验现象说明了什么问题?
1、钠浮在水面上,而沉在乙醇中
说明:水的密度>钠的密度>乙醇的密度
2、钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基上的H原子与水分子中H原子的活泼性:
3、乙醇与钠反应的性质是由它的 决定的
-OH结构
乙醇<水
1、乙醇与钠的反应
[练习]其它活泼金属如钾、镁等也可与乙醇反应,均可产生H2 ,请写出钾与乙醇反应的化学方程式。
2CH3CH2OH + 2K 2CH3CH2OK + H2↑
乙醇钾
三、乙醇的化学性质
H— C — C— O —H ,
H H
H H
①处O—H
键断开
①
2CH3CH2OH + 2 Na → 2CH3CH2ONa + H2↑
乙醇钠
[思考]乙醇和钠的反应属于什么反应类型?
2.乙醇的氧化反应
2CO2 +3H2O
C2H5OH + 3 O2
点燃
1)乙醇在空气中燃烧? (彻底氧化)
现象:乙醇在空气里容易燃烧,火焰为淡蓝色,同时放出大量的热。
酒精燃料飞机
酒精火锅
实验3-3把灼热的铜丝插入乙醇中,观察铜丝颜色变化,并小心闻试管中液体产生的气味。
2)乙醇的催化氧化
2.乙醇的氧化反应
观察与思考
实 验 步 骤
现 象
1、铜丝在火焰上加热
2、加热后铜丝插入乙醇中
铜丝由红色变成
铜丝由黑色又变成 ,
黑色
红色
反复多次,闻到刺激性气味
?思考 (1)铜丝发生了什么反应?
(2)刺激性气味的物质是什么?
(3)铜丝的作用?
(4)乙醇分子的断键位置?
铜丝
变黑
2Cu + O2 2CuO
△
又变红
产生刺激性气味
CH3CHO
乙醛
总反应方程式:
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
(2)乙醇的催化氧化
Cu或Ag作催化剂
H O-H
│ │
H-C-C-H
│ │
H H
Cu O
+
Cu
+
H2O
△
+
H O
│
H-C-C-H
│
H
醛基 -CHO
两个氢脱去与O结合成H2O
H— C— C—H
O
H
H
H
H
3
1
同时断 键
1
3
乙醇催化氧化的断键位置
2
2
H
H—C—C—H
O
H
注意:
醇发生催化氧化时去掉2个H原子。连接-OH官能团的碳原子上必须有H,才能发生催化氧化。
乙醇的用途
乙 醇
饮 料
化工原料
溶 剂
医 药
燃料
消毒剂(75%的乙醇溶液)
饮料
与Na反应
催化氧化
归纳整理 ---乙醇的结构和性质
羟基:-OH
官能团
决定有机物的主要化学性质
如:-X,-OH,-NO2
写出下列反应的方程式:
(1)乙醇与金属钠反应: ,
属于 反应;
(2)乙醇燃烧:
,
属于 反应;
(3)乙醇的催化氧化:
,
属于 反应;
2CH3CH2OH + 2 Na → 2CH3CH2ONa + H2↑
取代
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
氧化
氧化
2CO2 +3H2O
C2H5OH + 3 O2
点燃
课堂巩固
练习
1、不含C2H5OH的饮料被称为软饮料,下列饮料中属于软饮料的是
A.啤酒 B. 可乐 C. 葡萄酒 D. 酸奶
B D
2、将等量的铜片在酒精灯上加热后,分别插
入下列溶液中,放置片刻后铜片质量与加
热前相同的是
A.硝酸 B. 无水乙醇 C. 石灰水 D. 盐酸
B
课堂反馈
1、乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
(1)与活泼金属反应键 断裂
(2) CH3CH2OH 燃烧键 断裂
(3)在Cu或Ag催化下和O2反应键 断裂
C—C—O—H
H
H
H
H
H
①
②
③
④
⑤
①
① ③
全部
4、酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是( )
A、浓硫酸 B、浓NaOH溶液
C、碱石灰 D、无水氯化钙
C
3、下列金属不能与乙醇反应生成氢气的是
A 钠 B 铜 C 镁 D 铝
B
5、下列有关乙醇的物理性质应用中不正确的是( )
A. 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B. 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C. 由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D. 由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
A
分液:是把两种互不混溶的液体分离开的操作方法.例如,用四氯化碳分离碘水中的碘
蒸馏
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
