永春二中2018-2019学年度高二年下学期化学期中考试卷
文档属性
| 名称 | 永春二中2018-2019学年度高二年下学期化学期中考试卷 |

|
|
| 格式 | zip | ||
| 文件大小 | 145.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-01 16:32:22 | ||
图片预览



文档简介
永春二中2018-2019学年度高二年下学期化学期中考试卷
《物质结构与性质》
命题者:康碧霞 审题者:李瑞长
注意:在本试卷上作答无效,应在答题卡各题指定的答题区域内作答。
一、单选题(本大题共30小题,共60分)
提出原子结构“有核模型”,被人们称为“原子之父”的科学家是( )
A. 道尔顿 B. 卢瑟福 C. 玻尔 D. 门捷列夫
已知元素X的原子最外层电子排布为 ns nnp n+2,则X元素的原子序数为( )
A. 7 B. 8 C. 9 D. 10
下列说法正确的是( )
A. 用乙醇或CCl4提取碘水中的碘单质
B. NaCl和SiC晶体熔化时,克服粒子间作用力类型相同
C. 24Mg32S晶体中电子总数与中子总数之比为1:1
D. H2S与SiF4分子中各原子最外层都满足8电子结构
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性.下列有关分析正确的是( )
A. K3C60中只有离子键 B. K3C60中不含共价键
C. 该晶体在熔融状态下能导电 D. C60与12C互为同素异形体
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A. X的简单氢化物的热稳定性比W强
B. Y的简单离子与X的简单离子具有相同的电子层结构
C. Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
D. Z与X属于同一主族,与Y属于同一周期
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
下列说法正确的是( )
A. 离子化合物中可能含有共价键,但不一定含有金属元素
B. 分子中一定含有共价键
C. 非极性分子中一定存在非极性键
D. 对于组成结构相似的分子,一定是相对分子质量越大,熔沸点越高
根据杂化轨道理论判断下列分子的空间构型是V形的是( )
A. BeCl2 B. H2O C. HCHO D. CS2
下列递变规律不正确的是( )
A. Na、Mg、Al还原性依次减弱 B. I2、Br2、Cl2氧化性依次增强
C. 原子半径:F<Mg<K D. 稳定性:PH3>H2S>HCl
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1?mol?P4S3分子中含有9?mol共价键
下列性质可以证明某化合物内一定存在离子键的是( )
A. 可溶于水 B. 熔融状态能导电
C. 水溶液能导电 D. 具有较高熔点
下列中心原子的杂化轨道类型和分子几何构型均不正确的是( )
A. CCl4中C原子sp3杂化,为正四面体形
B. BF3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
下列说法正确的是( )
A. CaCl2晶体中存在共价键
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D. I2是分子晶体,加热升华过程中只需克服分子间作用力
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
A. 非金属性:Z<Y<X
B. R与Y的电子数相差8
C. 气态氢化物稳定性:HR<HY<HT
D. 最高价氧化物的水化物的酸性:HTO4>HYO4
下列物质的性质与氢键无关的是( )
A. NH3分子比PH3分子稳定 B. 通常情况NH3极易溶于水
C. 氨易液化 D. H2O的沸点比H2S的沸点高
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.根据如表所列数据判断,错误的是( )
元素 I1 I2 I3 I4
X 500 4600 6900 9500
Y 580 1800 2700 11600
A. 元素X的常见化合价是+1价
B. 元素Y是IIIA族元素
C. 若元素Y处于第3周期,它的单质可与冷水剧烈反应
D. 元素X与氯元素形成化合物时,化学式可能是XCl
下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl2?? ②NCl3 ? ③PCl3 ? ④COCl2? ?⑤SF6
⑥XeF2??? ⑦CS2?? ⑧CH4??? ⑨CF2Cl2 ⑩S2Cl2.
A. ②④⑦⑧⑨⑩ B. ②③④⑦⑨⑩ C. ①③④⑦⑩ D. ③④⑤⑦⑨⑩
关于下列粒子的描述不正确的是( )
A. PH3的电子式为,其热稳定性不如NH3
B. HS-的电子式为,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为,是分子结构呈四面体的分子
D. KF的电子式为K+,它是易溶于水的离子化合物
有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
A. 原子序数:A>B>C>D B. 离子半径:A+>B2+>C->D2-
C. 氢化物稳定性:H2D>HC D. 金属性:A>B
下列物质中,含有非极性键的共价化合物是( )
A. Na2O2 B. CH3CH3 C. NaCl D. N2
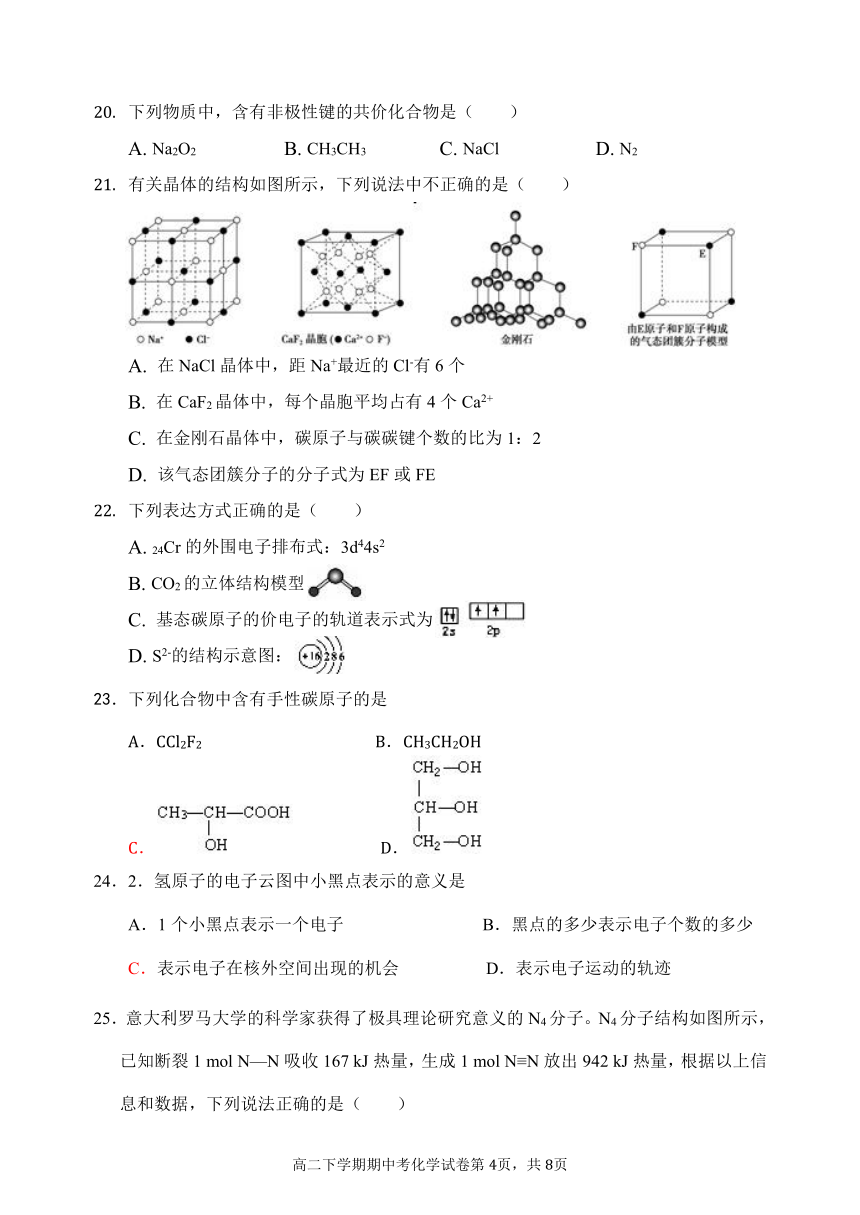
有关晶体的结构如图所示,下列说法中不正确的是( )
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D. 该气态团簇分子的分子式为EF或FE
下列表达方式正确的是( )
A. 24Cr的外围电子排布式:3d44s2
B. CO2的立体结构模型
C. 基态碳原子的价电子的轨道表示式为
D. S2-的结构示意图:
23.下列化合物中含有手性碳原子的是
A.CCl2F2 B.CH3CH2OH
C. D.
24.2.氢原子的电子云图中小黑点表示的意义是
A.1个小黑点表示一个电子 B.黑点的多少表示电子个数的多少
C.表示电子在核外空间出现的机会 D.表示电子运动的轨迹
25.意大利罗马大学的科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942 kJ热量,根据以上信息和数据,下列说法正确的是( )
A.N4属于一种新型的化合物
B.N4与N2互称为同位素
C.N2化学性质比N4稳定
D.1 mol N2气体转变为N4将放出441 kJ热量
26.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石
⑤晶体氖和晶体氮 ⑥硫磺和碘
A. ①②③ B. ④⑤⑥ C. ③④⑥ D. ①③⑤
27.现有四种元素基态原子电子排布式如下,则下列有关比较中正确的是( )
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。
A.第一电离能:④>③>②>① B.原子半径:②>①>④>③
C.电负性:④>③>②>① D.最高正化合价:④>①>③=②
28.科学家发现钇钡铜氧化合物在90 K时即具超导性,该化合物的晶胞结构如图所示:
该化合物以Y2O3、BaCO3和CuO为原料,经研磨烧结而成,其原料配比为( )
A.1∶1∶1 B.1∶2∶3 C.1∶4∶6 D.2∶2∶3
29.下列说法错误的是 ( )
A.ns电子的能量不一定高于(n-1)p电子的能量
B.6C的电子排布式1s22s22px2违反了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
30.已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等
电子原理”。根据等电子原理,下列各组粒子结构不相似的是
A.BCl3和PH3 B.NH和CH4 C.NO和CO D.CO2和N2O
二、填空题(本大题共5小题,共40.0分)
31.氮、磷、硫、氯的化合物种类繁多,应用广泛.
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序
是 _____ 。
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、______
和 _____ 。
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是 _____ ;碳原子采取sp杂化,
1mol该物质中含有的π键数目为 ______ 。
②H2O2常温下是液体,沸点较高(150℃),其主要原因
是 ______ 。
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物 质中S原子的轨道杂化方式是 ______ ,该分子属于极性?分子.
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。
(5)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是 ????????? ;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是 ?????? (填“A”或“B”),(水为极性分子,依据相似相溶原理判断)。
A B
32.(14分)(1)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是 ; 只含有离子键的是 ;
既含有非极性键又含有极性键的是 ;
含有非极性键的离子化合物是 ;
(2)某元素原子的价电子排布式为4s24p4,它在周期表中的位置是___________________
(3)Fe3+基态核外电子排布式为__________________
(4)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p3,该元素基态原子的价电子轨道表示式为_______________________
(5)镍和镧形成的一种合金具有储氢功能,该合金储氢后的晶胞如下图所示:
基态Ni原子的电子排布式为_________,1 mol 镧形成的该合金能储存_______mol氢气。
33.(16分)
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g) Ni(CO)4(g) ②Ni(CO)4(g) Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有________(填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小
C、O、Ni元素的电负性由大到小排列顺序为______________。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为 。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(5)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______FeO(填“<”或“>”);
32.(共14分)
(1)①;④;⑤;⑥(各1分) (2)第四周期ⅥA族
[Ar]3d5或1s22s22p63s23p63d5
(5)1s22s22p63s23p63d84s2或[Ar]3d84s2 (2分) 3(2分)
33.(16分)
(1)BD (2分) (2)H2O >CH4 (2分)(3)O>C>Ni (2分)
(4)sp3 (2分) (5)> (2分)
高二下学期期中考化学试卷第6页,共6页
高二下学期期中考化学试卷第8页,共8页
《物质结构与性质》
命题者:康碧霞 审题者:李瑞长
注意:在本试卷上作答无效,应在答题卡各题指定的答题区域内作答。
一、单选题(本大题共30小题,共60分)
提出原子结构“有核模型”,被人们称为“原子之父”的科学家是( )
A. 道尔顿 B. 卢瑟福 C. 玻尔 D. 门捷列夫
已知元素X的原子最外层电子排布为 ns nnp n+2,则X元素的原子序数为( )
A. 7 B. 8 C. 9 D. 10
下列说法正确的是( )
A. 用乙醇或CCl4提取碘水中的碘单质
B. NaCl和SiC晶体熔化时,克服粒子间作用力类型相同
C. 24Mg32S晶体中电子总数与中子总数之比为1:1
D. H2S与SiF4分子中各原子最外层都满足8电子结构
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性.下列有关分析正确的是( )
A. K3C60中只有离子键 B. K3C60中不含共价键
C. 该晶体在熔融状态下能导电 D. C60与12C互为同素异形体
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A. X的简单氢化物的热稳定性比W强
B. Y的简单离子与X的简单离子具有相同的电子层结构
C. Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
D. Z与X属于同一主族,与Y属于同一周期
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
下列说法正确的是( )
A. 离子化合物中可能含有共价键,但不一定含有金属元素
B. 分子中一定含有共价键
C. 非极性分子中一定存在非极性键
D. 对于组成结构相似的分子,一定是相对分子质量越大,熔沸点越高
根据杂化轨道理论判断下列分子的空间构型是V形的是( )
A. BeCl2 B. H2O C. HCHO D. CS2
下列递变规律不正确的是( )
A. Na、Mg、Al还原性依次减弱 B. I2、Br2、Cl2氧化性依次增强
C. 原子半径:F<Mg<K D. 稳定性:PH3>H2S>HCl
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1?mol?P4S3分子中含有9?mol共价键
下列性质可以证明某化合物内一定存在离子键的是( )
A. 可溶于水 B. 熔融状态能导电
C. 水溶液能导电 D. 具有较高熔点
下列中心原子的杂化轨道类型和分子几何构型均不正确的是( )
A. CCl4中C原子sp3杂化,为正四面体形
B. BF3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
下列说法正确的是( )
A. CaCl2晶体中存在共价键
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D. I2是分子晶体,加热升华过程中只需克服分子间作用力
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
A. 非金属性:Z<Y<X
B. R与Y的电子数相差8
C. 气态氢化物稳定性:HR<HY<HT
D. 最高价氧化物的水化物的酸性:HTO4>HYO4
下列物质的性质与氢键无关的是( )
A. NH3分子比PH3分子稳定 B. 通常情况NH3极易溶于水
C. 氨易液化 D. H2O的沸点比H2S的沸点高
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.根据如表所列数据判断,错误的是( )
元素 I1 I2 I3 I4
X 500 4600 6900 9500
Y 580 1800 2700 11600
A. 元素X的常见化合价是+1价
B. 元素Y是IIIA族元素
C. 若元素Y处于第3周期,它的单质可与冷水剧烈反应
D. 元素X与氯元素形成化合物时,化学式可能是XCl
下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl2?? ②NCl3 ? ③PCl3 ? ④COCl2? ?⑤SF6
⑥XeF2??? ⑦CS2?? ⑧CH4??? ⑨CF2Cl2 ⑩S2Cl2.
A. ②④⑦⑧⑨⑩ B. ②③④⑦⑨⑩ C. ①③④⑦⑩ D. ③④⑤⑦⑨⑩
关于下列粒子的描述不正确的是( )
A. PH3的电子式为,其热稳定性不如NH3
B. HS-的电子式为,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为,是分子结构呈四面体的分子
D. KF的电子式为K+,它是易溶于水的离子化合物
有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
A. 原子序数:A>B>C>D B. 离子半径:A+>B2+>C->D2-
C. 氢化物稳定性:H2D>HC D. 金属性:A>B
下列物质中,含有非极性键的共价化合物是( )
A. Na2O2 B. CH3CH3 C. NaCl D. N2
有关晶体的结构如图所示,下列说法中不正确的是( )
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D. 该气态团簇分子的分子式为EF或FE
下列表达方式正确的是( )
A. 24Cr的外围电子排布式:3d44s2
B. CO2的立体结构模型
C. 基态碳原子的价电子的轨道表示式为
D. S2-的结构示意图:
23.下列化合物中含有手性碳原子的是
A.CCl2F2 B.CH3CH2OH
C. D.
24.2.氢原子的电子云图中小黑点表示的意义是
A.1个小黑点表示一个电子 B.黑点的多少表示电子个数的多少
C.表示电子在核外空间出现的机会 D.表示电子运动的轨迹
25.意大利罗马大学的科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942 kJ热量,根据以上信息和数据,下列说法正确的是( )
A.N4属于一种新型的化合物
B.N4与N2互称为同位素
C.N2化学性质比N4稳定
D.1 mol N2气体转变为N4将放出441 kJ热量
26.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石
⑤晶体氖和晶体氮 ⑥硫磺和碘
A. ①②③ B. ④⑤⑥ C. ③④⑥ D. ①③⑤
27.现有四种元素基态原子电子排布式如下,则下列有关比较中正确的是( )
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。
A.第一电离能:④>③>②>① B.原子半径:②>①>④>③
C.电负性:④>③>②>① D.最高正化合价:④>①>③=②
28.科学家发现钇钡铜氧化合物在90 K时即具超导性,该化合物的晶胞结构如图所示:
该化合物以Y2O3、BaCO3和CuO为原料,经研磨烧结而成,其原料配比为( )
A.1∶1∶1 B.1∶2∶3 C.1∶4∶6 D.2∶2∶3
29.下列说法错误的是 ( )
A.ns电子的能量不一定高于(n-1)p电子的能量
B.6C的电子排布式1s22s22px2违反了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
30.已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等
电子原理”。根据等电子原理,下列各组粒子结构不相似的是
A.BCl3和PH3 B.NH和CH4 C.NO和CO D.CO2和N2O
二、填空题(本大题共5小题,共40.0分)
31.氮、磷、硫、氯的化合物种类繁多,应用广泛.
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序
是 _____ 。
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、______
和 _____ 。
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是 _____ ;碳原子采取sp杂化,
1mol该物质中含有的π键数目为 ______ 。
②H2O2常温下是液体,沸点较高(150℃),其主要原因
是 ______ 。
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物 质中S原子的轨道杂化方式是 ______ ,该分子属于极性?分子.
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。
(5)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是 ????????? ;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是 ?????? (填“A”或“B”),(水为极性分子,依据相似相溶原理判断)。
A B
32.(14分)(1)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是 ; 只含有离子键的是 ;
既含有非极性键又含有极性键的是 ;
含有非极性键的离子化合物是 ;
(2)某元素原子的价电子排布式为4s24p4,它在周期表中的位置是___________________
(3)Fe3+基态核外电子排布式为__________________
(4)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p3,该元素基态原子的价电子轨道表示式为_______________________
(5)镍和镧形成的一种合金具有储氢功能,该合金储氢后的晶胞如下图所示:
基态Ni原子的电子排布式为_________,1 mol 镧形成的该合金能储存_______mol氢气。
33.(16分)
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g) Ni(CO)4(g) ②Ni(CO)4(g) Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有________(填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小
C、O、Ni元素的电负性由大到小排列顺序为______________。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为 。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(5)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______FeO(填“<”或“>”);
32.(共14分)
(1)①;④;⑤;⑥(各1分) (2)第四周期ⅥA族
[Ar]3d5或1s22s22p63s23p63d5
(5)1s22s22p63s23p63d84s2或[Ar]3d84s2 (2分) 3(2分)
33.(16分)
(1)BD (2分) (2)H2O >CH4 (2分)(3)O>C>Ni (2分)
(4)sp3 (2分) (5)> (2分)
高二下学期期中考化学试卷第6页,共6页
高二下学期期中考化学试卷第8页,共8页
