粤教版九下化学 6.3金属矿物与冶炼 课件(18张PPT)
文档属性
| 名称 | 粤教版九下化学 6.3金属矿物与冶炼 课件(18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 320.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-03 10:13:01 | ||
图片预览




文档简介
课件18张PPT。 6.3金属矿物与冶炼
(第1课时)
【教学目标】
1.知识与技能
(1)知道元素有两种存在形态,认识几种金属矿物;
(2)了解钢铁是怎样炼成的,认识还原反应及物质的还原性;
(3)了解冶炼金属的常用方法;
(4)初步学会关于不纯物的化学计算。
2.过程与方法:讲述、实验探讨。
3.情感态度与价值观:体验炼钢的艰辛,珍惜美好生活。
【教学重点】炼钢;有关化学方程式的计算。
【教学难点】氧化-还原反应;化学方程式中含杂质的计算。
【教具学具】实验室常见仪器
【课时安排】2课时
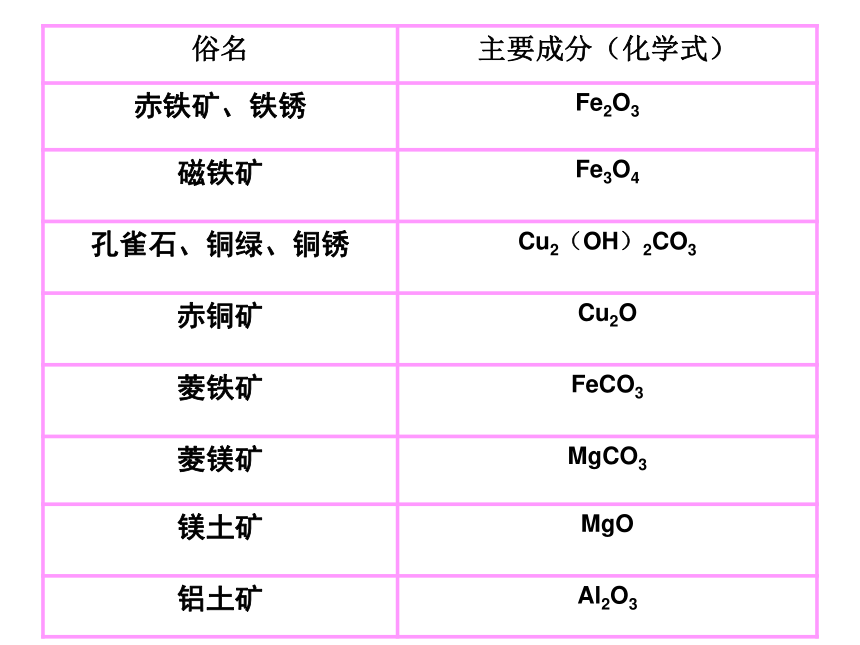
【教学设计】6.3 金属矿物与冶炼一、元素的存在形态1、游离态:2、化合态:元素以单质形态存在的状态元素以化合物形态存在的状态少多二、常见的金属矿物孔雀石(主要成分为Cu2(OH)2CO3)自然金
(主要成分为Au)银 磁铁矿
主要成分为Fe3O4 黄铁矿
主要成分是FeS2 菱铁矿主要成分是
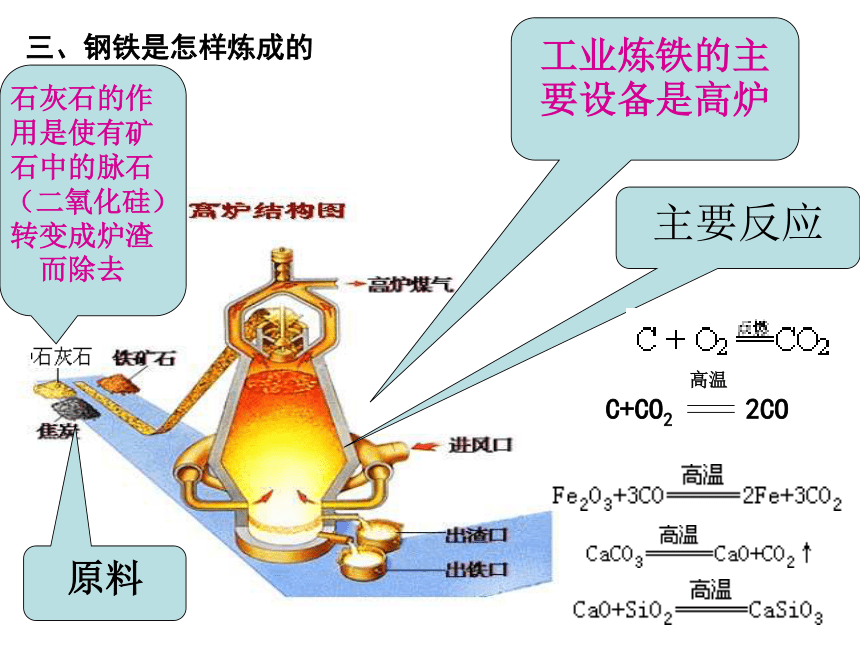
FeCO3 三、钢铁是怎样炼成的工业炼铁的主要设备是高炉主要反应石灰石的作用是使有矿石中的脉石(二氧化硅)转变成炉渣而除去原料1、生铁:铁的合金,含碳量在2℅~4.3℅之间,同时还有少
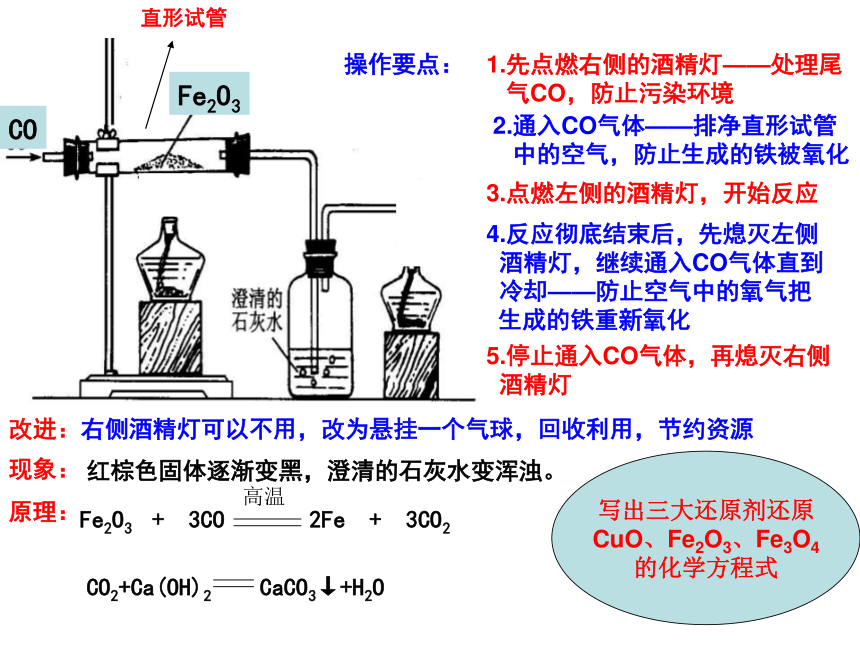
量的硫和磷,硬而脆,不利于加工。2、炼钢:在炼钢炉里吹进氧气(1)原则:降碳(C)除硫磷(S、P)调硅锰(Si、Mn)(2)含碳(C)量在0.03℅~2℅低C钢:含碳0.03℅~0.25℅中C钢:含碳0.25℅~0.6℅高C钢:含碳0.6℅~2℅{(4)性能好,硬而韧,有弹性,可铸可锻。(3)成分:主要是铁(Fe)和碳(C)的合金3、炼铁的原理及实验装置图:解
决1.先点燃右侧的酒精灯——处理尾
气CO,防止污染环境2.通入CO气体——排净直形试管
中的空气,防止生成的铁被氧化4.反应彻底结束后,先熄灭左侧
酒精灯,继续通入CO气体直到
冷却——防止空气中的氧气把
生成的铁重新氧化3.点燃左侧的酒精灯,开始反应5.停止通入CO气体,再熄灭右侧
酒精灯改进:右侧酒精灯可以不用,改为悬挂一个气球,回收利用,节约资源操作要点:现象:红棕色固体逐渐变黑,澄清的石灰水变浑浊。原理:写出三大还原剂还原
CuO、Fe2O3、Fe3O4
的化学方程式1.活泼金属(如K Ca Na Mg AI)
电解法: 2AI2O3 = 4AI+3O2
2.一般金属(如Zn Fe Sn Pb Cu)
热还原法: Fe2O3+3CO = 2Fe+3CO2
3.较稳定金属(如Hg)
直接加热法: 2HgO = 2Hg+O2
4.稳定金属(如Ag Pt Au) : 直接以单质形式存在
通电高温加热四、冶炼金属的常用方法:例.若要炼制含铁量为90%的生铁100吨,需要含氧化铁
70%的赤铁矿多少吨?
五、含杂质的计算解:设需要含氧化铁70%的赤铁矿 X,则
160 2×5670 % X 100t×90%解,得 X≈184t
答:需要含氧化铁70%的赤铁矿约184吨。
【反馈评价】
1. 生铁和钢的主要区别是( )
A、生铁含杂质,钢不含杂质 B、生铁含碳,钢不含碳
C、生铁不含碳,钢含碳
D、生铁中含碳 2%—4.3% ,钢中含碳 0.03%—2%
2. 下列物质的颜色不是黑色的是( )
A、Fe2O3 B、Fe3O4 C、MnO2 D、CuO
3. 在高炉炼铁的反应中,CO 是( )
A、氧化剂 B、还原剂 C、氧化剂 D、提高炉温
4. 下列物质前者是混合物,后者是纯净物的是( )
A、铁矿石、天然气 B、铜、生铁
C、铁、不锈钢 D、钢、氧化铁
5. 含氧化铁 80% 的赤铁矿,铁元素的质量分数是( )
A、63% B、56% C、70% D、80% DABDB6. 某钢铁厂高炉炼铁的主要反应过程如下:
(1) 请在方框内填入相应物质的化学式。
(2) 写出步骤 ①②③ 的化学方程式:
① ________________________ _____
② ______________________ ______
③ _____________________________ 。 CO2CO分析还原反应的原理
H2+CuO = Cu+H2O
H2:得到氧,被氧化,发生氧化反应,
具有还原性,是还原剂
CuO:失去氧,被还原,发生还原反应,
具有氧化性,是氧化剂
还原反应:含氧化合物失去氧的反应。
还原性:能夺取含氧化合物里的氧,使它
发生还原反应的物质具有还原性。高温实验:氢气还原氧化铜
H2+CuO = Cu+H2O加热对金属而言:
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质.
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质.
3CO+Fe2O3 = 2Fe+3CO2
讨论:
①发生还原反应的物质是谁?
②哪种物质具有还原性?
③哪种物质是氧化剂?还原剂?高温具有还原性的物质:
H2 C CO
问题:请写出H2和C还原Fe2O3的化
学方程式
3H2+Fe2O3= 2Fe+3H2O
3C+2Fe2O3 = 4Fe+3CO2高温高温 根据氢气还原氧化铜的实验,分析一氧化碳与氧化铁反应的实验步骤,反应现象,并设计改进装置.
(第1课时)
【教学目标】
1.知识与技能
(1)知道元素有两种存在形态,认识几种金属矿物;
(2)了解钢铁是怎样炼成的,认识还原反应及物质的还原性;
(3)了解冶炼金属的常用方法;
(4)初步学会关于不纯物的化学计算。
2.过程与方法:讲述、实验探讨。
3.情感态度与价值观:体验炼钢的艰辛,珍惜美好生活。
【教学重点】炼钢;有关化学方程式的计算。
【教学难点】氧化-还原反应;化学方程式中含杂质的计算。
【教具学具】实验室常见仪器
【课时安排】2课时
【教学设计】6.3 金属矿物与冶炼一、元素的存在形态1、游离态:2、化合态:元素以单质形态存在的状态元素以化合物形态存在的状态少多二、常见的金属矿物孔雀石(主要成分为Cu2(OH)2CO3)自然金
(主要成分为Au)银 磁铁矿
主要成分为Fe3O4 黄铁矿
主要成分是FeS2 菱铁矿主要成分是
FeCO3 三、钢铁是怎样炼成的工业炼铁的主要设备是高炉主要反应石灰石的作用是使有矿石中的脉石(二氧化硅)转变成炉渣而除去原料1、生铁:铁的合金,含碳量在2℅~4.3℅之间,同时还有少
量的硫和磷,硬而脆,不利于加工。2、炼钢:在炼钢炉里吹进氧气(1)原则:降碳(C)除硫磷(S、P)调硅锰(Si、Mn)(2)含碳(C)量在0.03℅~2℅低C钢:含碳0.03℅~0.25℅中C钢:含碳0.25℅~0.6℅高C钢:含碳0.6℅~2℅{(4)性能好,硬而韧,有弹性,可铸可锻。(3)成分:主要是铁(Fe)和碳(C)的合金3、炼铁的原理及实验装置图:解
决1.先点燃右侧的酒精灯——处理尾
气CO,防止污染环境2.通入CO气体——排净直形试管
中的空气,防止生成的铁被氧化4.反应彻底结束后,先熄灭左侧
酒精灯,继续通入CO气体直到
冷却——防止空气中的氧气把
生成的铁重新氧化3.点燃左侧的酒精灯,开始反应5.停止通入CO气体,再熄灭右侧
酒精灯改进:右侧酒精灯可以不用,改为悬挂一个气球,回收利用,节约资源操作要点:现象:红棕色固体逐渐变黑,澄清的石灰水变浑浊。原理:写出三大还原剂还原
CuO、Fe2O3、Fe3O4
的化学方程式1.活泼金属(如K Ca Na Mg AI)
电解法: 2AI2O3 = 4AI+3O2
2.一般金属(如Zn Fe Sn Pb Cu)
热还原法: Fe2O3+3CO = 2Fe+3CO2
3.较稳定金属(如Hg)
直接加热法: 2HgO = 2Hg+O2
4.稳定金属(如Ag Pt Au) : 直接以单质形式存在
通电高温加热四、冶炼金属的常用方法:例.若要炼制含铁量为90%的生铁100吨,需要含氧化铁
70%的赤铁矿多少吨?
五、含杂质的计算解:设需要含氧化铁70%的赤铁矿 X,则
160 2×5670 % X 100t×90%解,得 X≈184t
答:需要含氧化铁70%的赤铁矿约184吨。
【反馈评价】
1. 生铁和钢的主要区别是( )
A、生铁含杂质,钢不含杂质 B、生铁含碳,钢不含碳
C、生铁不含碳,钢含碳
D、生铁中含碳 2%—4.3% ,钢中含碳 0.03%—2%
2. 下列物质的颜色不是黑色的是( )
A、Fe2O3 B、Fe3O4 C、MnO2 D、CuO
3. 在高炉炼铁的反应中,CO 是( )
A、氧化剂 B、还原剂 C、氧化剂 D、提高炉温
4. 下列物质前者是混合物,后者是纯净物的是( )
A、铁矿石、天然气 B、铜、生铁
C、铁、不锈钢 D、钢、氧化铁
5. 含氧化铁 80% 的赤铁矿,铁元素的质量分数是( )
A、63% B、56% C、70% D、80% DABDB6. 某钢铁厂高炉炼铁的主要反应过程如下:
(1) 请在方框内填入相应物质的化学式。
(2) 写出步骤 ①②③ 的化学方程式:
① ________________________ _____
② ______________________ ______
③ _____________________________ 。 CO2CO分析还原反应的原理
H2+CuO = Cu+H2O
H2:得到氧,被氧化,发生氧化反应,
具有还原性,是还原剂
CuO:失去氧,被还原,发生还原反应,
具有氧化性,是氧化剂
还原反应:含氧化合物失去氧的反应。
还原性:能夺取含氧化合物里的氧,使它
发生还原反应的物质具有还原性。高温实验:氢气还原氧化铜
H2+CuO = Cu+H2O加热对金属而言:
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质.
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质.
3CO+Fe2O3 = 2Fe+3CO2
讨论:
①发生还原反应的物质是谁?
②哪种物质具有还原性?
③哪种物质是氧化剂?还原剂?高温具有还原性的物质:
H2 C CO
问题:请写出H2和C还原Fe2O3的化
学方程式
3H2+Fe2O3= 2Fe+3H2O
3C+2Fe2O3 = 4Fe+3CO2高温高温 根据氢气还原氧化铜的实验,分析一氧化碳与氧化铁反应的实验步骤,反应现象,并设计改进装置.
